鼻咽癌來源的細胞外囊泡miR-144刺激血管生成

越來越多的證據表明細胞外囊泡(EVs)通過促進實體腫瘤中腫瘤-內皮細胞之間的通訊來刺激血管生成。先前的研究表明miR-144是鼻咽癌(NPC)細胞來源的EVs中的內含物之一,但EVs miR-144對腫瘤內皮細胞和血管生成的影響尚不清楚。2021年3月發表于“Molecular Therapy”(IF=11.454)的文章“miR-144 delivered by nasopharyngeal carcinoma-derived EVs stimulates angiogenesis through the FBXW7/HIF-1a/VEGF-A axis”對此展開了研究。本研究旨在探討腫瘤源性細胞外囊泡(EVs)在鼻咽癌血管生成中的作用。我們初步采集鼻咽癌活檢標本。將人臍靜脈內皮細胞(HUVECs)與鼻咽癌細胞分離的EVs共培養后,通過Transwell室系統和matrigel基血管生成實驗評估其遷移、侵襲和血管樣管形成。使用體內Matrigel血管生成模型檢測EVs的促血管生成活性以及候選microRNA 。結果表明,與鼻咽癌正常組織相比,鼻咽癌組織中miR-144水平上調,且與CD31的表達呈正相關。此外,miR-144在鼻咽癌細胞EVs中高度富集,最終增強HUVECs和血管樣管在體內和體外的遷移和侵襲。值得注意的是,miR-144通過抑制靶基因FBXW7和促進轉錄因子HIF1α依賴的血管內皮生長因子(VEGF-A)。綜上所述,本研究強調了miR-144作為鼻咽癌腫瘤發生中細胞外促血管生成介質的作用。
技術路線
結果:
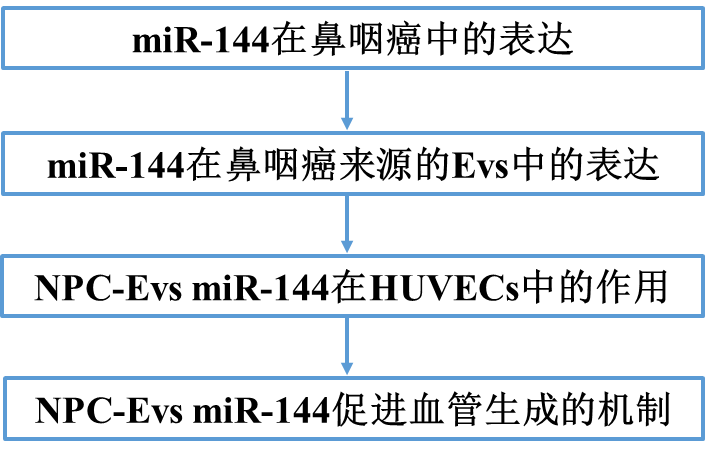
1)miR-144在鼻咽癌組織和細胞中上調
先前的文獻強調了miR-144在NPC發展過程中的促癌作用。我們首先確定miR-144在NPC中的表達模式。采用qRT-PCR方法分析95例鼻咽癌活檢標本和95例慢性鼻咽炎鼻咽活檢標本中miR-144的表達。結果表明,miR-144在鼻咽癌組織中的表達水平高于在非癌性鼻咽組織中的表達水平(圖1A),并通過原位雜交(ISH)進一步驗證(圖1B)。如圖1C所示,相對于非癌性鼻咽組織,鼻咽癌組織中CD31的免疫組化染色增強。在鼻咽癌組織中,CD31的表達與miR-144的表達呈正相關(圖1D)。隨后,我們通過qRT-PCR比較了人鼻咽癌細胞系(C666-1和SUNE1)和鼻咽上皮細胞系NP69之間miR-144的表達水平。與預期的一樣,C666-1和SUNE1細胞表現出相對于NP69更高水平的miR-144表達(圖1E)。以上結果提示,miR144在鼻咽癌組織和細胞中呈高表達,與CD31表達呈正相關,表明miR144與腫瘤血管生成具有潛在的相關性。
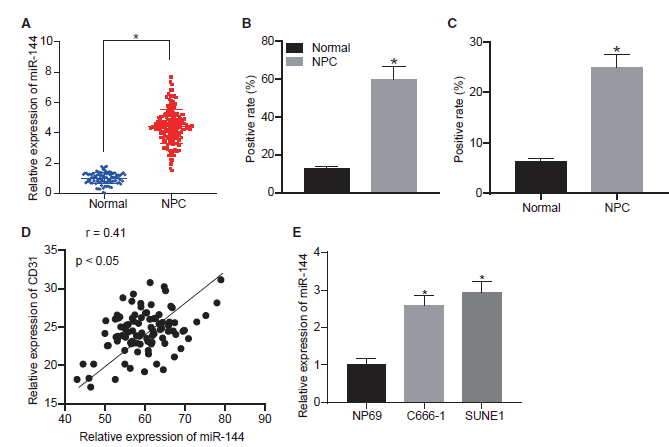
2)miR-144在鼻咽癌細胞釋放的EVs中高度富集
接下來,為了確定腫瘤分泌的miR-144是否具有通過EVs細胞外通信影響腫瘤-微環境串擾的能力,我們首先從C666-1、SUNE1和NP69細胞中分離EVs。透射電子顯微鏡(TEM)觀察發現,納米顆粒的直徑為30 ~ 100 nm,每個囊泡呈杯狀(圖2A)。免疫印跡顯示,與相應的細胞裂解液相比,這些來自C666-1、SUNE1和NP69細胞的納米顆粒中存在常見的EVs特異性標記物,包括CD9、CD63和TSG101,而內質網膜蛋白calnexin明顯缺失(圖2B)。納米顆粒示蹤分析(NTA)進一步顯示EV的平均直徑為94.1 nm (C666-1細胞)、90.5 nm (SUNE1細胞)和68.5 nm (NP69細胞)(圖2C)。此外,我們檢測了C666-1、SUNE1和NP69細胞衍生EVs的表面電荷(圖2D)。添加RNase對這三種細胞系的EVs中miR-144的表達沒有影響,而Triton X-100處理的細胞中miR-144的表達明顯降低,說明細胞膜對miR-144的表達具有保護作用(圖2E)。結果表明,這三種細胞系的EVs具有穩定的膜態,對RNA具有保護作用。通過qRT-PCR檢測EVs中miR-144的表達,結果顯示miR-144在鼻咽癌細胞EVs中表達高水平(圖2F)。這些發現為miR-144在npc細胞來源的ev中上調提供了證據。

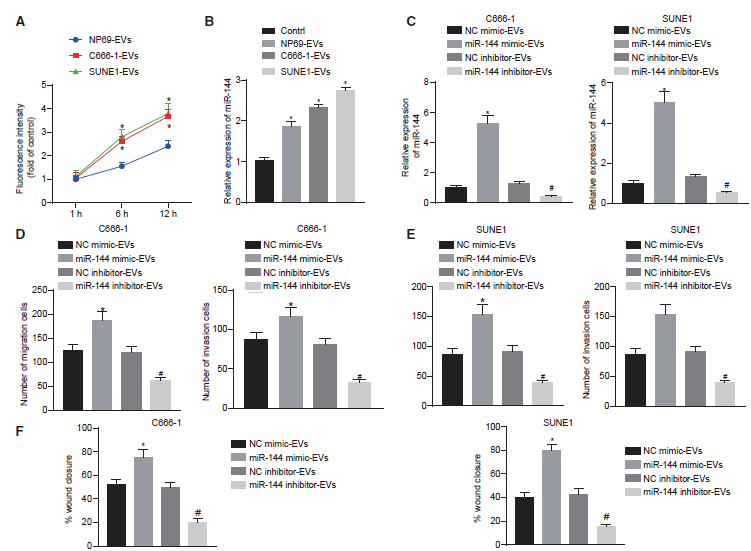
3)miR-144通過EVs從鼻咽癌細胞進入HUVECs,增強了HUVECs的遷移和侵襲
既往文獻證實血管生成需要內皮細胞的遷移和成管能力。因此,我們試圖研究NPC-EVs分泌的miR144對HUVECs遷移和侵襲的影響,以闡明腫瘤分泌的miR-144在血管生成中的作用。首先,在熒光顯微鏡下觀察HUVECs在不同時間點對PKH67標記EVs的攝取。結果證實了HUVECs細胞質中存在PKH67信號,提示HUVECs已被HUVECs內吞。隨著時間的推移,與NP69-EV組相比,C666-1-EV組和SUNE1-EV組的HUVECs逐步表現出更大程度的EV內化(圖3A)。qRT-PCR結果顯示miR-144在經C666-1和SUNE1釋放的EVs處理的HUVECs中的表達較高(圖3B)。為了進一步證明鼻咽癌細胞分泌的EVs miR-144對內皮細胞的影響,我們轉染了C666-1和SUNE1細胞系,然后提取EV。qRT-PCR結果表明,暴露于miR-144模擬物處理的鼻咽癌細胞的HUVECs中miR-144上調,而暴露于miR-144 inhibitor處理的鼻咽癌細胞的HUVECs中miR-144下調(圖3C)。Transwell實驗結果表明,miR-144過表達EVs足以增強HUVECs的遷移和侵襲,而miR-144抑制EVs則表現出相反的趨勢(圖3D和3E)。此外,我們還通過傷口愈合實驗檢測HUVECs的增殖和遷移能力(圖3F)。結果顯示,與NC模擬EV組相比,miR-144模擬EV組細胞的創面愈合率升高,說明C666-1-和SUNE1細胞來源的EV miR-144均促進HUVECs的增殖和遷移。與NC抑制EV組相比,miR-144抑制EV組的細胞創面愈合率降低,提示C666-1-和SUNE1 EV細胞EV miR-144抑制后,HUVECs的增殖和遷移受到抑制。
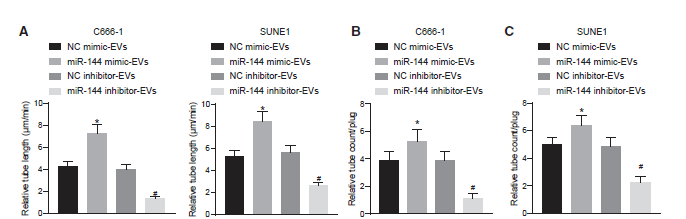
4)NPC-EVs通過轉染miR-144增強體外和體內HUVECs的血管樣管形成
我們評估NPC-EVs來源的miR-144對HUVECs血管樣管結構的影響,以闡明腫瘤分泌的miR-144在血管生成中的作用。基于基質膠的體外血管生成實驗(圖4A)表明,miR-144模擬物處理的鼻咽癌細胞EVs顯著促進了體外HUVECs的血管樣管形成,這與miR-144抑制劑處理的鼻咽癌細胞EVs的結果形成了鮮明對比。接下來,為了進一步證明NPC-EVs來源的miR-144的促血管生成活性,我們在裸鼠中進行了體內Matrigel實驗,以鑒定移植凝膠栓中新形成的血管(圖4B和4C)。我們發現,來自miR-144模擬處理的鼻咽癌細胞的EVs增強了凝膠塞中新形成的增強血管,而來自miR-144抑制劑處理的鼻咽癌細胞的EVs則降低了血管,這與體外基質凝膠血管生成實驗的結果一致。基于上述結果,NPC-EVs來源的miR-144增強了體外和體內HUVECs的血管樣管形成。
5)miR-144升高導致FBXW7下調,HIF-1α上調
近期研究表明,FBXW7在血管內皮細胞遷移和炎癥、內皮屏障完整性和血管生成中發揮重要作用。隨后,我們開始闡明miR-144在鼻咽癌中促血管生成功能的分子機制。我們預測了miR-144在3‘UTR FBXW7 mRNA的結合位點(圖5A)。與miR-144 模擬物共轉染后,FBXW7的野生型(WT)報告基因啟動子的熒光素酶活性低于突變型(MUT) 3’UTR (圖5B)。在mRNA水平和蛋白水平比較鼻咽癌組織和非癌性鼻咽組織中FBXW7的表達。如圖5C和5D所示,FBXW7在鼻咽癌組織中的mRNA和蛋白表達低于非癌性鼻咽組織。Pearson相關分析顯示,鼻咽癌組織中miR-144的表達與FBXW7的表達呈顯著負相關(圖5E)。我們還發現,相對于非癌性鼻咽組織,鼻咽癌組織中FBXW7的免疫組化染色程度下降(圖5F)。與NP69細胞相比,C666-1和SUNE1細胞FBXW7的mRNA和蛋白表達水平均低于NP69細胞(圖5G和5H)。既往研究表明,FBXW7/HIF-1α/ VEGF-A通路參與腫瘤血管生成。因此,我們假設miR-144的促血管生成功能是通過在癌變過程中調節FBXW7/HIF-1α/VEGF-A通路實現的。在本研究中,我們首先在mRNA水平和蛋白水平檢測暴露于鼻咽癌EVs的HUVECs中FBXW7和HIF-1α。而HUVECs上清中用酶聯免疫吸附試驗(ELISA)測定VEGF-A濃度(圖5I和5J)。結果顯示,暴露于miR-144模擬物的EVs中FBXW7的表達減少,而HUVECs上清液中HIF-1α和VEGFA的表達增加。miR-144抑制劑的引入導致EVs中FBXW7表達增加,HIF -1α表達減少,HUVECs上清VEGF-A濃度降低。此外, FBXW7過表達或HIF-1α沉默導致HUVECs上清中HIF-1α表達和VEGF-A濃度降低(圖5K和5L)。因此,miR-144可以靶向FBXW7,促進HIF-1α和VEGF-A的表達。

6)miR-144通過FBXW7/HIF-1α/ VEGF-A通路發揮促血管生成功能
我們確定NPC-EV來源的miR-144是否通過介導FBXW7/HIF-1α/VEGF-A通路促進HUVECs的血管樣管形成。免疫印跡分析結果表明,在miR-144抑制劑處理的鼻咽癌細胞來源的EVs中,si-FBXW7處理導致FBXW7表達下調,HIF-1α和VEGF-A表達升高。這表明miR-144對HIF-1α/VEGF-A通路的影響是以FBXW7依賴的方式發生的(圖6A)。同樣地,我們還發現與單獨抑制miR-144相比,聯合抑制miR-144和FBXW7后,HUVEC的遷移(圖6B)和侵襲(圖6C)增強,以及血管樣管形成(圖6D)增加,這表明miR-144在體外依賴于FBXW7的促血管生成功能。體內Matrigel栓試驗(圖6E和6F)顯示,與單獨抑制miR-144相比,包含miR144模擬物處理過的鼻咽癌細胞EVs的凝膠栓在miR-144和 FBXW7抑制聯合作用下,新形成的血管增強了,說明NPC-EV miR-144在體內依賴于FBXW7的促血管生成功能。

結論:總之,本研究的關鍵發現為EV來源的miR-144在體外鼻咽癌的進展中發揮促進作用提供了證據。具體來說,miR-144可以通過鼻咽癌細胞來源的EVs轉運到HUVECs,最終強化其惡性表型,為鼻咽癌基于EVs的生物標志物和治療方式的發展提供了一個新靶點。






