高轉移肝細胞癌外泌體S100A4通過激活STAT3促進腫瘤轉移
細胞間的相互作用在腫瘤進展和轉移中發揮關鍵作用。目前關于這些腫瘤細胞是如何與其他細胞相互交流的仍有很多是未知的。腫瘤釋放的外泌體被認為是腫瘤進行細胞間溝通的有效介質。Dong等探索了肝細胞癌(HCC)外泌體在其轉移和預后價值中的功能。本文于2021年6月發表在《Signal Transduction and Targeted Therapy》期刊上,IF:13.493。
技術路線:

主要實驗結果:
1、外泌體的分離與鑒定以及HCC細胞的釋放和吸收
使用投射電子顯微鏡觀察了外泌體的形態和形狀;納米粒子跟蹤分析發現外泌體直徑在40-200nm之間,并且在6個HCC細胞系外泌體中都檢測到了外泌體標志物CD63,CD9,和Alix的表達;然后使用DIO標記高轉移性HCC細胞的外泌體(HMH-exo)和低轉移性HCC細胞外泌體(LMH-exo),在激光掃描共焦顯微鏡下觀察到綠色標記的HMH-exo和LMH-exo都可以被低轉移性HCC細胞細胞系有效吸收(圖1)。這些結果表明已經成功分離和純化HCC來源的外泌體并且他們可以被其它HCC細胞吸收。
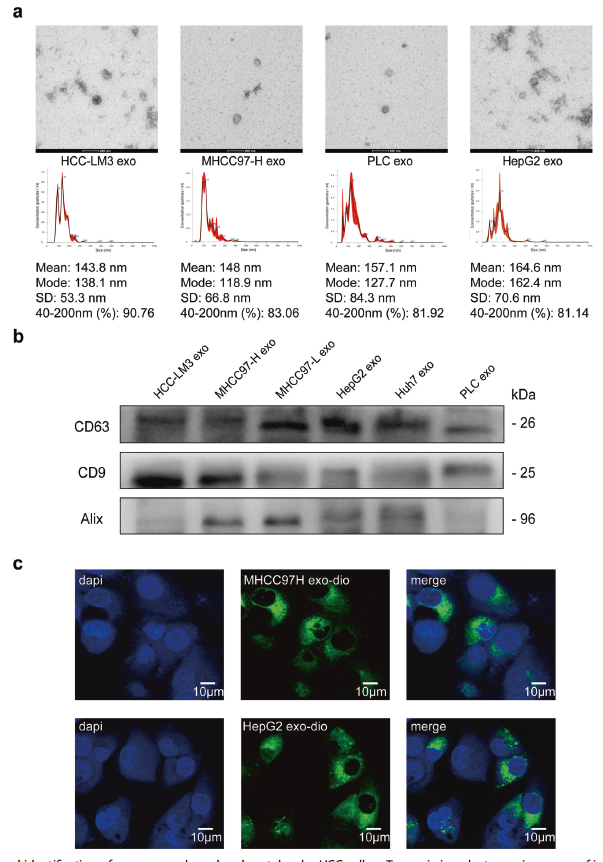
圖1外泌體的分離與鑒定以及HCC細胞的釋放和吸收
為了探究HCC轉移時外泌體在細胞與細胞串擾中的可能作用,作者實驗HMH-exo預處理低轉移性的HCC細胞系。結果發現,與LMH-exo或者PBS預處理組相比,HMH-exo顯著增強了低轉移性HCC細胞系的轉移能力;隨后作者使用低轉移性HCC細胞系構建了體內原位異種移植瘤模型,成瘤后使用外泌體治療6周,最后檢測肝臟腫瘤和肺轉移,結果顯示與其它組相比,HMH-exo組的肝臟腫瘤更大,肺轉移結節更多。(圖2)。這些結果表明HMH-exo可以在體內外增強低轉移性HCC細胞的轉移能力。

圖2 HMH-exo增強低轉移性HCC細胞系的轉移潛力
3、外泌體S100A4是HCC細胞轉移潛力的關鍵增強子
為了探究通過HMH-exo增強HCC轉移能力的關鍵,作者對LMH-exo和HMH-exo進行了iTRAQ質譜篩選。結果從HMH-exo中鑒定到116個顯著上調和43顯著下調的蛋白質;結果發現了4個蛋白家族的聚類:Apo、PSM、EEF/EIF和S100鈣結合蛋白家族(圖3a-b)。經過文獻分析,作者主要關注了S100鈣結合蛋白家族,并以其中最顯著差異表達的4個蛋白為主:依次是S100A4,S100A6,S100A10,和 S100A11。作者檢測了這4個蛋白在5個HCC細胞系外泌體中的表達豐度,結果發現依然是S100A4的表達水平最高(圖3c)。因此,初步選擇S100A4進行下一步分析。
進一步檢測S100A4的功能,結果顯示敲除S100A4顯著降低高轉移性HCC細胞系的遷移和侵襲能力,過表達S100A4則顯著增強低轉移性HCC細胞系的遷移和侵襲能力(圖3d)。然后作者收集了S100A4敲除和S100A4過表達的HCC細胞的外泌體,結果得到了類似的結論,S100A4過表達外泌體顯著增強HCC細胞的遷移和侵襲,以及體內肺部轉移的能力(圖3e-f)。這些結果證實了外泌體S100A4具有增強HCC細胞轉移潛力的功能。
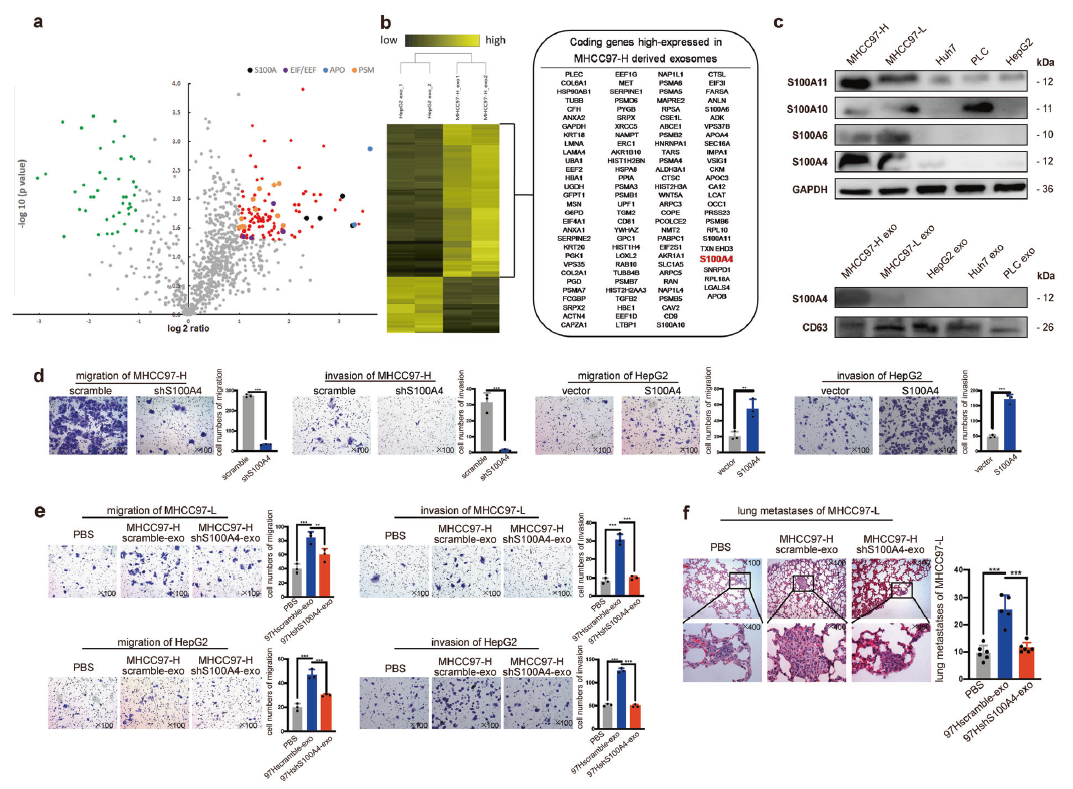
圖3外泌體S100A4是HCC細胞轉移潛力的關鍵增強子
4、外泌體S100A4通過STAT3磷酸化激活OPN轉錄
接下來探究了S100A4的作用機制,首先選擇了21個腫瘤干性相關基因,然后下載了GEO數據進行相關性分析,結果顯示S100A4主要和11個基因正相關(圖4a)。隨后檢測了不同HCC細胞系中敲除和過表達S100A4后11個基因的表達水平的改變,結果顯示只有OPN是S100A4的下游基因,其表達受到S100A4的調控(圖4b-f)。OPN是促進HCC轉移和干性的關鍵因子,但外泌體S100A4調節OPN的機制仍不清楚。

圖4 S100A4的表達與OPN正相關
有趣的是,研究報道S100A4可以增強STAT3的磷酸化,而STAT3的磷酸化與OPN的表達是相關的,并且STAT3被預測是OPN的潛在轉錄因子。因此,檢測了S100A4敲除和過表達后OPN表達,STAT3表達和STAT3磷酸化,結果顯示OPN表達和STAT3磷酸化水平與S100A4的變化趨勢一致;并且敲除STAT3后HCC細胞系中OPN表達和STAT3磷酸化被顯著抑制(圖5a-c)。這些結果表明S100A4可以激活STAT3磷酸化并增加OPN表達。
為了進一步探究S100A4過表達外泌體對STAT3磷酸化和OPN表達的影響,使用該外泌體預處理HCC細胞,結果顯示它可以顯著促進 STAT3磷酸化和OPN表達,以及S100A4的表達(圖5d)。此外,在原位異種移植瘤模型中,HMH-exo顯著增強了核STAT3磷酸化和細胞質OPN的表達(圖5e-f)。總之,以上結果表明S100A4過表達外泌體促進低轉移性HCC細胞的轉移潛力,而外泌體S100A4是HCC細胞的關鍵增強子,其通過激活STAT3的磷酸化和上調OPN的表達實現其功能(圖6a)。
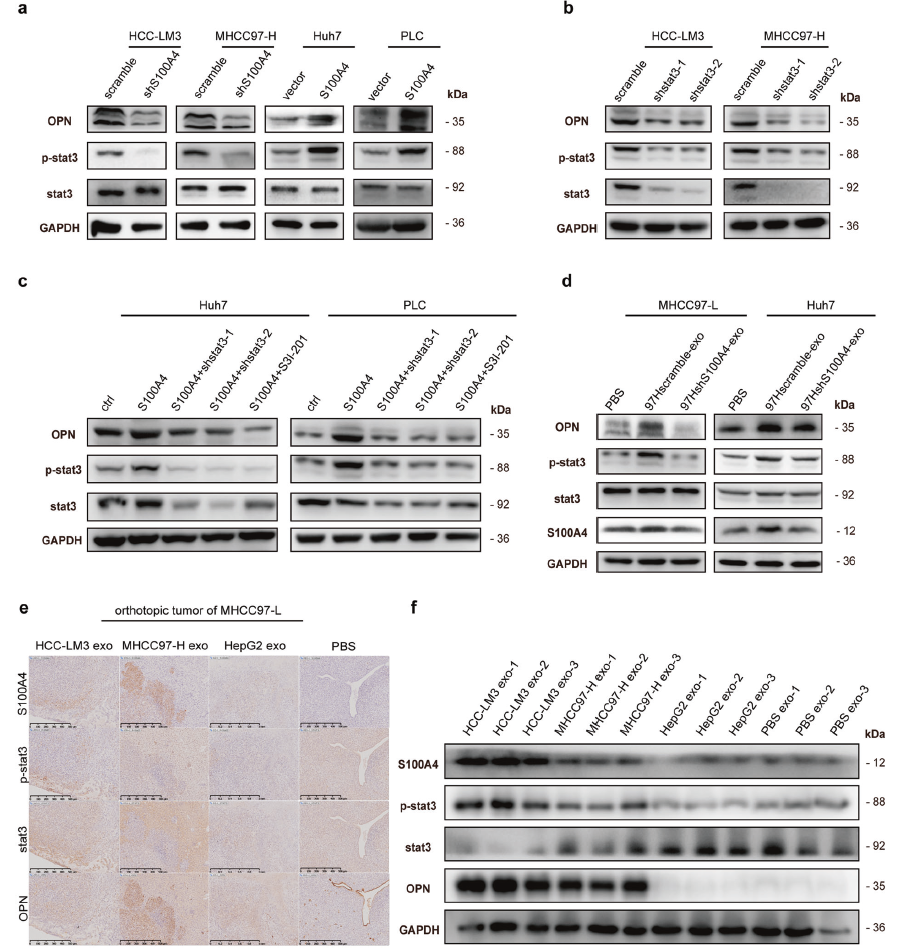
圖5 外泌體S100A4通過STAT3磷酸化激活OPN轉錄
5、血漿外泌體S100A4和OPN水平聯合可以作為HCC患者術后的強力預后因子
在168例接受肝切除術的HCC患者中,進一步研究了血漿外泌體S100A4和OPN水平的臨床意義。結果發現外泌體S100A4水平和OPN的表達顯著正相關,并且外泌體S100A4低表達組患者的總體生存率和無疾病生存率要顯著高于外泌體S100A4高表達組(圖6b-d)。隨后,基于外泌體S100A4水平和OPN水平的聯合分析,將患者分為4組,結果發現雙低水平S100A4和OPN組具有最好的預后,而雙高組則預后最差(圖6e-f)。

圖6血漿外泌體S100A4和OPN水平聯合可作為HCC患者術后的強力預后因子
參考文獻:
Sun Haoting., Wang Chaoqun., Hu Beiyuan., Gao Xiaomei., Zou Tiantian., Luo Qin., Chen Mo., Fu Yan., Sheng Yuanyuan., Zhang Kaili., Zheng Yan., Ren Xudong., Yan Shican., Geng Yan., Yang Luyu., Dong Qiongzhu., Qin Lunxiu.(2021). Exosomal S100A4 derived from highly metastatic hepatocellular carcinoma cells promotes metastasis by activating STAT3. Signal Transduct Target Ther, 6(1), 187. doi:10.1038/s41392-021-00579-3






