染色質定向蛋白質組學鑒定的前列腺癌細胞內源性雄激素受體網絡

雄激素和雄激素受體(AR)是激素激活轉錄因子(TF),是驅動前列腺癌(PCa)發生發展的關鍵因素。因此AR是晚期PCa激素治療的主要分子靶點。雄激素剝奪療法,特別是第二代抗雄激素和雄激素合成抑制劑最初是有效的。然而,由于患者仍然可以從晚期PCa進展到致命性去勢抗性前列腺癌(CRPC),需要新的治療靶點和生物標志物。靶蛋白的一個來源可能是ar相關的染色質蛋白。
大多數目前已知的核受體(NR)相互作用蛋白,包括那些AR,已經通過遺傳篩選,如雙雜交系統,免疫共沉淀和基于肽段的體外方法。盡管親和純化-質譜耦合(MS)已經啟發了NRs的輔助調節器,但它很少在代表NRs自然環境的條件下進行。然而,通過利用RIME(內源性蛋白快速免疫沉淀MS), Paltoglou等人和Stelloo等人已經從PCa細胞交聯染色質中鑒定了幾種內源性AR相關蛋白。
核心調節因子通常作為蛋白質復合物中的亞基存在,并以多種方式參與轉錄調控,例如通過調節組蛋白修飾和染色質結構。哺乳動物BRG1-或brm相關的染色質重塑復合物(BAF, SWI/SNF)改變了癌細胞染色質可及性景觀。該復合物是細胞周期和增殖的關鍵調控因子,也是前列腺癌的驅動因子,具有多種癌癥特異性作用。此外,頻繁發生的TMPRSS2-ERG融合基因易位可使BAF復合物重新靶向于染色質,促進前列腺癌的發生。互斥的ATPase亞基BRG1 (SMARCA4)和BRM (SMARCA2)是復雜功能的關鍵組件。此外,AR與DNA序列特異性轉錄因子(如FOXA1、GATA2、ERG和HOXB13)之間的合作已經建立。TF FOXA1可以結合到封閉的染色質區域,調節其染色質可及性,從而促進AR結合染色質引發PCa。
2021年6月,在Oncogene雜志上發表了文章“Chromatin-directed proteomics-identified network of endogenous androgen receptor in prostate cancer cells..”。此報道通過運用了一種強大的染色質導向蛋白質組學方法,稱為ChIP-SICAP,揭示去勢抗性前列腺癌(CRPC)細胞中內源性AR周圍染色質蛋白網絡(染色質蛋白網絡)的組成。在CRPC細胞雄激素信號通路的背景下,進一步研究了與AR相關蛋白作用的染色質重塑者SMARCA4和SIM2。通過整合ChIP-seq、RNA-seq、ATAC-seq和功能實驗的數據,揭示SMARCA4和AR在染色質上廣泛共存,SMARCA4缺失影響了一組AR靶基因的染色質可及性和表達,也抑制了CRPC細胞的生長,驗證了SMARCA4在CRPC細胞中的功能。雖然SIM2的沉默同樣降低了染色質的可及性,但它影響了更多的雄激素調節基因的表達。在雞胚絨膜尿囊膜實驗中,SIM2沉默也降低了CRPC細胞的增殖和腫瘤的大小。總之,此研究鑒定的AR染色體是研究這一重要藥物靶點的重要資源。
技術路線:

一、CRPC細胞中AR的染色體
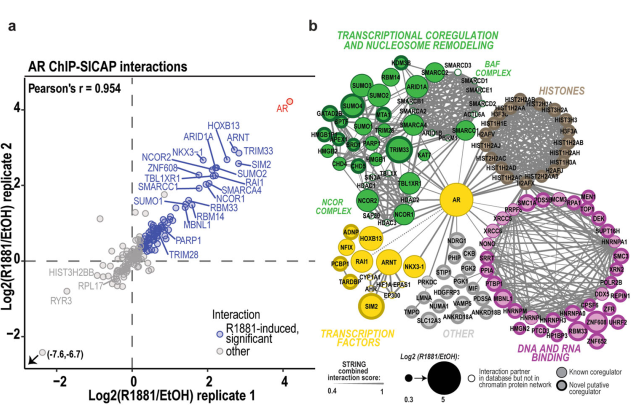
散點圖顯示在VCaP細胞的兩個生物重復中由AR ChIP-SICAP鑒定的染色質相關蛋白。在暴露于R1881(合成AR激動劑)中使用差異的silac標記。在190個ChIP-SICAP定量蛋白中,87個形成了r1881誘導的AR染色體,從而發現了可能與受體功能相互作用的蛋白。r1881誘導的AR chromatome被分為不同的功能蛋白組(圖1b)。DNA和rna結合蛋白,組蛋白,DNA修復和mRNA加工相關蛋白形成了大部分(~50%)的網絡。
二、SMARCA4共占據了大多數ar結合位點,但對其染色質可及性的影響有限

SMARCA4和AR共同占據的位點,以及雄激素如何影響共同占據。SMARCA4(61534)的大多數染色質結合位點沒有受到DHT的影響(簇C1,圖2a),在C2位點,AR和SMARCA4與結合高度相關。DHT增強了SMARCA4在這些位點的招募(集群C1,圖2b)。基序分析顯示,與C1位點相比,C2位點具有更高的雄激素響應元件(AREs)富集,進一步支持雄激素誘導的SMARCA4到染色質上的募集。FOXA1、ERG和HOXB13的基序依次在C1和C2位點上同樣富集(圖2c)。ChIP-seq數據集顯示,FOXA1和ERG的結合隨著激素暴露在C2位點而增加,而在C1位點則不增加(圖2d和e)。然而,HOXB13似乎在C1位點結合更多(圖2f)。與SMARCA4類似,SMARCC1[15](在ChIP-SICAP中發現)顯示與C1和C2位點相結合(圖2g)。

重點分析了ARBs染色質可及性的變化,發現雄激素通常增加了ARBs的可及性(圖3a, ATAC, siCTRL)。盡管SBs和ARBs之間有很大的重疊,但SMARCA4刪除僅減少了2149個ARBs的染色質可及性。這些sismarca4受影響的位點中有一半是開放的,不管激素暴露與否(pre-accessible),其余的在激素暴露后顯示其可及性增加(de novo位點,圖3a和c)。被AR招募的SMARCA4增加染色質可及性,潛在地協助其他因素招募到這些位點(圖3d,補充表2)。由于雄激素誘導了FOXA1在sismarca4影響位點的結合(圖3e), AR誘導的SMARCA4的招募可能有助于雄激素誘導FOXA1的結合。上述結果表明SMARCA4在CRPC細胞染色質景觀的調節中既有AR依賴的作用,也有非ARr獨立的作用。
三、SMARCA4調節AR靶基因的表達,參與細胞外基質組織和細胞粘附
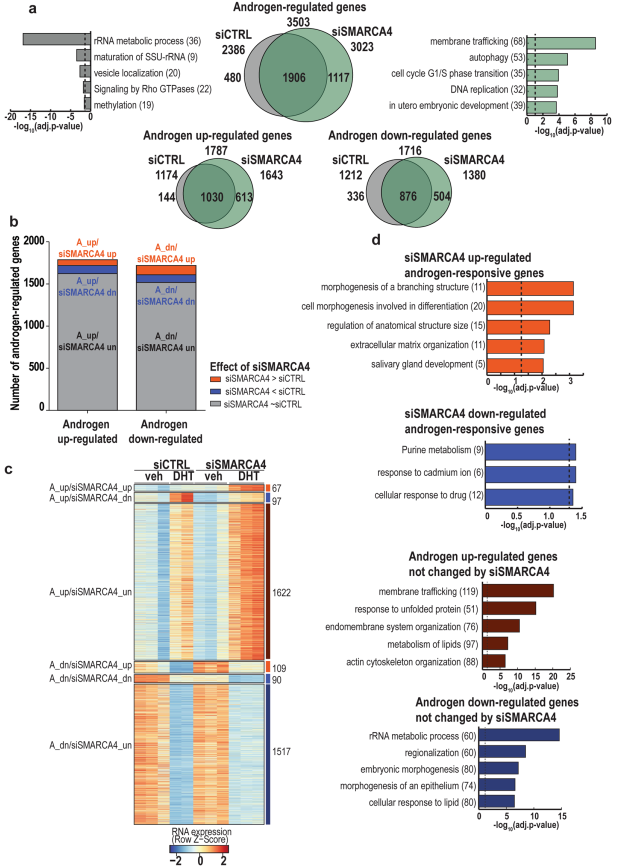
使用RNA-seq研究了SMARCA4缺失對有DHT和沒有DHT的VCaP細胞基因表達的全基因組影響。后一組中,雄激素(A)下調的基因占大多數(~70%),而在前一組中,雄激素(A)下調和上調的基因數量增加大致相等(圖4a) 。與具有DHT的siCTRL相比,siSMARCA4有931個差異表達基因(DEGs),其中363個基因雄激素顯著調控(圖4b, c)。對差異雄激素調節基因集進行metasscape分析。耗盡SMARCA4可增加雄激素應答基因的表達,例如,分支結構的形態發生和參與分化的細胞形態發生,而耗盡SMARCA4可抑制嘌呤代謝和細胞對藥物的反應中富集的基因的表達(圖4d)。上述結果表明smarca4介導的染色質可及性變化促進了它們的表達。
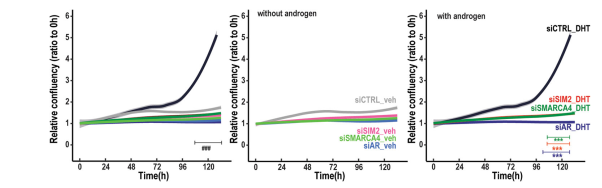
使用測量細胞一致性的活細胞成像作為細胞生長和擴散的代理,來測試SMARCA4消耗的影響是否轉化為VCaP細胞生長的改變。如圖5所示,在沒有雄激素的情況下,SMARCA4刪除并不影響細胞的生長,而在有雄激素的情況下,它降低了細胞的相對融合,盡管程度低于去除AR。SMARCA4刪除同樣會降低LNCaP細胞的相對融合。
四、SIM2沉默改變了arb亞群的染色質可及性

SIM2沉默降低了2434個arb染色質可及性,三分之二受siSIM2影響的arb在雄激素暴露前可及(圖6a c中可獲得),而其余在雄激素暴露后可及(圖6a c中重新獲得)。根據ChIP-SICAP數據,siim2受影響的位點中最富集的motif是ARE,盡管其在這些位點的富集程度低于未受siim2影響的位點(NC位點,圖6d)。AR、FOXA1、ERG和HOXB13在sisim2影響的位點的標簽密度與NC位點相比均呈上升趨勢(圖6e),表明SIM2是一種與AR協同的TF。
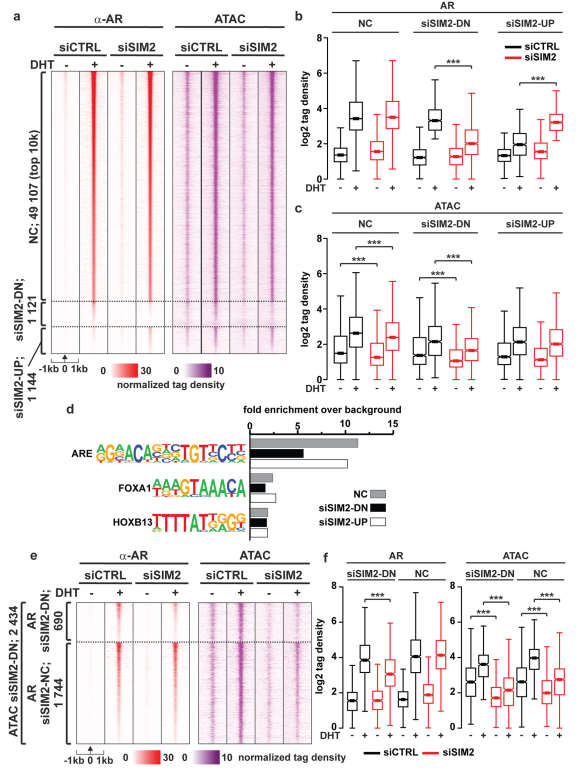
SIM2是否也影響AR與染色質的結合,我們在SIM2沉默后進行AR ChIP-seq。如圖7所示,受體與大多數arb的結合沒有改變。然而,SIM2沉默影響2265 ARBs藥物通過降低和增加染色質占用大約相同數量的地點(圖7 a、b)。當反映這些siSIM2-affected染色質易訪問性的變化,有趣的是,減少可訪問性是在690年siSIM2-DN ARBs藥物(圖7 c、e、f),而在siSIM2-UP arb中,染色質可及性的變化不明顯(圖7c)。其余的(1744)siSIM2位點在AR結合方面沒有變化。大多數由SIM2沉默改變的arb并不與FOXA1缺失改變的arb重疊,這得到了基元分析的支持,表明FOXA1基元在siSIM2-DN arb上的富集少于在AR結合沒有變化的位點上的富集(圖7d)。
五、SIM2對ar介導的基因表達有顯著影響

利用RNAseq研究SIM2沉默后SIM2對基因表達的影響。沉默SIM2使dht調控的基因數量增加了一倍多,2394個基因受到雄激素調控,而只有180個基因受到雄激素調控(圖8a, b)。此外,沉默SIM2導致6867個deg,其中2937個deg受到雄激素調控(圖8c, d, Supplementary Fig. S19f)。SIM2沉默也減輕了雄激素對AR表達的抑制(補充圖S20)。根據RT-qPCR的評估,ARNT沉默實質上再現了SIM2對選定AR靶基因和DEGs的影響(補充圖S21a, b)。對雄激素調節基因集的meta分析顯示,通過SIM2沉默,幾種途徑顯著富集。A_up/ siSIM2_up基因組和A_up/siSIM2_dn基因組中富集的最上面的通路分別是膜運輸和細胞對外界刺激的反應(圖8e)。






