外泌體介導的CD44v6/C1QBP復合物與胰腺癌肝轉移

胰管腺癌(PDAC)有明顯的肝轉移傾向。促癌分泌體通過外泌體傳遞和運輸是轉移前微環境形成和轉移的關鍵。2021年4月發表于Gut(IF=19.819)的文章“Exosome-delivered CD44v6/C1QBP complex drives pancreatic cancer liver metastasis by promoting fibrotic liver microenvironment”對此進行了探究。本研究旨在探討PDAC來源的外泌體(Pex)調控肝臟微環境、促進轉移的潛在機制。Pex衍生的CD44v6/C1QBP復合物對于肝纖維化微環境和PDAC肝轉移的形成是必不可少的。高表達的外泌體CD44v6和C1QBP是預測PDAC患者預后和肝轉移的很有前途的生物標志物。
技術路線
結果
1)Pex誘導肝纖維化微環境,促進PDAC肝轉移
從小鼠正常胰腺(Npex)和小鼠PDAC細胞分離的外泌體呈現典型的外泌體結構,大小約為50-150 nm(圖1A,B)。進一步的western blot分析證實了分離的外泌體的存在(圖1C)。為了確定Pex在PDAC肝轉移中的作用,我們首先進行了“教育”程序,并進一步通過脾內注射建立了PDAC肝轉移模型(圖1D)。在“教育”過程后,STE和原子力顯微鏡(AFM)顯示,與Npex組相比,Pex組小鼠的肝臟剛度顯著增加(圖1E,F)。此外,肝組織膠原密度增加(圖1G),肝ECM明顯重構(圖1H,I)。同樣,PDAC原位植入模型也顯示原位腫瘤可增加肝臟膠原沉積。肝轉移模型顯示,與Npex組相比,Pex組肝轉移更多,肝質量更高(圖1J)。這些數據表明,Pex可以通過重構肝臟ECM來誘導肝纖維化微環境,促進PDAC肝轉移。

2)Pex增強肝衛星細胞(HSCs)的活性
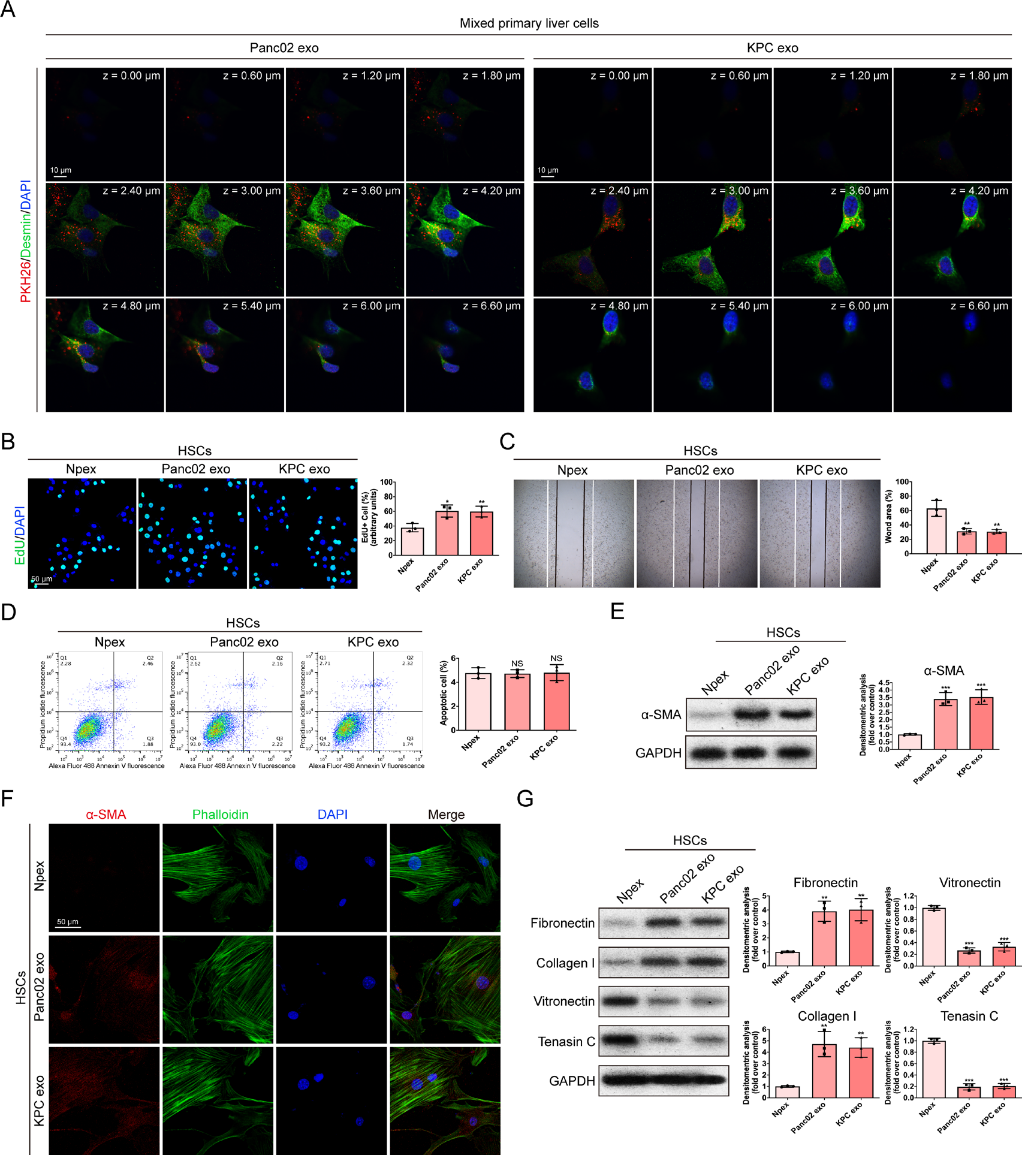
為了證實Pex的生物學功能,將原代小鼠肝細胞與Pex孵育,Pex被受體細胞吸收。然后使用免疫熒光染色對原發性肝細胞的類型進行表征,結果顯示,desmin+HSCs和F4/80+Kupffer細胞吸收了Pex(圖2A)。我們接下來研究了Pex對HSCs生物學行為的影響,發現Pex顯著增強了HSCs的增殖和遷移能力(圖2B和C)。Pex與Npex處理的HSCs的凋亡沒有顯著差異(圖2D)。western blot和免疫熒光檢測結果顯示,Pex顯著上調α-SMA的表達,說明Pex能促進HSC的活化(圖2E和F)。我們觀察到Pex可以通過下調vitronectin和tenascin C的表達,上調collagen I和fibronectin的表達來調節HSCs中的ECM分泌(圖2G)。
3) IGF-1信號在Pex誘導的HSC活化和肝纖維化中至關重要
為了進一步探索Pex調控HSC行為的機制,我們比較了Pex和Npex組間的HSC的RNA測序基因表達譜(圖3A)。在差異表達基因中,我們觀察到41個重疊的上調基因在Pan02 exo組與Npex組和KPC exo組與Npex組之間存在部分交集(圖3B)。主要涉及的基因參與細胞外空間、細胞外區域和ECM(圖3C),表明Pex調節HSC的ECM分泌。此外,GO和KEGG通路分析顯示,IGF-1及其下游PI3K/AKT是受Pex影響的排名最高的信號通路(圖3D,E)。western blot分析支持了Pex顯著增加HSC中IGF- 1R、IRS-1和AKT磷酸化的發現(圖3F)。當使用IGF-1R抑制劑時,Pex誘導的p-IGF-1R、p-IRS-1和p- AKT的上調被阻斷(圖3G)。基于這些結果,我們推測IGF-1信號可能是介導Pex依賴的HSC活化的關鍵因素。與預期的一樣,IGF-1R抑制劑抑制了Pex誘導的HSC的活化、增殖和遷移(圖4A-D)。此外,IGF-1R抑制劑逆轉了Pex誘導的HSC中ECM的產生(圖4E)。我們的體內實驗表明,IGF-1R抑制劑可以阻斷Pex誘導的肝纖維化(圖4F-I)。這些數據表明IGF-1信號在Pex誘導的肝纖維化中起重要作用。


4)Pex來源的CD44v6對于HSCs的激活是必要的,但不是充分的
我們之前的研究揭示了CD44v6參與調控PDAC細胞的IGF-1通路。因此,我們首先驗證了CD44v6在外泌體中的表達,發現CD44v6在Pex中的表達水平明顯高于Npex(圖5A)。為了研究CD44v6是否能夠被傳遞到受體細胞中,我們采用蛋白合成抑制劑環己酰亞胺檢測加入Pex后CD44v6的蛋白水平。western blot分析顯示,加入Pex后,HSCs中CD44v6的表達水平明顯增加(圖5B)。與Npex-孵育的細胞相比,CD44v6的表達水平保持不變(圖5B)。我們還進行了免疫熒光分析,檢測出HSC膜中CD44v6與Pan-cadherin共定位(圖5C)。這些結果表明,Pex可將CD44v6輸送到HSC膜。此外,western blot檢測表明,敲除CD44v6或使用抗CD44v6抗體的Pex強烈減弱了Pex誘導的IGF-1信號通路的激活(圖5D)。同時,在CD44v6- kd Pex或CD44v6抗體的作用下,Pex誘導的HSC活化(圖5E,F)、ECM重塑(圖5G)的積極作用顯著減少。為了闡明CD44v6在Pex誘導的HSC激活中的作用,我們進一步研究了過表達CD44v6在HSC中是否與Pex具有同樣的激活HSC的作用。然而,過表達CD44v6并沒有像預期的那樣提高α-SMA的表達(圖5H)。這些結果表明,CD44v6在Pex誘導的HSC激活中發揮了重要作用。

5)Pex衍生的CD44v6/C1QBP復合物介導了Pex對肝纖維化和PDAC肝轉移的積極作用
此前,我們發現IGF-1可以通過誘導補體C1q結合蛋白(C1QBP)從細胞質轉位到膜上,驅動CD44v6/C1QBP復合物的形成,從而激活IGF-1下游通路。因此,我們很想知道C1QBP是否通過CD44v6相互作用參與Pex誘導的HSC活化。我們的結果表明C1QBP在Pex中的表達明顯高于Npex(圖6A)。如圖6B所示,C1QBP在Pex孵育的HSCs中表達高于Npex組。同時,與Pex處理的細胞相比,C1QBP-kd Pex處理HSCs后C1QBP蛋白水平顯著降低(圖6B)。與Pex轉移的CD44v6在HSCs中的位置一致,膜中也檢測到C1QBP,并與Pan-cadherin共定位(圖6C)。這些數據表明,C1QBP可以通過Pex傳遞到HSCs膜。免疫電鏡顯示CD44v6和C1QBP在Pex中共表達(圖6D)。同時過表達CD44v6和C1QBP后,Co- IP檢測顯示CD44v6和C1QBP在Pex中相互作用(圖6E)。此外,通過近距離連接(圖6F)和免疫熒光分析(圖6G),我們發現了CD44v6和C1QBP在Pex孵化的HSCs膜上的結合。這些發現表明,CD44v6在傳遞外泌體CD44v6/C1QBP復合物中起重要作用。
與CD44v6敲低實驗的結果相似,敲低Pex中的C1QBP在很大程度上抑制了α-SMA表達(圖6H)。過表達C1QBP并沒有上調α-SMA的表達(圖6I)。同時過表達CD44v6和C1QBP顯著增加了α-SMA的表達(圖6I)。與我們的體外研究一致,敲除Pex中的CD44v6或C1QBP逆轉了Pex誘導的HSC激活、肝臟剛度增加和肝臟ECM重塑的作用(圖6J-L)。脾內注射肝轉移模型(圖6M)顯示,與Pex組相比,注射了CD44v6- kd或C1QBP- kd的Pex組小鼠的肝轉移減少。這些結果表明,Pex衍生的CD44v6/C1QBP復合物介導了Pex對肝纖維化和PDAC肝轉移的積極作用。

6)Pex衍生的CD44v6和C1QBP的高表達預示著PDAC患者的肝轉移和低生存率
采用免疫組化和western blot檢測肝轉移灶周圍肝組織和正常肝組織的纖維化ECM微環境。與體內實驗一致,纖維連接蛋白、I型膠原和α-SMA水平顯著升高,而玻連蛋白和固生蛋白C水平下調(圖7A,B)。接下來,我們研究了外泌體衍生CD44v6和C1QBP在PDAC患者中的預后價值。外泌體CD44v6和C1QBP在PDAC組織中的表達明顯高于正常胰腺組織(圖7C)。此外,有肝轉移的PDAC患者外泌體CD44v6和C1QBP的表達明顯高于無肝轉移的PDAC患者(圖7C)。免疫電鏡顯示,CD44v6和C1QBP在PDAC組織來源的EVs中共表達(圖7D)。Pex中CD44v6和C1QBP高表達的患者比其他患者更容易發生肝轉移 (圖7E)。此外,生存分析顯示,EV中CD44v6和C1QBP高表達的患者的生存結局明顯較差(圖7F)。循環外泌體的隨訪數據也顯示了一致的結果。PDAC患者中循環外泌體CD44v6和C1QBP的表達明顯高于健康對照組(圖7G), PDAC伴有肝轉移的患者中循環外泌體CD44v6和C1QBP的表達明顯高于無肝轉移的患者(圖7G)。免疫電子顯微鏡顯示,CD44v6和C1QBP在PDAC患者的循環外泌體中共表達(圖7H)。高循環外泌體表達CD44v6和C1QBP的患者比其他患者更容易發生肝轉移 (圖7I)。然而,高表達循環外泌體CD44v6和C1QBP的患者生存率明顯較差(圖7J)。總之,我們的研究結果證實了CD44v6和C1QBP在組織源性EV和循環外泌體中的表達可以預測PDAC患者的預后和肝轉移。

結論:我們揭示了原代PDAC細胞和HSCs之間通過PDAC來源的外泌體進行遠距離的細胞通信。此外,Pex通過促進肝纖維化微環境的形成來指示肝特異性轉移。更重要的是,我們發現外泌體CD44v6/C1QBP復合物傳遞到HSC的質膜上誘導IGF-1信號通路的激活。外泌體CD44v6和C1QBP可能是預測PDAC患者預后的有前途的生物標志物,也是治療PDAC肝轉移的潛在靶點。






