單細胞轉錄和染色質可及性分析重新定義了成人腎臟中的細胞異質性

近日,美國圣路易斯華盛頓大學醫學院Yoshiharu Muto教授等在Nature communications發布了Single cell transcriptional and chromatin accessibility profiling redefine cellular heterogeneity in the adult human kidney的研究論文。文中,作者采用單細胞核轉錄組snRNA-seq和單細胞核染色質可及性snATAC-seq技術,對5個健康成人(50歲到62歲,男性(n = 3)和女性(n = 2))腎臟樣本進行檢測。此文揭示腎臟內獨特的細胞狀態,并重新定義近端小管和粗升肢的細胞異質性。
轉座酶染色質可及性單核測序(snATAC-seq)也是一種單細胞表觀遺傳組測序技術。單細胞核測序,能夠獲得組織的細胞圖譜,解決細胞異質性的問題。單細胞或細胞核RNA測序(scRNA-seq或snRNAseq)促進了對定義腎臟細胞特性的基因和途徑的更深入的理解。成熟的人類和小鼠腎臟的多個scRNAseq圖譜已經確定了轉錄如何有助于細胞類型的特異性。最近的方法已經將這種方法擴展到單細胞染色質可及性分析。單核染色質轉置可及性測序試驗(snATACseq)是ATAC-seq的擴展,該試劑盒利用Tn5轉置酶在數千個單個細胞中測量染色質可及性。染色質可及性是驅動腎元發育的動態過程,而腎元祖細胞具有不同的染色質可及性譜,且隨其分化而變化。染色質可及性在促進或抑制腎臟修復和再生中的作用對于設計急性和慢性腎臟疾病的治療方案具有重要意義,并可能有助于改善腎臟類器官的定向分化。scRNA-seq和snATAC-seq在成年小鼠腎臟中的聯合分析為理解染色質可及性如何調節轉錄提供了一個框架。然而,人類腎臟的單細胞表觀基因組還沒有被描述。
生物信息學工具可以從snATAC-seq數據集中提取出scRNA-seq無法獲取的唯一信息。預測細胞類型特異性順式調控DNA相互作用和轉錄因子活性是補充scRNA-seq獲得的轉錄信息的兩種方法。長程染色質-染色質相互作用在轉錄調控中起著重要作用,并受到轉錄因子結合的影響。染色質可及性分析將有助于識別通過遠程相互作用影響轉錄的遠程調控區域。
我們已經進行了snATAC-seq和snRNA-seq來研究染色質可及性如何改善我們對成熟人類腎臟中細胞狀態和功能的理解。我們生成了一個包含轉錄組和表觀基因組數據的交互式多模態圖譜(http://humphreyslab.com/ SingleCell/)。結合snRNA-seq和snATAC-seq分析提高了檢測近端小管和厚升肢內獨特細胞狀態的能力,并重新定義了可能有助于腎臟再生和細胞特異性離子通透性的細胞異質性。
技術路線:

一、人類成年腎臟的單細胞轉錄和染色質可及性分析

工作流程圖
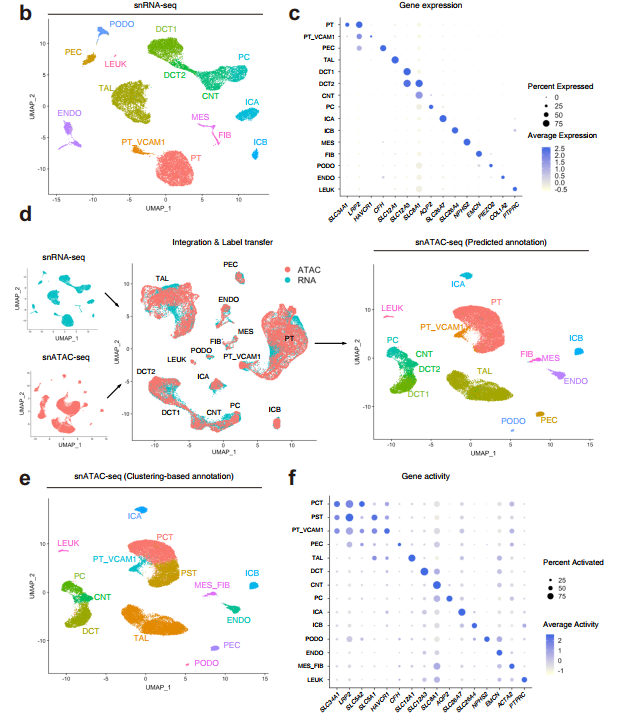
1)成人腎臟中的單細胞轉錄和染色質可及性分析
snRNA-seq基于譜系特異性標記的表達(圖1c,補充圖1b),鑒定了腎皮質內所有主要細胞類型(圖1b,補充圖1a)。檢測了近端小管(PT)、壁上皮細胞(PEC)、粗升肢(TAL)、遠端小管(DCT1、DCT2)、連接小管(CNT)、集合管(PC、ICA、ICB)、內皮細胞(ENDO)、腎小球細胞類型(MES、PODO)、成纖維細胞(FIB)和少量白細胞(LEUK)(補充表2、補充數據1)。
值得注意的是,近端小管亞群中VCAM1表達增加(PT_VCAM1)。該亞群還表達了HAVCR1,這是一種急性損傷后近端小管上調的基因,是長期腎臟預后的預測因子。
2)整合單核RNA和ATAC數據集,用于預測和驗證ATAC細胞類型分配
snATAC-seq捕獲單個細胞的染色質可及性特征。相對而言,我們對細胞類型特異性染色質可及性圖譜的了解較少;因此,我們利用注釋snRNA-seq數據集使用標簽轉移來預測使用Seurat的snATAC-seq細胞類型。標簽轉移是通過從snATAC-seq數據創建一個基因活性矩陣來進行的,這是一種衡量蛋白編碼基因的基因體和啟動子內染色質可及性的方法。
在參考snRNA-seq數據集和查詢基因活性矩陣之間識別轉移錨點,然后分配預測的細胞類型。snATAC-seq預測分數的分布表明,絕大多數細胞具有較高的預測分數,并被自信地劃分為單細胞類型(補充圖2)。
對snATAC-seq數據集使用97%置信閾值對細胞類型分配進行過濾,以去除異型雙重體。通過標簽轉移獲得的snATAC-seq細胞類型預測(圖1d)與無監督簇的編輯注釋(圖1e, f)的比較表明,所有主要的細胞類型都存在于這兩個數據集中,并且在檢測和分配細胞身份方面,snATAC-seq與snRNA-seq具有可比性(補充圖3)。使用基于基因活性的細胞類型分配進行下游分析,這是通過對snatc -seq數據集的無監督聚類獲得的。有趣的是,snATAC-seq能夠檢測到近端小管簇內的兩個亞群,這可能代表近端曲小管(圖1e, PCT)和近端直小管(圖1e, PST)。PCT顯示編碼SGLT2的SLC5A2具有更強的染色質可及性;而PST在編碼SGLT1的SLC5A1(圖1f,補充圖4)中表現出更強的可達性。SGLT2在近端小管S1和S2段重新吸收葡萄糖,SGLT1位于S3。
二、染色質的可及性明確了細胞的類型
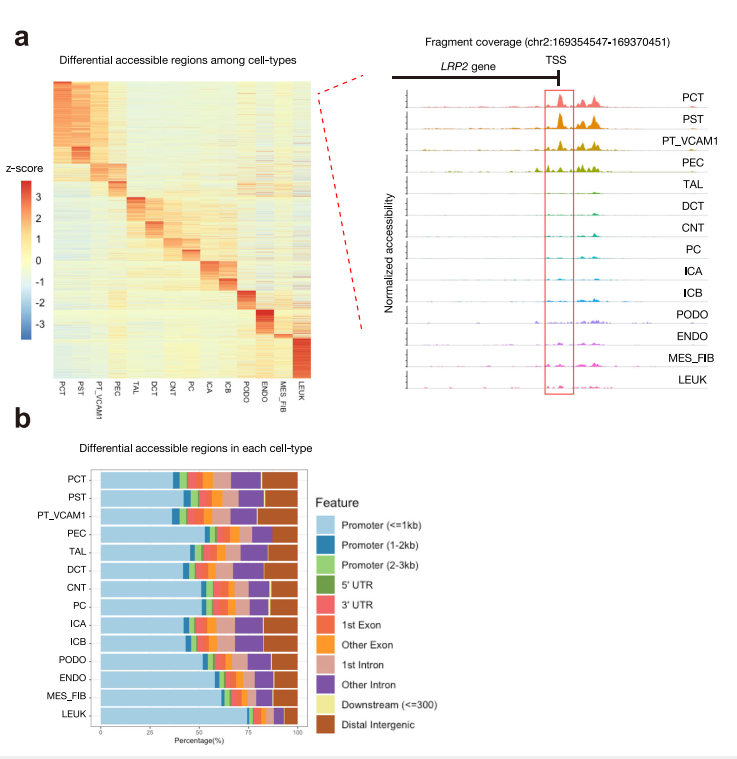
我們使用R包Signac來研究不同細胞類型間染色質可及性的差異。細胞類型可以根據差異開放區域(DARs)是開放的還是封閉的來區分(Fig. 2a)。
約20%(平均比例= 0.203 0.04)的DAR與各自細胞類型中的差異表達基因密切相關(補充表4)。例如,LRP2是一個表達在近端小管的譜系特異性基因,該區域的覆蓋圖顯示其啟動子和基因體內ATAC峰的數量和幅度增加(圖2a)。事實上,大部分DAR都位于距離最近的轉錄起始位點3 kb內的啟動子區域(圖2b,補充圖7)。第二個最常見的位置是內含子,DAR在不同細胞類型中的分布相對保守(圖2c)。
三、染色質可及性與細胞類型特異性轉錄因子活性和染色質相互作用網絡有關

HNF4A編碼驅動近端小管分化的關鍵轉錄因子。chromVAR檢測到近端小管DAR中HNF4A結合基序的富集(圖3b,基序活性),這是HNF4A中染色質可及性增強(圖3b,基因活性)和snRNA-seq數據集中HNF4A轉錄增強(圖3b,基因表達)所支持的。我們通過染色質免疫沉淀,然后定量PCR (ChIP-qPCR)驗證了HNF4A與腎近端小管上皮細胞(RPTEC,補充圖8a)中選定的靶基因位點(SLC34A1, SLC5A2, HNF4A) DAR中預測的HNF4A結合位點的結合。 然而,在RPTEC中可檢測到HNF4A的表達水平低于腎皮質,這表明HNF4A與該細胞類型中的這些位點具有強大的相互作用(補充圖8b)。
TFAP2B也有類似的模式,它調節遠端腎單位的發育30。TFAP2B轉錄因子活性在粗升肢和遠端曲小管中增加(圖3b, motif活性),TFAP2B染色質可及性增加(圖3b,基因活性),TFAP2B轉錄增加(圖3b,基因表達)。
我們對遠曲小管(DCT)、連接小管(CNT)和主細胞(PC)進行了偽時間排序,這些細胞在snRNA和snATAC數據集中都形成了一組不同的轉錄相關細胞類型。
在HNF4A中,觀察到近曲小管中有一個CCAN,在啟動子、基因體和遠端區域的差異開放區域(圖3c,紅框)之間有多個連接(紅色或藍色弧線)(圖3c)。
與coaccessibility score較高的Cicero連接相比,coaccessibility score較低的Cicero連接在GeneHancer double elite數據庫中的可能性較小(p <2.2 10 16,卡的平方)。在近端曲小管內,大部分Cicero連接要么在啟動子區域內,要么在啟動子和另一個位置之間(圖3d),這種分布在其他細胞類型中也類似(補充圖11)。
轉錄因子活性與轉錄因子表達有適度的相關性(Pearson r2 = 0.36, p值= 4.2 10 12,圖3e)。
推測motif活性與轉錄因子表達呈正相關的轉錄因子可能在DAR中扮演轉錄激活因子的角色,而負相關的轉錄因子則扮演轉錄抑制因子的角色。令人驚訝的是,糖皮質激素受體(NR3C1)的motif活性與表達呈正相關,而礦皮質激素受體(NR3C2)則呈負相關(圖3f)。
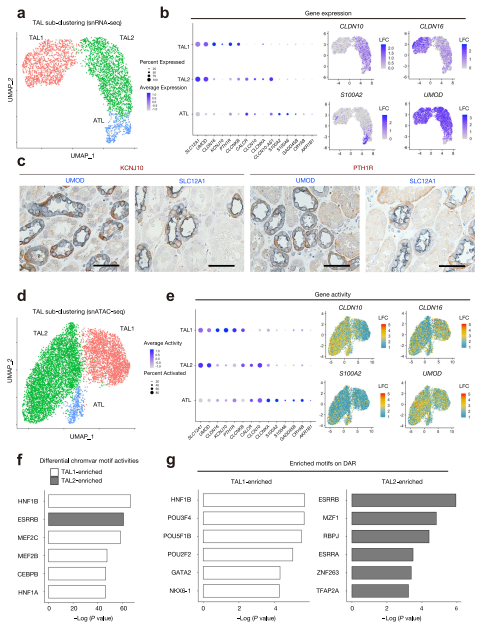
四、Multimodal 分析突出了肥大的上行肢體的細胞異質性
為了確定我們是否能夠檢測出具有可變claudin表達模式的細胞亞群,在snRNA-seq數據集的umap圖上劃分三個亞種群(TAL1, TAL2和ATL)。ATL,上升細肢。顯示了TAL各亞群體中富集基因的基因表達模式。一組細胞(SLC12A1+UMOD+)表達粗升肢標記(CLDN16、KCNJ10和PTH1R): TAL1,另一組細胞表達另一組TAL特異性標記,如CLDN10: TAL2(圖4b)。第三組細胞根據之前發表的標記的表達被確定為髓袢升支粗段(ATL) 。我們使用免疫組化方法驗證PTH1R和KCNJ10在UMOD+ SLC12A1+細胞亞群中表達(圖4c)。在snATAC-seq數據集的umap圖上進行TAL的亞聚類,劃分三個亞種群(TAL1、TAL2和ATL)(圖4d)。點圖顯示每個TAL亞種群中富集的基因的活性模式(圖4e)。斑點的直徑對應于檢測到的基因活性的細胞比例,斑點的密度對應于相對于所有細胞類型的平均基因活性。Umap顯示CLDN10、CLDN16、S100A2或UMOD(左)的基因活性。TAL1和TAL2之間的chromVAR差異激活轉錄因子基序(圖4f)。使用Seurat FindMarkers功能來識別區分厚升肢細胞群的DAR,并使用Seurat FindMotifs功能對這些DAR進行轉錄因子motif富集(圖4g)。
五、NF-κB調節表達VCAM1的近端小管亞群的分子特征
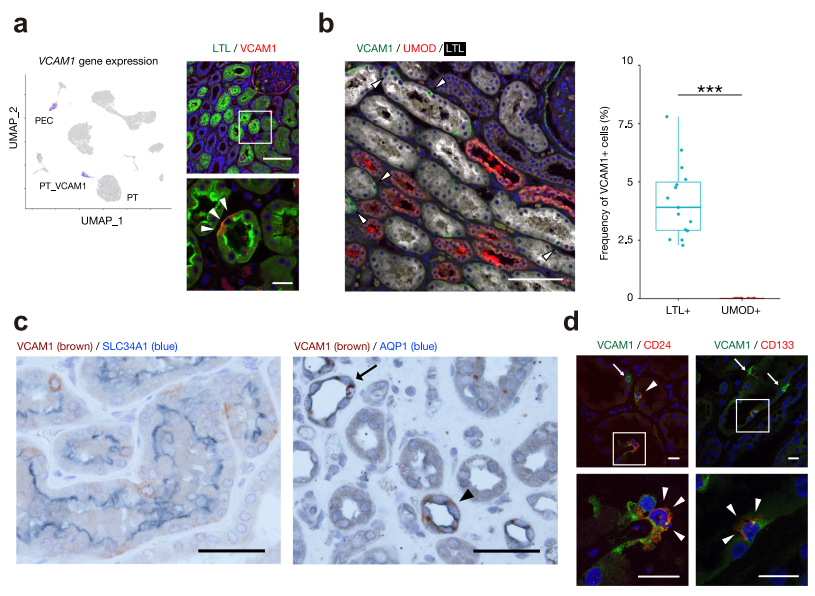
檢測了一組近端小管細胞,VCAM1的表達和染色質可及性增加,我們將其命名為PT_VCAM1(圖1)。免疫熒光研究表明,VCAM1在近端小管上皮中呈散在分布的表達(圖5a)。我們的單細胞研究估計PT_VCAM1占總細胞數的2%,近端小管上皮細胞數的6%。我們還證實,在LTL+ PT細胞中,VCAM1+小管細胞占4.19 1.58%,而在腎皮質的UMOD+ TAL細胞中,VCAM1+細胞未被檢測到(圖5b)。雖然之前的研究表明VCAM1在亨利氏襻(dTL)的降肢表達,但我們僅通過AQP1對腎臟切片進行鏈紋檢測,觀察到VCAM1在dTL的一個亞組表達(圖5c)。這些數據表明,VCAM1+小管細胞大部分位于皮質內近端小管內。與VCAM1+ PT細胞相比,有少數dTL小管表達VCAM1。免疫熒光分析確定了一個VCAM1+近端小管細胞亞群表達CD24或CD133(圖5d)。
六、多組學方法分析表征近端小管細胞子集
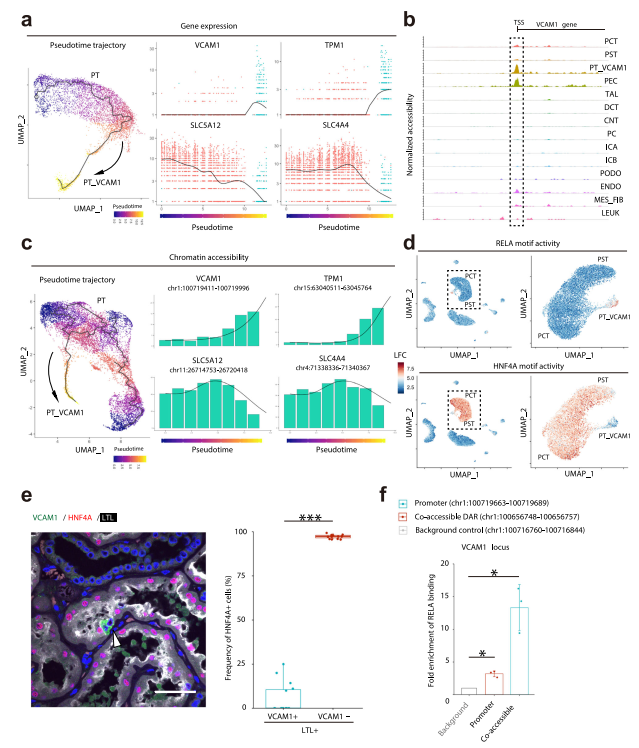
Cicero研究了從PT到PT_VCAM1轉變過程中染色質可及性的變化。VCAM1和TPM1轉錄增加(圖6a)與VCAM1基因體和啟動子區域染色質可及性增加相關(圖6b, c)。同樣,SLC5A12和SLC4A4轉錄降低(圖6c)與染色質可及性降低相關(圖6c,補充圖15)。通過評估chromVAR轉錄因子的活性,我們發現了可能調節近端小管和PT_VCAM1之間過渡的轉錄因子。有趣的是,近端小管顯示出強大的HNF4A活性,該活性在PT_VCAM1簇中降低,并與增加的REL和RELA活性相一致(圖6d)。我們在PT_VCAM1細胞核中驗證了減少的HNF4A蛋白表達(圖6e)。
我們從VCAM1基因體中鑒定出一個約60kb的開放染色質區域,該區域包含一個與VCAM1啟動子相互作用的RELA基序(通過ciscoaccessibility network)。實際上,ChIP-qPCR擴增了該位點,使其能夠與RELA結合(圖6f,補充圖17b),為該細胞類型中RELA調控VCAM1表達提供了實驗證據。
七、急性腎損傷和慢性腎臟疾病患者PT_VCAM1的比例升高
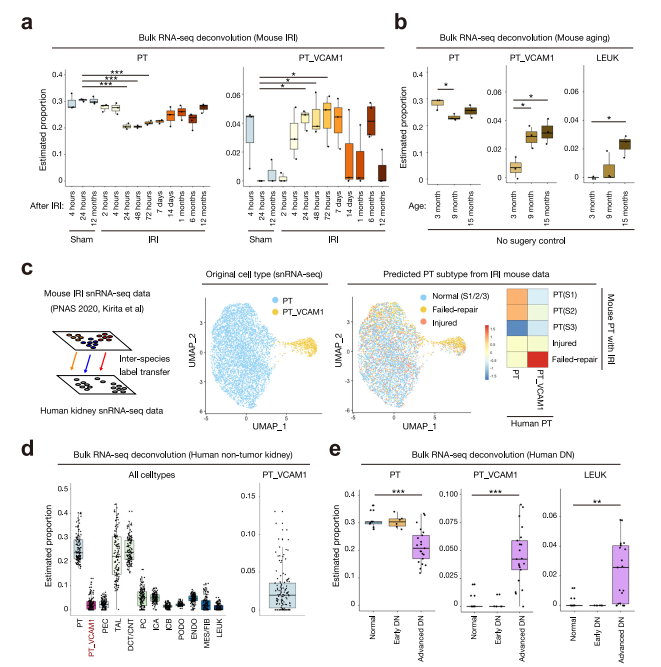
對小鼠缺血再灌注損傷(IRI)實驗中獲得的大量RNA-seq進行反卷積,以確定PT_VCAM1的比例是否與急性腎損傷有關。BisqueRNA使用基于scRNA-seq參考的反褶積方法從整體RNA-seq中估算細胞類型的豐度。PT_VCAM1估計比例在iri后24 h顯著增加,并持續至少7天;與正常近端小管細胞比例下降相對應(圖7a)。有趣的是,未手術控制小鼠腎臟中PT_VCAM1的估計比例在老齡小鼠中增加(圖7b)。用BisqueRNA對非腫瘤腎樣本進行反卷積,估計PT_VCAM1細胞的比例為2.6%(圖7d),這與我們的snRNA-seq和snatc -seq估計一致。接下來,我們分析了來自2型糖尿病患者腎臟活檢的大量RNA-seq。與對照組和早期糖尿病腎病患者相比,晚期糖尿病腎病患者PT_VCAM1的比例明顯更高(圖7e),提示PT_VCAM1和小管損傷可能與糖尿病腎病的疾病進展有關。
從小鼠IRI到人類的細胞類型標記轉移表明,大部分PT_VCAM1與我們最近在小鼠中發現的修復失敗的近端小管細胞(FR-PTC)群體有關(圖7c)。






