Wnt信號塑造彌漫性胃癌的組織學變化
胃癌(GC)是全球第五大最常見的癌癥,也是癌癥死亡率的第三大主要原因。Lauren的分類經典地將GC分為2種主要的組織學類型:腸道和彌散性。彌散性GC在2010年世界衛生組織(WHO)分類中更名為粘著不良癌(PCC),并進一步分為2種組織學亞型:印戒細胞癌(SRCC)和非PCC的非SRCC(PCC-NOS)。
今天我們來看一篇題名為:Wnt Signaling Shapes the Histologic Variation in Diffuse Gastric Cancer的文章,文章發表在Gastroenterology雜志,影響因子17.373。文章通過組織病理學分析、原位雜交和基因表達分析,建立了7株彌漫性GC類器官細胞系。對于彌漫性GC的遺傳模型,敲除了人正常胃類器官中的CDH1和/或TP53。將綠色熒光蛋白標記的GC類有機物異種移植到免疫缺陷小鼠體內進行體內評價。
Wnt和R-spondin (WR)對PCC類器官形態的調節
建立了7株彌漫性GC類器官細胞系。全外顯子組測序和RNA-seq鑒定了所有SRCC中彌散型GC的驅動基因改變,包括CDH1和RHOA突變以及CLDN18-ARHGAP基因融合。所有PCC類器官都需要WR才能生長,并顯示出緊密聚集的形態,這與PCC組織學粘聚力差一致。 值得注意的是,從培養基中除去WR后,細胞的形態顯著改變。WR+培養的由緊密聚集的小圓形細胞構成,WR-培養的細胞由松散連接的腫脹細胞簇組成。高碘酸希夫染色顯示WR-培養的細胞中充滿粘蛋白的空泡和移位的細胞核,這也是印戒細胞的典型形態。鑒于組織學上的相似性,WR+和WR-培養的類器官分別稱為PCC-NOS和SRCC細胞。與PCC-NOS相比,在RNA序列分析中,SRCC顯示杯狀細胞標記基因(MUC2和KRT20)的高表達,Wnt靶基因(LGR5和AXIN2)的表達下調。與分化的基因表達模式一致,SRCC WR去除后具有降低的生長能力和擴展。這些結果表明,Wnt信號活性控制分化狀態以及PCC類器官中的形態變化。
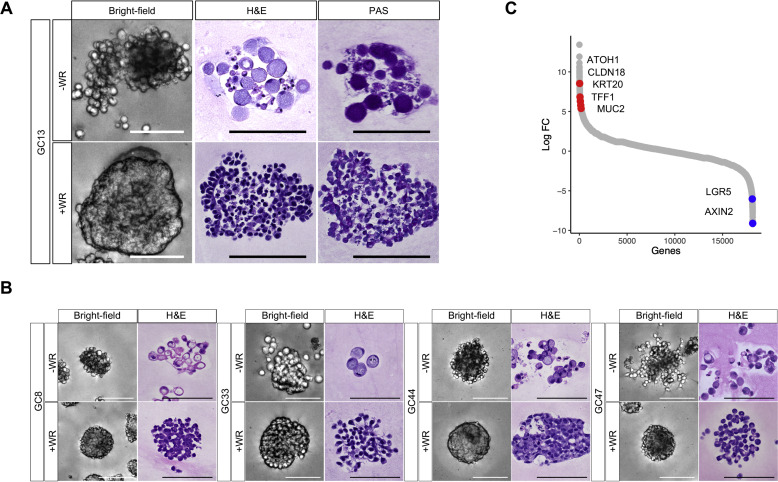
PCC的去分化能力
當重新提供WR時,一些但不是全部的SRCC可以還原為PCC-NOS并在細胞解離后傳播。SRCC之間的逆轉能力差異與TP53突變狀態平行。為了驗證這種基因型-表型關聯,研究人員從正常胃類細胞入手,它們缺乏CDH1(CDH1KO)或CDH1和TP53(CDH1/TP53DKO)。如前所示,CDH1KO細胞在rho相關卷曲線圈形成激酶(ROCK)抑制劑存在下呈囊性形態,無印戒細胞結構。無論是否存在ROCK抑制劑,CDH1KO類器官都不僅具有不黏附形態,而且在去除WR時也產生了富含粘蛋白的印戒細胞。再補充WR后,具有CDH1/TP53DKO而非CDH1KO背景的印戒細胞能夠再生為PCC-NOS。這些結果表明,TP53突變有助于SRCC的表型可塑性和增強的致瘤能力。

患者來源組織中PCC亞型的研究
為了確定PCCs中SRCC和PCC-NOS亞型的特異性是否與人PCC組織中Wnt信號的激活同時發生,采用原位雜交和免疫組織化學方法評估了從PCC標本中獲得Wnt靶基因的表達。與SRCC和PCC-NOS中的基因表達模式一致,LGR5的表達僅限于PCC-NOS隔室,而SRCC組分特異性表達KRT20。值得注意的是,LGR5+PCC-NOS區域經常位于R-spondin3+成纖維細胞周圍,表明這些成纖維細胞誘導PCC中的Wnt信號激活。
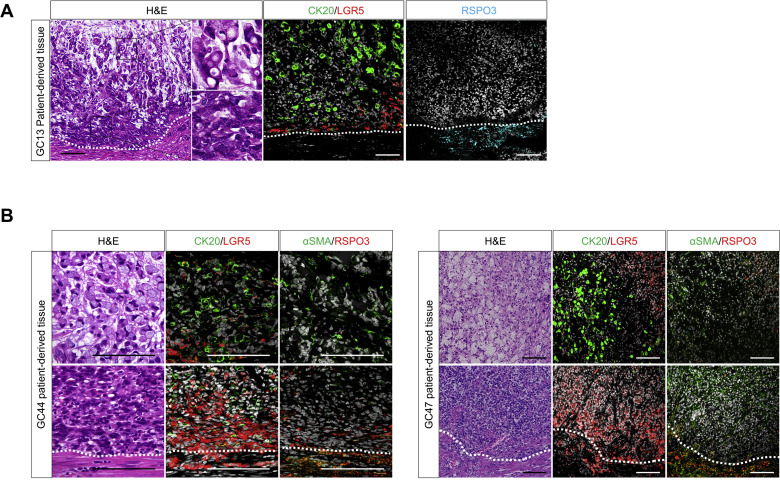
異種移植的PCC類器官在體內再現了腫瘤的組織學異質性
PCC未能在皮下和腎包膜下生長,提示這些部位缺乏WR生態位。相反,移植到去除上皮的結腸上,綠色熒光蛋白標記的PCC類器官可通過提供WR生態位而有效地形成腫瘤。結腸鏡顯示了硬化的腫瘤生長。植入的PCC形成了WR依賴的分層結構,該結構由PCC-NOS和SRCC組成,并再現了原始PCC組織。
為了驗證這兩種組織學亞型的克隆起源,克隆了PCC細胞異種移植到胃壁。PCC取代了宿主上皮,形成了具有Wnt依賴性分化組織結構,使人聯想到初級PCC組織。在結腸和胃異種移植物中,表達LGR5的PCC經常位于小鼠R-spondin3+成纖維細胞附近。從另一個患者來源的PCC克隆中獲得了相同的結果。
為了確定與基質細胞的相互作用是否可以調節PCC的組織學亞型,將PCC與產生WR的腸基質細胞共同培養。基質細胞替代外源WR,并允許PCC以PCC-NOS形態繁殖。抑制劑能Wnt配體的產生,抑制PCC-NOS的生長并誘導SRCC的轉化。這些效應通過添加WR而逆轉。這些結果表明,基質WR生態位環境調節PCC-NOS和SRCC之間的病理組織亞型規范。

SRCC和PCC-NOS在克隆上是相同的,并且它們的形態受到細胞外Wnt和R-spondin表達的調節。 該文章結果解釋了人類彌散性GC中的遺傳突變和腫瘤環境如何塑造病理組織學和生物學表型。






