單細胞轉錄組分析明確了鼻咽癌中腫瘤細胞、病毒感染和微環(huán)境之間的相互作用

鼻咽癌(NPC)是最常見的頭頸部腫瘤,起源于鼻咽部上皮細胞,在華南及東南亞地區(qū)高發(fā)。eb病毒(Epstein-Barr virus, EBV)是一種屬于γ-皰疹病毒家族的皰疹病毒,被認為是鼻咽癌的致病因子。部分ebv編碼基因參與鼻咽癌的發(fā)生發(fā)展。例如,LMP1可激活宿主NF-κB、PI3K/AKT、ERK/MAPK和JAK/STAT信號通路,促進細胞增殖和抗凋亡。以往對鼻咽癌的發(fā)病機制和分子基礎的研究主要集中在其易感基因、基因組改變和基因表達模式(在宿主和EBV中)以及宿主病毒相互作用等方面。然而,這些研究很大程度上依賴于僅從整體角度研究腫瘤的方法,限制了它們在解剖腫瘤微環(huán)境(TME)中的亞群事件如瘤內(nèi)異質性(ITH)和多細胞亞型等方面的能力。為了更深入地了解鼻咽癌的多細胞生態(tài)系統(tǒng),此篇文獻運用scrna測序技術(single lecell RNA sequencing, scRNA-seq),同時對鼻咽癌中惡性細胞、EBV、基質細胞和免疫細胞的轉錄組進行測序,并系統(tǒng)地比較腫瘤和非惡性組織的微環(huán)境。
2020年9月,來自北京大學生物醫(yī)學前沿創(chuàng)新中心、生命科學學院白凡研究員團隊與中山大學腫瘤防治中心曾木圣/鐘茜教授團隊合作在Cell Research雜志上發(fā)表了文章“Single-cell transcriptomic analysis defines the interplay between tumor cells, virus infection, and the microenvironment in nasopharyngeal carcinoma”。
在這項研究工作中,研究人員首先利用Smart-seq2和10x Genomics兩種單細胞轉錄組技術平臺對19個EBV+ NPC患者的腫瘤樣本(其中3例有配對轉移位組織),以及7例非腫瘤患者的鼻咽組織樣本應用scRNA-seq技術,共捕獲到大約104,000個單細胞。經(jīng)過深入的生物信息學分析,研究人員在單細胞水平全面系統(tǒng)的描繪了腫瘤細胞、EBV、間質和免疫細胞等的轉錄組圖譜。同時,研究人員在單細胞水平揭示了NPC腫瘤內(nèi)部異質性,以及原位和轉移位腫瘤組織潛在的播散關系。對EBV基因表達圖譜特征分析表明,EBV潛伏期和裂解期基因可在宿主同一腫瘤細胞內(nèi)共表達。
技術路線:
一、鼻咽癌多細胞生態(tài)系統(tǒng)的單細胞轉錄組分析
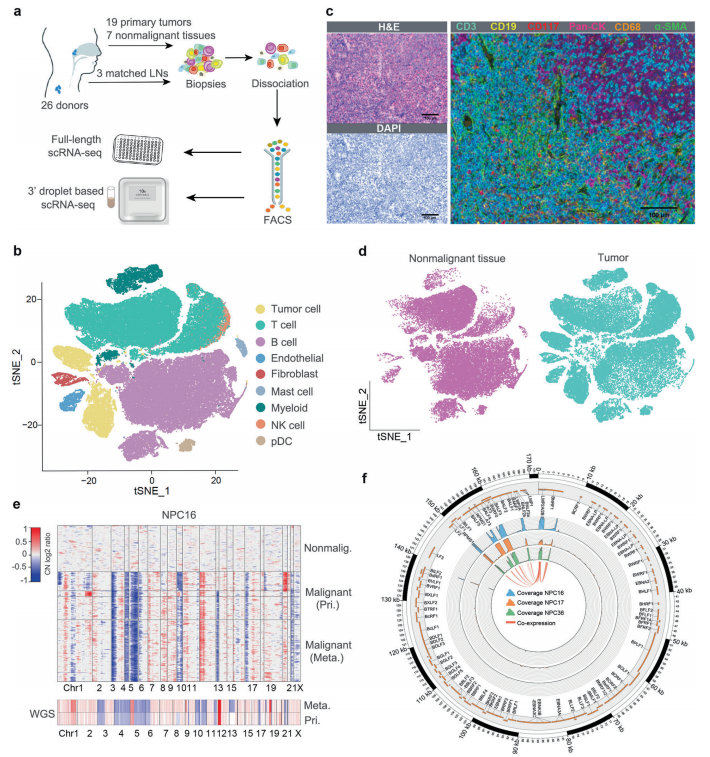
A.展示了使用兩個平臺進行樣本收集、單細胞分離、分類和scRNA-seq的流程。
b t-SNE圖來自10個基因組體的所有單細胞。
c抗cd3 (T細胞)、抗cd19 (B細胞)、抗cd117(肥大細胞)、抗pan - ck(腫瘤細胞)、抗cd68(巨噬細胞)和抗α- sma(成纖維細胞)抗體的多重免疫組化染色。比例尺,100μm。d t-SNE圖比較來自腫瘤和非惡性組織的單細胞分布。
e上圖顯示了基于scRNA-seq數(shù)據(jù)推斷的典型腫瘤(NPC16)中單細胞CNVs的大尺度變化。下圖顯示了全基因組測序推斷出的CNVs。
f來自三種腫瘤的單個細胞中顯示ebv衍生測序的總覆蓋的Circos圖。EBV基因是根據(jù)它們的位置和CDS區(qū)域繪制的。潛在的共表達基因區(qū)域通過寬度與單個細胞中共表達事件的數(shù)量成比例的條帶連接。
二、破譯表達式程序揭示了惡性細胞上皮免疫的雙重特征
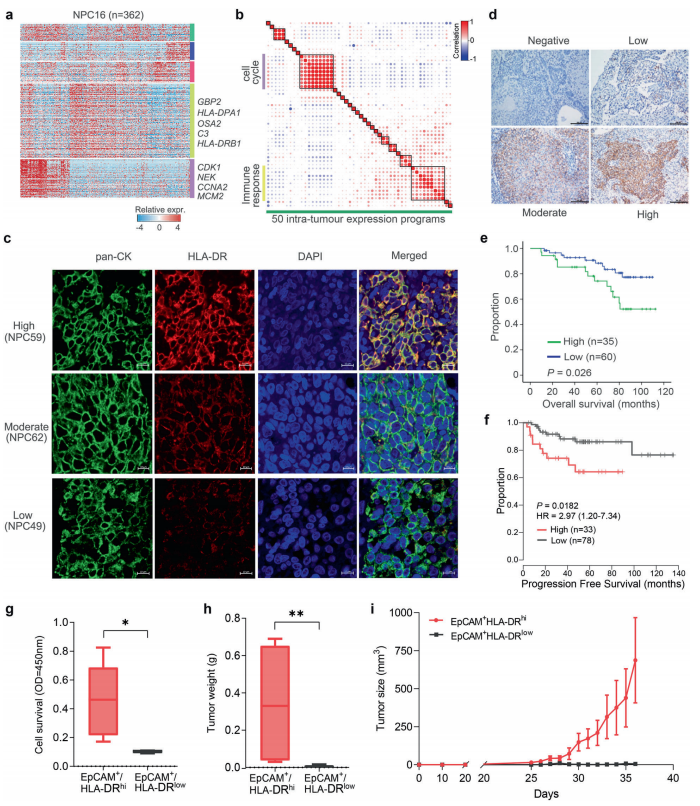
a使用NMF從代表性腫瘤(NPC16)中破譯出的基因表達程序的熱圖。
b 50個腫瘤內(nèi)表達程序的Pearson相關性聚類。網(wǎng)點大小與相關系數(shù)的絕對值成正比。
c鼻咽癌中HLA-DRB1免疫組化染色梯度。Top, HLA-DR在NPC59組織中具有強免疫反應性;中等HLA-DR在NPC62組織中的免疫反應性;下為HLA-DR在NPC49組織中的弱免疫反應性。pan-CK作為鼻咽癌腫瘤細胞的生物標志物,DAPI作細胞核染色。比例尺,10μm。
d抗hla - dr免疫組化染色。比例尺,100μm。
e HLA-DR高表達或低表達患者的總生存期。
f從大量RNA-seq數(shù)據(jù)推斷不同ISs患者的無進展生存期。
g通過CCK-8試驗比較C17鼻咽癌異種移植物的is -高和is -低細胞存活率。IS-high, EpCAM+HLA-DRhi; IS-low, EpCAM+HLA-DRlow。h, i在注射C17 NPC異種移植瘤的is -高、is -低群體的裸鼠中腫瘤重量和大小的比較。數(shù)據(jù)為SEM的平均值。高,EpCAM + HLA-DRhi;低,EpCAM + HLA-DRlow
三、鼻咽癌T細胞聚類及狀態(tài)分析
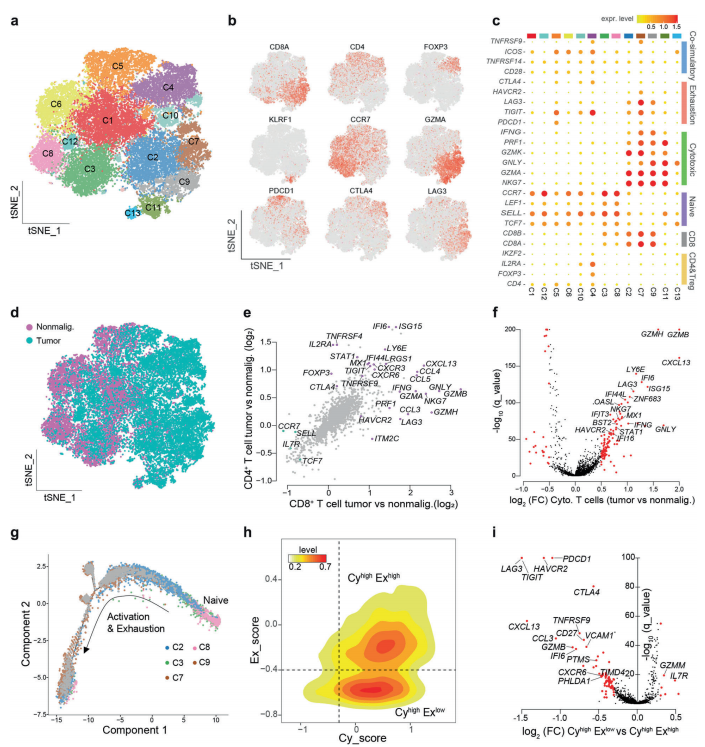
A. 將所有的細胞分為13組,證實了T細胞群的功能異質性.
B-C.調(diào)查了13個集群中典型T細胞標記物的表達和分布.C4細胞主要來源于腫瘤(補充信息,圖S5c),這表明鼻咽癌的免疫微環(huán)境偏向于更耐受性的環(huán)境。C5細胞中PDCD1和CXCL13高表達(圖3b, c),C4簇代表FOXP3、IL2RA和IKZF2高表達的調(diào)節(jié)性T細胞(treg).。C2、C7和C9的T細胞顯示NKG7和GZMK等細胞毒性標記物高表達(圖3c)。
有趣的是,C2、C7和C9的衰竭標志物表達不同
D. 來自腫瘤和非惡性組織的T細胞分布呈二分性(圖3d)
E-F.在腫瘤源性CD4+和CD8+ T細胞中,共刺激和共抑制受體(如TNFRSF9和TIGIT)以及趨化因子受體(如CXCR3和CXCR6)均上調(diào)(圖3e)。比較了腫瘤來源和非惡性組織來源的細胞毒性CD8+ T細胞、treg細胞和自然殺傷細胞(NK)的表達譜(圖3f)
G.CD8+ T細胞的發(fā)育軌跡,并根據(jù)典型標志物的表達計算每個細胞的細胞毒性評分和衰竭評分.
H.雖然大多數(shù)CD8+ T細胞遵循激活耦合衰竭的趨勢,但仍有一部分細胞表現(xiàn)出較高的細胞毒性但較低的衰竭狀態(tài)(圖3h).
I.在CyhighExhigh組中,眾所周知的衰竭標志物,如PDCD1、LAG3、TIGIT和HAVCR2顯著上調(diào)。值得注意的是,我們還確定了潛在的新衰竭標志物,包括VCAM1、PTMS和TIMD4(圖3i).
四、鼻咽癌中髓細胞和間質細胞聚集及狀態(tài)分析
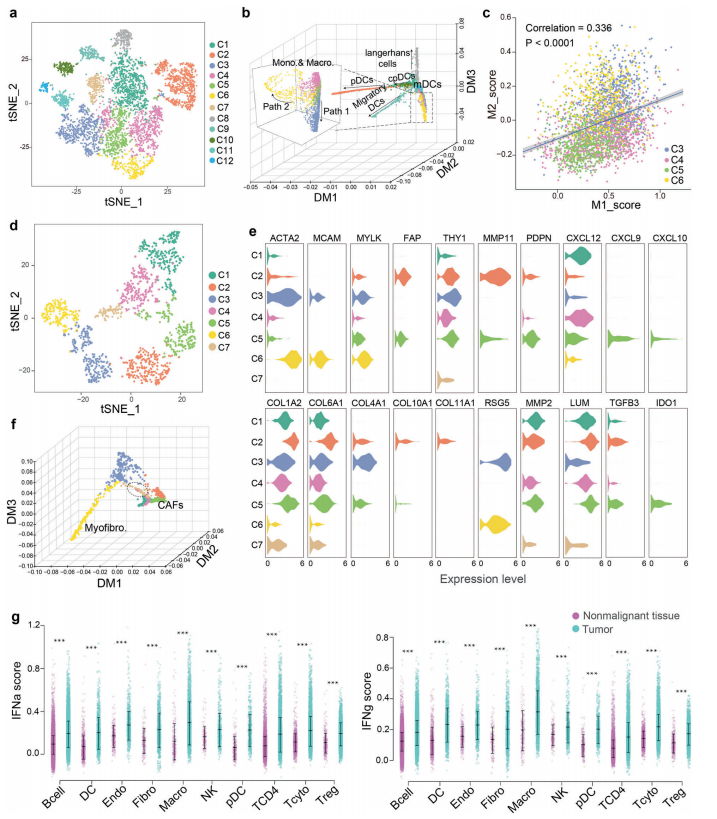
A. 分析了6053個髓系細胞的轉錄組,包括4646個腫瘤源性細胞和1407個非惡性組織源性細胞。
髓細胞表現(xiàn)出顯著的異質性,分為12組.Cluster C2高表達IGJ基因,代表pDCs。C8簇由于其FCER1A的高表達,具有腫瘤特異性,與朗格漢斯細胞相對應。C9集群專門表達CCR7,并代表遷移的DCs.
B. 簇C3、C4、C5和C6代表單核細胞/巨噬細胞,如CD14、CD163和CQ1B等基因構建了一個彌散圖來描繪骨髓細胞的發(fā)育軌跡.
C. 4個單核/巨噬細胞簇中M1和M2信號呈顯著正相關.
D. 捕獲了1416個成纖維細胞的轉錄組,其中1195個來源于腫瘤組織,221個來源于非惡性組織。利用基于圖的聚類,我們鑒定出7個成纖維細胞簇。
E. 集群C3和C6顯示ACTA2、MCAM和MYLK的高表達水平,從而代表肌成纖維細胞.
F. 纖維細胞的發(fā)育軌跡顯示肌成纖維細胞和CAFs譜系不同(圖4f).
G. 鼻咽癌主要細胞類型IFN-α和IFN-γ評分顯著升高,表明鼻咽癌TME中IFN應答整體上調(diào)(圖4g)。
五、NPC中TME成分和細胞間相互作用
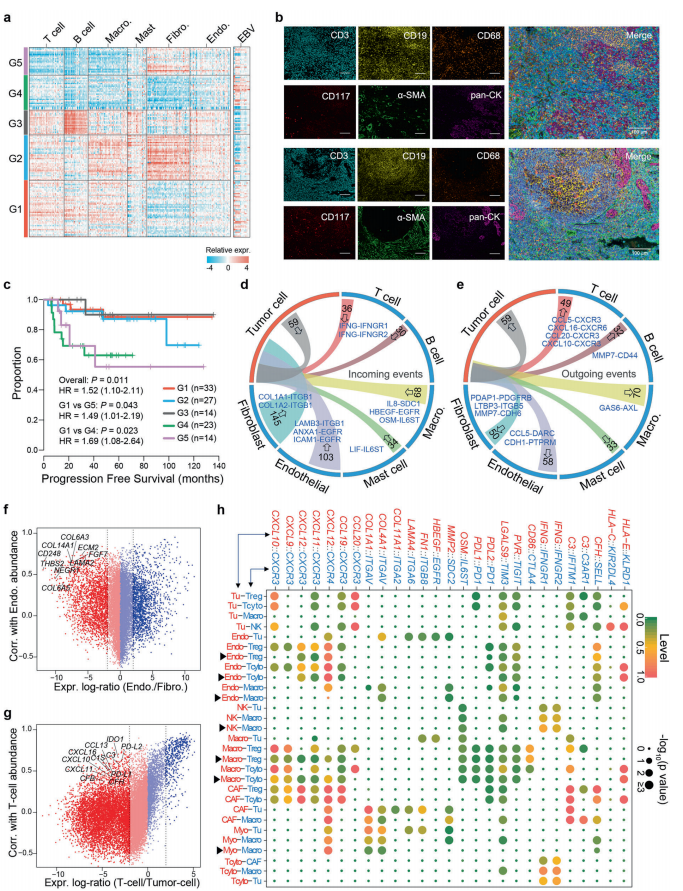
A. 分析了這些標記在RNA-seq中的表達模式。我們分析了140例初治患者鼻咽癌原發(fā)腫瘤的基因表達譜,并根據(jù)其TME組成的顯著差異將其分為5組(G1-G5)(圖5a)。G4和G5腫瘤表現(xiàn)出較低的免疫細胞相關特征,而G5腫瘤表現(xiàn)出較高的纖維母細胞相關特征。G1、G2、G3腫瘤免疫細胞豐度較高。特別是,G3腫瘤中含有更多的B細胞,而G2腫瘤中纖維母細胞的比例明顯更高(圖5a)。
B. 為了驗證基于RNA-seq數(shù)據(jù)的TME分層,我們在額外的鼻咽癌樣本中對不同的免疫細胞和基質細胞進行多重免疫組化染色(圖5b)。
C. 檢查了這些患者的臨床記錄,發(fā)現(xiàn)分成5組的患者表現(xiàn)出不同的無進展生存期(PFS)(圖5c)。
D. 大多數(shù)腫瘤細胞的傳入事件是由成纖維細胞介導的,因為成纖維細胞表達明顯更高數(shù)量的有效配體,其受體被腫瘤細胞表達(P < 0.01).
E. 鼻咽癌腫瘤細胞通過CXCL10 CXCR3和CXCL16 CXCR6等相互作用對T細胞表現(xiàn)出明顯的趨化作用(圖5e).
F. 結合單細胞轉錄組和大量RNA-seq,我們確定了主要在一種細胞類型中表達的基因,但與其他細胞類型的豐度相關。例如,COL6A3、COL14A1和CD248在成纖維細胞中高表達,并與TME中EC豐度呈正相關(圖5f).
G. 與黑色素瘤不同,補體基因如C1S、C3、CFH和CFB也在鼻咽癌腫瘤細胞中廣泛表達,并與T細胞豐度相關.
H. TME中不同細胞類型與非惡性微環(huán)境之間的特異性配體受體相互作用(圖5h).
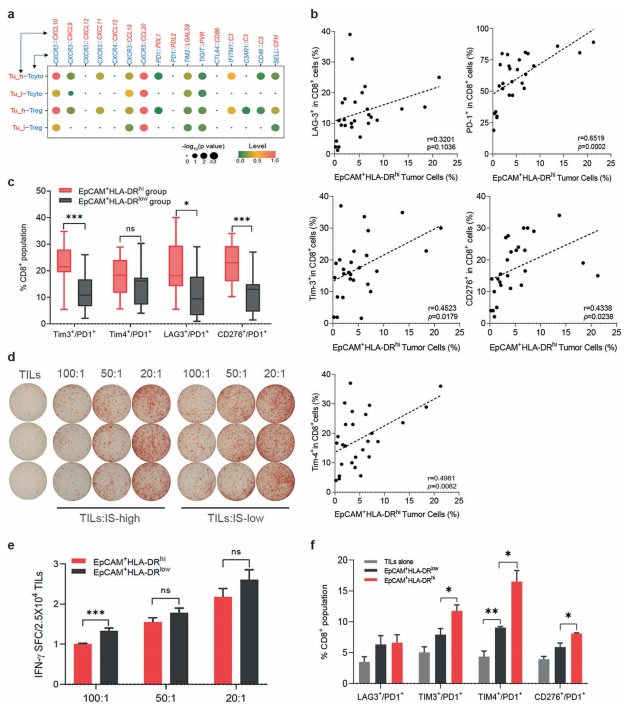
A.與IS-low水平腫瘤細胞相比, IS-high水平腫瘤細胞對T細胞表現(xiàn)出更強的配體受體相互作用,如CXCL11 CXCR3、C3 IFITM1、PDL1 PD1,這說明IS high水平腫瘤細胞具有更大的免疫招募、調(diào)節(jié)和抑制潛能(圖6a)。
B. 在其他鼻咽癌組織上使用熒光激活細胞分選(FACS),檢測了TILs上的共抑制受體(如PD-1、lag3、TIM-3、TIM-4和CD276)的表達,并發(fā)現(xiàn)CD8+ TILs上的表達與同一鼻咽癌組織中IS-high腫瘤細胞的豐度呈正相關.
C. 腫瘤的雙重特征與CD8+ T細胞中共抑制受體的表達相關,如TIM-3/PD-1、lag3 /PD-1和CD276/PD-1,反映了CD8+ TILs更深層次的功能障礙(圖6c).
D-E.通過ELISPOT實驗檢測TILs與IS-high腫瘤細胞共培養(yǎng)產(chǎn)生的IFN-γ較少(圖6d, e)。
F.高is腫瘤細胞具有更強的免疫抑制能力。通過將腫瘤細胞與TILs共培養(yǎng),與is低的腫瘤細胞相比,is高的腫瘤細胞誘導具有共抑制受體表達的CD8+ TILs比例更高(圖6f)






