miR-142-5p誘導IDO促進免疫抑制
對免疫療法的臨床反應與免疫抑制腫瘤微環境(TME)密切相關,并受腫瘤細胞與淋巴管內皮細胞(LEC)之間動態相互作用的影響。本文發現晚期宮頸鱗狀細胞癌(CSCC)分泌的外泌體(LV)傳遞miR-142-5p通過誘導吲哚胺2,3-加雙氧酶(IDO)作用于CSCC的免疫TME,促進疾病進展。本文于2020年9月發表于《Cell Death & Differentiation》IF:10.717。
本文技術路線如下:

本文主要結果:
1、在CSCC進展過程中,miR-142-5p表達與淋巴細胞IDO表達相關,并與浸潤的CD8+ T細胞數量負相關。
為了評估CSCC進展過程中miR-142-5p表達,作者使用ISH分析了116個病人的組織微陣列,與早期組織相比,miR-142-5p的表達和癌周的IDO陽性LV的比例都在晚期組織中顯著上調,但是CD8+ T細胞數量在CRCC進展中減少了。因此,miR-142-5p的表達與癌周的IDO陽性LV的和總的LV數量呈現正相關性,和浸潤的CD8+ T細胞數量負相關。此外,淋巴管的miR-142-5p與IDO表達在腫瘤中的共定位與腫瘤中miR-142-5p高表達有關,表明腫瘤來源的miR-142-5p轉運至癌周LV中可能上調了淋巴管IDO的表達。

圖1在CSCC進展過程中,miR-142-5p表達與淋巴細胞IDO表達相關,并與浸潤的CD8+ T細胞數量負相關。
2、miR-142-5p可能通過CSCC分泌的外泌體轉運至人真皮淋巴內皮細胞(HDLECs)
作者接下來探究了miR-142-5p是否通過外泌體途徑參與了CSCC細胞與HDLEC細胞間的串擾。如圖2A-C所示,是提取的CSCC分泌的外泌體,具有典型的外泌體特征,隨后與HDLEC共孵育,結果顯示,綠色熒標記的外泌體均可被其吸收內化,但是與對照組外泌體相比,miR-142-5p外泌體組孵育后的HDLEC細胞中miR-142-5p的表達顯著更高。

圖2 miR-142-5p可以通過CSCC分泌的外泌體轉移到HDLECs
3、CSCC分泌的外泌體miR-142-5p上調淋巴管IDO的表達
進一步分析外泌體miR-142-5p介導的淋巴管IDO表達的生物學功能,分析了HDLEC細胞與CSCC外泌體孵育48小時后的IDO的表達。結果顯示,與對照組相比,經miR-142-5p mimics處理的或者外泌體miR-142-5p處理的HDLEC細胞中IDO的表達顯著升高(Fig. 3a)。由于IDO酶降解色氨酸并生成色氨酸分解代謝產物犬尿素,作者使用高效液相色譜法測定培養基中色氨酸和犬尿素的濃度。犬尿素比色氨酸(K:T)的比例升高,表明IDO活性升高,這在miR-142-5p mimics處理的或者外泌體miR-142-5p處理的HDLEC細胞上清中都能觀察到(Fig. 3b)。這與IDO蛋白質水平的趨勢一致。
為了評估外泌體miR-142-5p在體內淋巴表型重塑中的作用,將Siha細胞與Siha/miR-142-5p或miR-142-5p mimics的外泌體處理的條件HDLECs混合,皮下注射到小鼠右側。15天后,Siha細胞組顯示更高水平的淋巴管IDO和miR-142-5p表達以及血漿K:T的比例(Fig. 3c–f)。總之,CSCC分泌外泌體miR-142-5p上調淋巴管IDO表達。
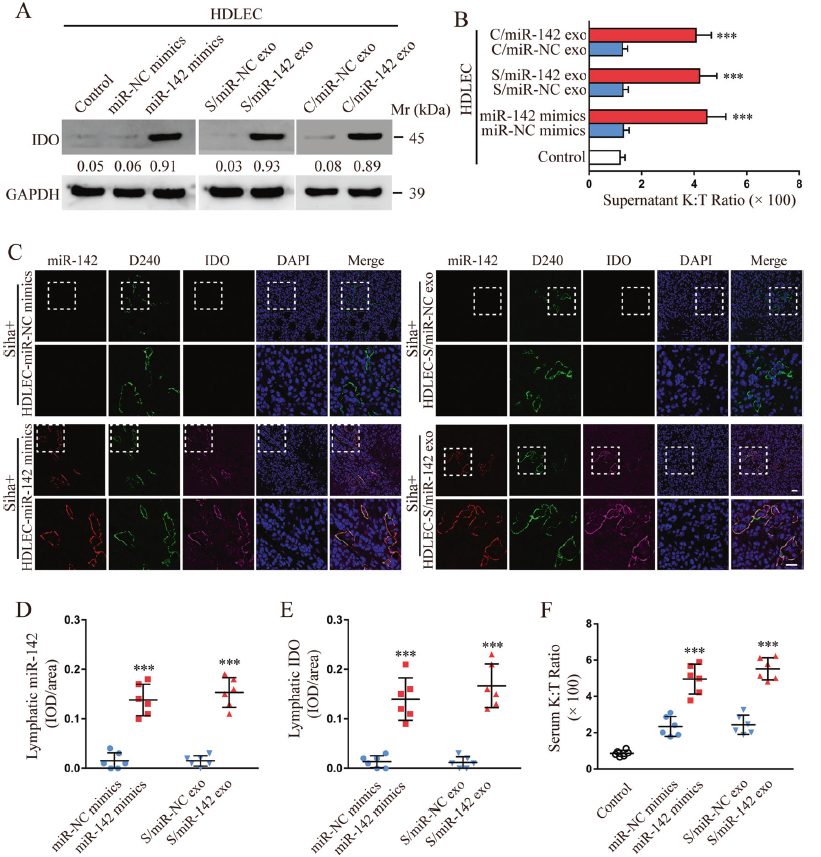
圖3 CSCC分泌的外泌體miR-142-5p上調淋巴細胞IDO表達
4、CSCC分泌的外泌體miR-142-5p在HDLECs細胞中直接靶向ARID2
隨后,使用三個數據庫共同預測到6個miR-142-5p的靶基因,經qPCR驗證后只有ARID2的表達發生顯著改變。熒光素酶實驗證實miR-142-5p與ARID2的在3’UTR存在直接相互作用,并且這種相互作用在用包含miR-142-5p的外泌體中也可檢測到,而在對照組外泌體檢測不到(圖4a-f)。進一步發現,干擾ARID2后IDO的表達顯著升高,而同時轉染miR-142-5p mimics則導致IDO的表達顯著下調;類似的,干擾ARID2后與外泌體對照組共孵育,IDO的表達顯著升高,而與包含miR-142-5p的外泌體孵育則顯著抑制IDO的表達(圖4g)。不僅如此,HDLEC細胞上清中K:T的比例也具有相同的變化趨勢(圖4h)。由于IFN-γ可誘導IDO表達,所以作者評估了IFN-γ的表達是否受到miR-142-5p/ARID2誘導。結果顯示,miR-142-5p過表達或ARID2干擾都導致淋巴管中IFN-γ的表達顯著上調,反之則下調。
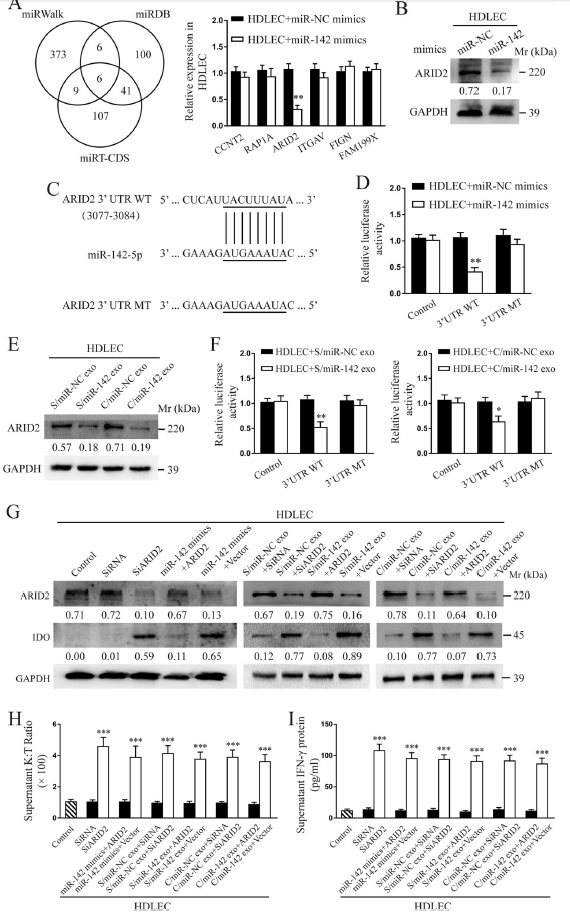
圖4 CSCC分泌的外泌體miR-142-5p在HDLECs細胞中直接靶向ARID2
5、ARID2通過招募DNMT1增強IFN-γ啟動子的甲基化
鑒于ARID2介導IFN-γ的表達,作者進一步探究兩者間是否存在直接連接。如圖5a,熒光素酶結果顯示在ARID2沉默或過表達細胞中IFN-γ的啟動子驅動的熒光素酶活性增加或減少。ChIP-PCR實驗顯示在ARID2中只有一個結合位點(?201 to ?360 bp)與IFN-γ的啟動子具有強烈的結合作用 (Fig. 5b)。因此,ARID2直接抑制IFN-γ的轉錄。
作為PBAF的一個亞基,ARID2具有表觀調控和調節基因轉錄的潛力。有研究表明DNMT1作為表觀調節者被ARID2招募以增強Snail啟動子的甲基化。這個結果促進了學者對ARID2- DNMT1復合物在IFN-γ轉錄調節中的理解。本文ChIP-RE-CHIP結果發現ARID2和DNMT1共同占用了IFN-γ的同一個啟動子區域(Fig. 5c)。并且,在ARID2過表達的HDLEC細胞中DNMT1與IFN-γ啟動子的結合增加了,ARID2干擾則相反,表明ARID2募集DNMT1只IFN-γ啟動子(Fig. 5d)。此外,本文還發現CpG(?153 to ?277 bp)與ARID2- DNMT1復合物在IFN-γ結合位點重疊(?201 to ?360 bp) (Fig. 5e)。實驗顯示,在ARID2過表達或干擾的HDLECs細胞中IFN-γ啟動子的甲基化會隨之上調或下調(Fig. 5f)。總之,這些結果表明ARID2抑制IFN-γ轉錄通過招募DNMT1至IFN-γ啟動子,進而上調啟動子的甲基化。
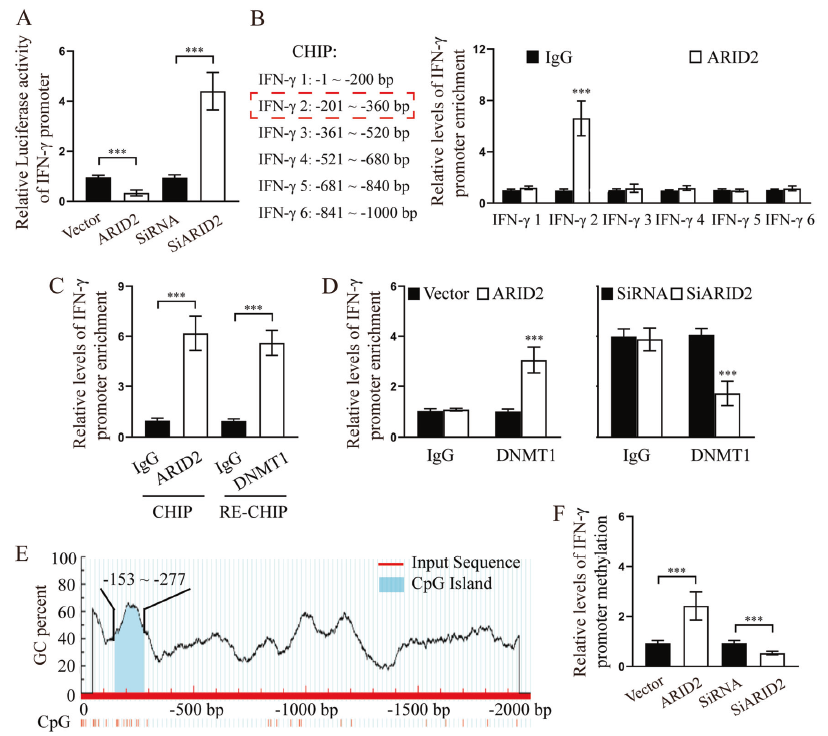
圖5 ARID2通過招募DNMT1增強IFN-γ啟動子的甲基化
6、miR-142-5p激活的HDLECs誘導IDO耗竭CD8+ T細胞
研究報道IDO促進免疫抑制通過減低CD8+ T細胞的響應。為了檢測HDLEC細胞暴露miR-142-5p是否促進CD8+ T細胞的免疫抑制作用,使用miR-142-5p和miR-142-5p mimics外泌體預處理的HDLEC細胞與CD8+ T細胞共孵育。結果發現被含有miR-142-5p外泌體預處理的HDLEC細胞會顯著降低CD69+(激活)的組分和 IFN-γ+ CD8+(影響子)T細胞組分(Fig. 6a, b),同時升高了PD-1+(抑制)和V+(凋亡)標記的CD8+T細胞組分(Fig. 6c, d)。此外,使用IDO阻斷劑或miR-142-5p抑制劑處理則顯著反轉了上述對CD8+ T細胞的抑制作用(Fig. 6a, d)。因此,IDO導致的免疫抑制是由miR-142-5p暴露介導的。
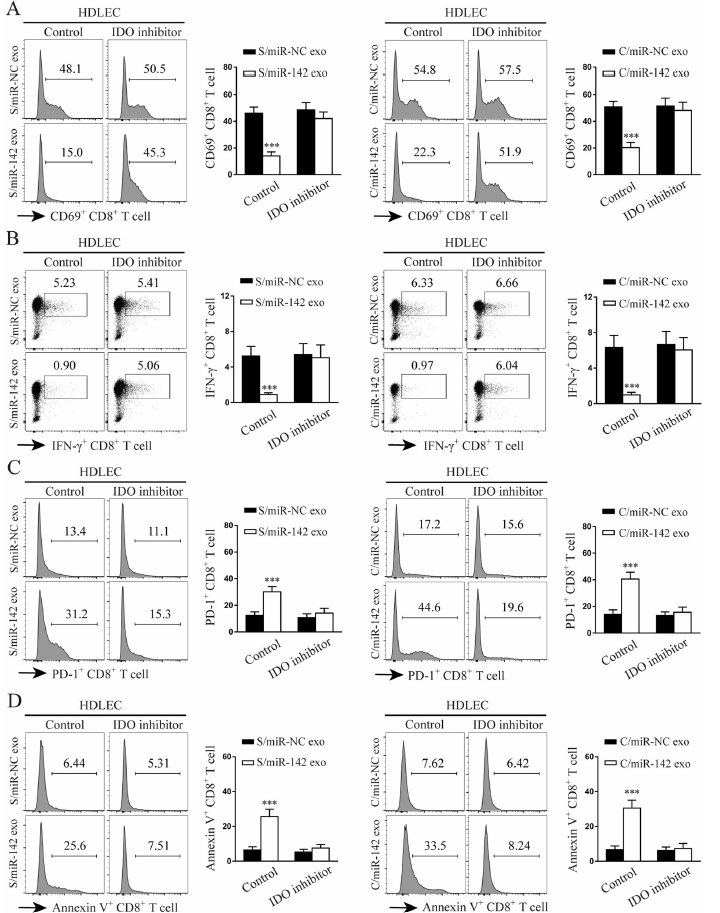
圖6 miR-142-5p激活的HDLECs誘導IDO耗竭CD8+ T細胞
7、血漿外泌體miR-142-5p水平與系統IDO活性和臨床CSCC病理進展相關
為了檢測腫瘤分泌的miR-142-5p能否再CSCC患者血漿中被檢測到,作者分離了27例早期和17例晚期CSCC患者以及8例健康人的外泌體,這些外泌體都具有典型的外泌體表型。進一步qPCR結果顯示,與健康組外泌體相比,CCC患者血漿分離的外泌體中miR-142-5p的表達顯著升高,其晚期的要顯著高于早期的(Fig. 7b),類似的趨勢也在K:T的比例中觀查到(Fig. 7c)。此外,血漿外泌體中miR-142-5p的表達與血漿中K:T的比例呈正相關(Fig. 7d)。
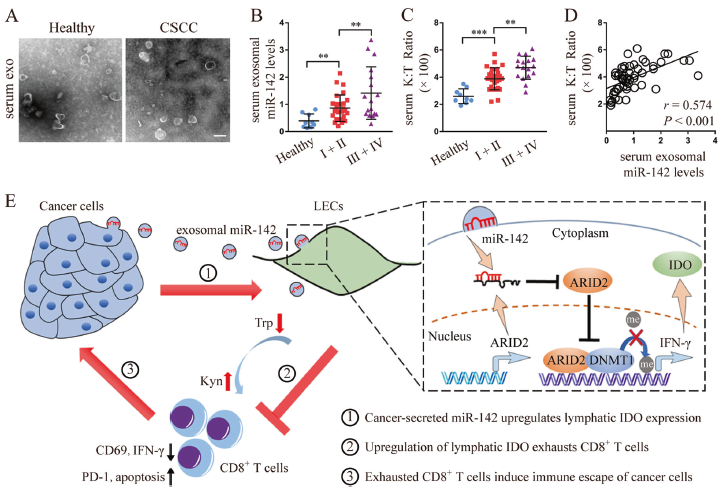
圖7血漿外泌體miR-142-5p水平與系統IDO活性和臨床CSCC病理進展相關
總之,本文的結果表明CSCC分泌的外泌體miR-142-5p下調淋巴管中ARID2的表達,抑制DNMT1募集至IFN-γ啟動子,并增強IFN-γ轉錄通過抑制啟動子甲基化,導致IDO活性升高隨后造成耗竭。






