乳腺癌內分泌治療耐藥?靶向PLK1試一試
雌激素受體(ER)陽性的乳腺癌(BC)患者占原發性乳腺腫瘤患者的80%以上,對ER陽性的BC患者利用內分泌治療來阻斷ER信號傳導是經典的治療方法。盡管內分泌治療提高了生存率,但依然存在耐藥的問題。目前,成功治療ER陽性的BC患者的主要挑戰是尋找內分泌治療耐藥后的新治療靶點。近日,居里學院的Elisabetta Marangoni教授團隊根據內分泌治療進展和椎體成形術后骨轉移患者建立病人來源異種移植(PDX)模型,并與早期原發性腫瘤進行比較,確定了轉移灶中與內分泌耐藥相關的新治療靶點PLK1,證明了PLK1抑制劑在高度增殖的CCND1驅動的PDX中導致腫瘤顯著收縮(包括不同的獲得性哌柏西利耐藥的RB陽性PDX)。相關研究結果以“PLK1 inhibition exhibits strong anti-tumoral activity in CCND1-driven breast cancer metastases with acquired palbociclib resistance”為題發表在Nature communications雜志上,雜志影響因子為12.121。
研究思路:
1.探究乳腺癌骨轉移PDX與原發性乳腺腫瘤間的基因表達差異集,篩選PLK1作為新治療靶點,并研究了PLK1抑制劑volasertib對腫瘤的作用。
2.探究volasertib在哌柏西利獲得性耐藥模型中的作用。
3.探究volasertib的適用性以及與療效有關的分子標志物。
4.探究PLK1表達水平與內分泌治療效果的關系。
結果:
1、PLK1是乳腺癌患者的新治療靶點
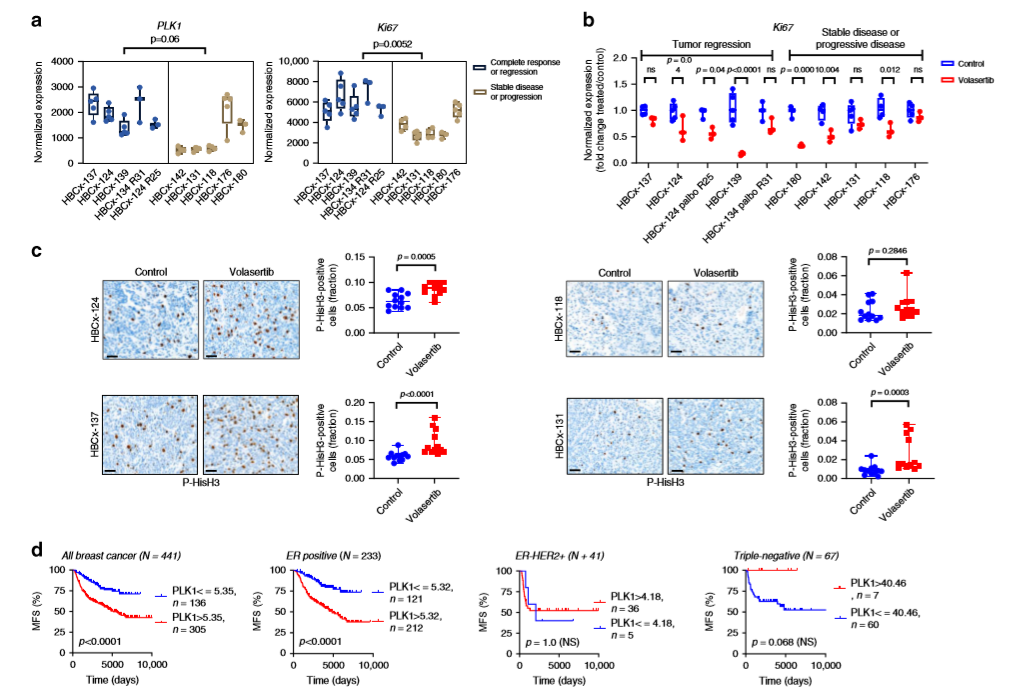
作者對PDX骨轉移模型和原發性乳腺腫瘤進行轉錄組比較分析,得到G2/M檢查點特征和有絲分裂紡錘體G2/M檢查點的差異表達基因集(a,b), 發現PDX骨轉移模型中與有絲分裂相關的不同靶標激酶上調,包括PLK1、AURKA、AURKB、CDK1和MPS1,而PLK1是PDX模型中上調最高的基因之一(c)。作者評估了基于侵襲性ER陽性的HBCx-137 PDX模型中PLK1抑制劑volasertib的療效,免疫組化結果顯示PLK1和Ki67在PDX、骨轉移病人以及原發乳腺癌腫瘤中強烈表達(d),發現原發乳腺腫瘤、骨轉移和PDX的CAN表達譜與FGFR1、FGFR2和CCND1的局部放大和CCNE2的CN增益高度相似(e),進一步研究發現,volasertib使腫瘤迅速縮小,并在4周內達到完全緩解,且哌柏西利單藥治療或與氟維司群聯合治療均表現穩定,在治療結束后6周,兩組volasertib治療的異種移植腫瘤復發,但再次經volasertib治療后腫瘤迅速減小(f)。作者進一步研究了在腫瘤治療中ER調控基因及其他相關基因的表達,發現在volasertib治療的異種移植腫瘤中ERG的表達變化不明顯,但CENPE的表達明顯增加(g)。這些結果表明,在該腫瘤中,volasertib的抗腫瘤活性是ER獨立,與增殖減少無關,與細胞周期阻滯在G2期有關,這與其已知的作用模式一致。
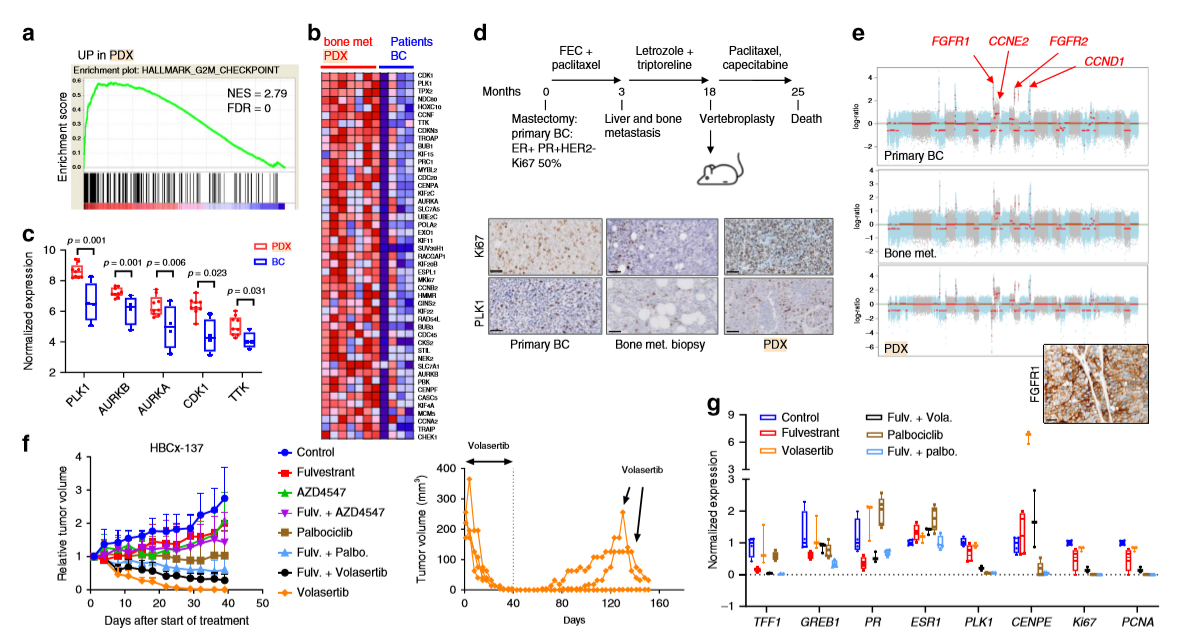
2、PLK1抑制劑對腫瘤的影響
作者基于診斷為轉移性BC的26歲患者構建PDX HBCx-124模型,發現FGFR1、MYC、CCNE2、CCND1和AURKA擴增,且該腫瘤模型對氟維司群耐藥,對volasertib反應完全,對哌柏西利±氟維司群穩定(a)。PDX HBCx-131模型來自一名乳房切除術后10年復發的41歲患者,而患者的乳腺腫瘤、骨轉移和PDX顯示FGFR1和CCND1擴增,骨轉移和PDX攜帶CDKN2A純合缺失,且PLK1和CDK4/6抑制劑并沒有阻止腫瘤的生長(b)。基于乳房切除術和輔助激素治療后9年復發的33歲BC患者構建PDX HBCx-139模型,發現該模型對volasertib和alpelisib (PI3K抑制劑)+氟維司群反應完全,對哌柏西利+氟維司群反應穩定(c)。總之,在fpur CCND1驅動的PDX模型中,靶向PLK1顯示顯著的腫瘤消退。
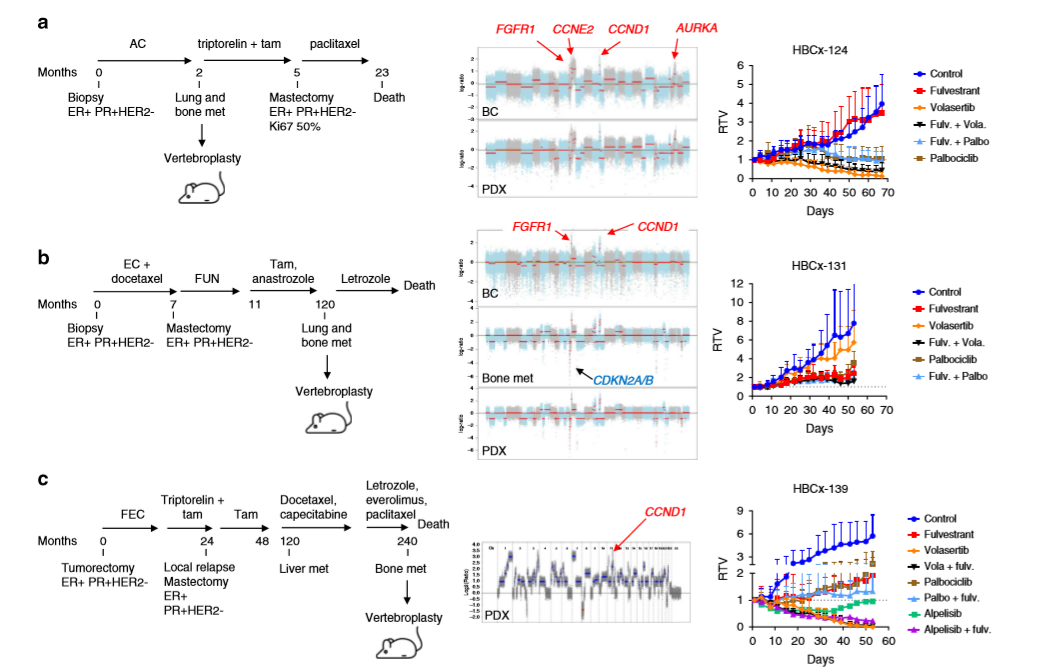
3、哌柏西利獲得性耐藥模型的構建和表達特征的探究
作者建立兩個哌柏西利獲得性耐藥PDX模型,第一個HBCx-134異種移植模型是基于攜帶PIK3CA突變的71歲乳腺癌骨轉移患者,該患者在新輔助治療中使用PI3K抑制劑聯合來曲唑治療,病理檢查發現患者對新輔助治療無響應,患者和PDX腫瘤均有CCND1擴增,且在PDX中發現CDKN2A純合缺失,進一步研究發現HBCx-134異種移植模型最初對哌柏西利有反應,通過長期暴露于CDK4/6抑制劑下建立了抗哌柏西利的PDX(a-b);異種移植的HBCx-134 Palbo R31模型對alpelisib和氟維司群具有交叉抗性,但對volasertib反應靈敏(d),而親本腫瘤和抗哌柏西利的異種移植物中磷酸化-RB的豐度也相似,說明在這個模型中,哌柏西利的抗性并非由于RB的缺失(e)。第二種哌柏西利獲得性耐藥模型來自于HBCx-124異種移植腫瘤,接受哌柏西利治療5個月后,腫瘤生長在腫瘤逃脫前2個月穩定(f),將HBCx-124 Palbo-R25重新植入另一組小鼠,發現對volasertib有顯著反應(g),且在palbo-R25 PDX中保存了磷酸化-RB的表達(h)。
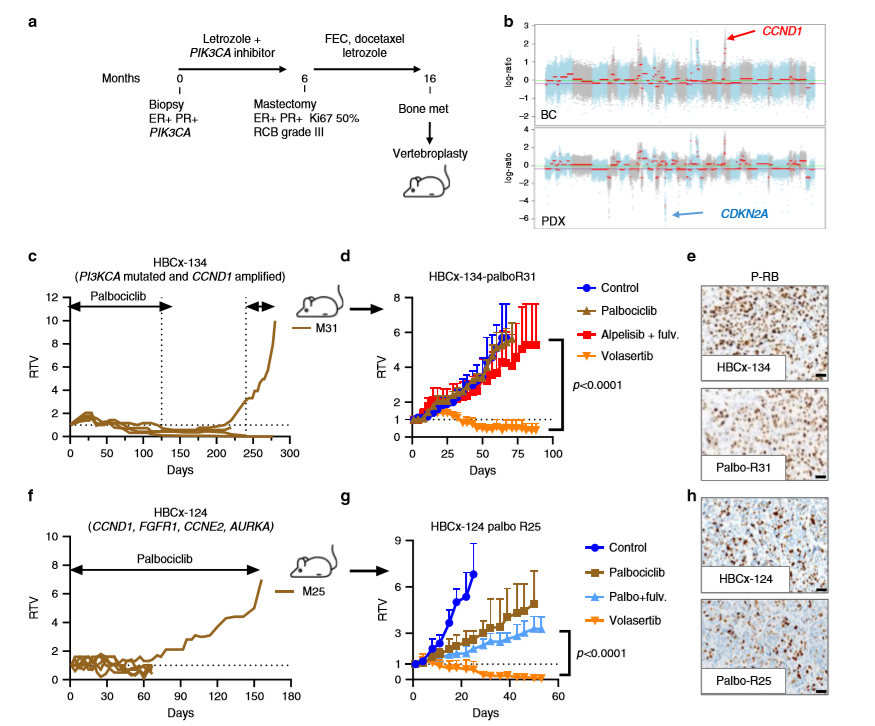
4、PLK1抑制劑適用性探究
PDX HBCx-180相對應的患者在乳房手術后14年和輔助內分泌治療結束后4年再次出現骨轉移,且在椎體成形術和建立PDX前接受了三個周期的哌柏西利+來曲唑和紫杉醇治療(a)。免疫組化結果表明PDX中Ki67和PLK1高表達、磷酸化-RB陽性(b)。研究發現PDX重現了對哌柏西利±氟維司群的耐藥性,并對volasertib有反應(c)。另一個模型PDX HBCx-176,來自于一位在乳房手術后14年因轉移性疾病復發的患者(具有NF1基因移碼插入),并在3個月的時間內接受了哌柏西利+來曲唑的治療(d)。免疫組化結果顯示PDX中P-RB呈陽性且P-ERK強表達(e),進一步研究發現HBCx-176經曲美替尼(MEK抑制劑)治療后腫瘤消退,但對哌柏西利和volasertib均耐藥(f)。這些結果表明,靶向PLK1是一種有效的治療方法,適用于ccnd1驅動的對哌柏西利獲得性耐藥的PDX模型。此外,NF1突變的腫瘤對哌柏西利和volasertib都有抗性,但對曲美替尼有反應。
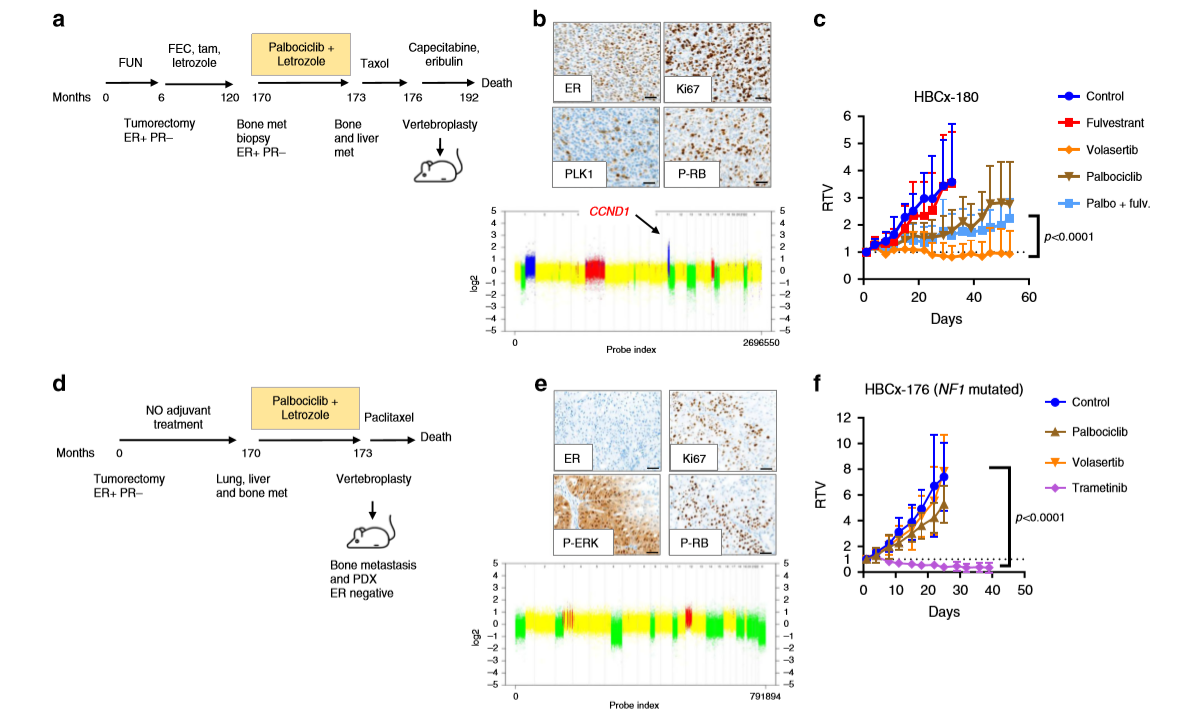
5、volasertib的療效與PLK1和Ki67表達相關
作者分析了7個PDX模型中PLK1和Ki67基因的表達水平,發現PLK1和Ki67基因在對volasertib完全應答或腫瘤消退的PDX中表達均較高(a),進一步分析了volasertib治療腫瘤模型中Ki67的表達情況,發現在六種PDX模型中,Ki67表達下降:腫瘤有反應的組中有三種,在病情穩定或進展的PDX組中有三種(b)。免疫組化表明在單次給藥(volasertib)24小時后P-HisH3染色增加在PDX HBCx-124和HBCx-137腫瘤細胞中達到10%,在HBCx-131模型中達到3%(c)。這些結果表明高增殖腫瘤對volasertib反應更強,并且與治療后有絲分裂停止有關。作者進一步分析了PLK1的預后意義,發現PLK1表達水平高的腫瘤患者的無轉移生存率 (5年MFS =68.4%,10年MFS =58.5%,15年MFS=49.8%)小于PLK1低表達腫瘤患者,且PLK1表達狀態在全球人群中的預后意義僅限于HR陽性(HR+HER2+和HR+HER2?)亞組,而在三陰性亞組和HR-HER2+亞組中未觀察到(d)。
6、體外PLK1與ER不相互作用
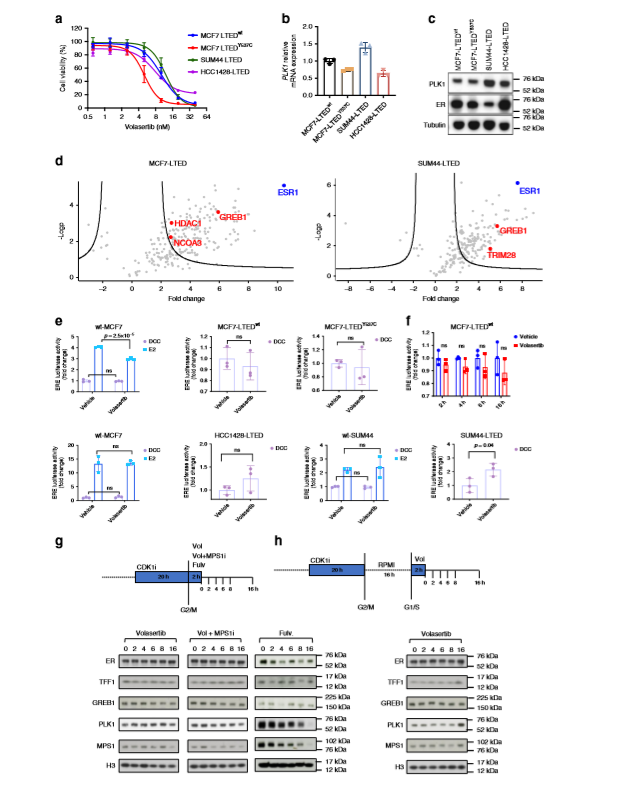
為了在體外分析PLK1和ER的相互作用,一組長期雌激素剝奪(LTED)耐藥的細胞系(含有自然發生的ESR1Y537S,ESR1Y537C或ESR1野生型)被置于不斷升高的volasertib濃度下,發現所有被測細胞系的增殖呈劑量依賴性下降(a),且PLK1的表達在mRNA或蛋白水平上都不是敏感性的決定因素(b,c),分析了在有雌激素的wt-MCF7和wt-SUM44細胞中RIME和二甲基標記以及沒有雌激素情況下比較了MCF7-LTED和SUM44-LTED,發現所有模型中最豐富的是與ER的交互,而主要的ER-交互作用是NCOA3、GREB1、TRIM28和HDAC1(d)。通過siRNA靶向PLK1和volasertib治療評估ER介導的反激活以及PLK1擾亂對特異性雌激素調控基因(ERGs)表達的影響,發現在雌激素存在或不存在的情況下,volasertib對PLK1的抑制對ER/ERE介導在wt-MCF7、wt-HCC1428和wt-SUM44中的反式激活影響很小或沒有影響,而在LTED模型中除了SUM44-LTED外其他沒有明顯的顯著影響,在SUM44-LTED中,volasertib導致ER/ERE報告基因活性顯著上升(e)。作者進一步評估了volasertib處理MCF7-LTED細胞16小時后ER/ERE-熒光素酶活性,發現對激素獨立的轉錄活性無明顯影響(f)。通過RO3306(CDK1抑制劑)和volasertib±BOS172722(MPS1抑制劑)同步處理MCF7-LTED細胞,發現抑制PLK1對TFF1、GREB1或ER的豐度沒有影響,但在存在volasertib和BOS172722的情況下,MPS1表達量呈時間依賴性下降,表明細胞周期停止,同時發現其對照組氟維司群處理的細胞中ER、TFF1和GREB1的降低呈周期性,且氟維司群導致MPS1和PLK1在處理后4h減少,這與細胞周期阻滯相一致(g,h)。
7、PLK1與內分泌治療效果的關系
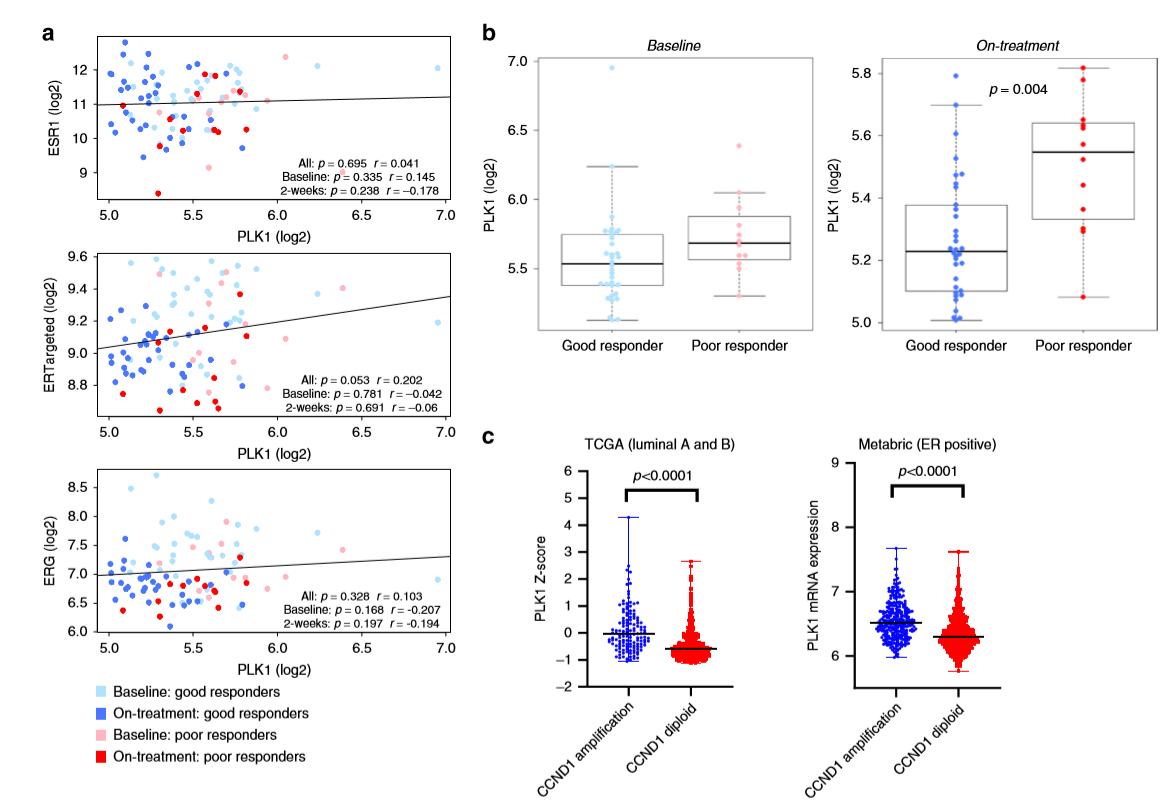
作者評估了69例接受單藥新輔助阿那曲唑治療兩周后的I期至IIIB ER陽性早期BC絕經患者中PLK1與ERG表達的關系,發現PLK1表達與ERGs無關(a), 且在同一組患者中發現PLK1表達水平高與阿那曲唑的不良反應有關(b)。通過TCGA和Metabric乳腺癌數據分析發現CCND1擴增的乳腺腫瘤中PLK1表達較高(c)。這些數據表明,PLK1在治療時表達水平高與內分泌治療的不良反應相關。
結論:
1.PLK1抑制導致高增殖的CCND1驅動PDX腫瘤收縮,包括不同的獲得性哌柏西利耐藥的RB陽性PDX。
2.PLK1表達水平高與較短的無轉移生存期和阿那曲唑的不良反應之間有很強的相關性。
參考文獻:
Elodie Montaudon, Joanna Nikitorowicz-Buniak, Laura Sourd et al. PLK1 inhibition exhibits strong anti-tumoral activity in CCND1-driven breast cancer metastases with acquired palbociclib resistance. Nature communications. 2020.






