頭頸癌細胞鐵死亡的奧秘
鐵硫簇合功能的喪失通過上調鐵饑餓反應使癌細胞易發生鐵死亡,但谷氧還蛋白5(GLRX5)沉默在鐵死亡中的作用尚不清楚。今天小編為大家介紹一篇發表于影響因子為8.579的“Theranostics”的文章“Inhibition of Glutaredoxin 5 predisposes Cisplatin-resistant Head and Neck Cancer Cells to Ferroptosis”,帶大家了解GLRX5功能喪失在促進順鉑耐藥頭頸癌(HNC)細胞鐵死亡中的作用。
在本文中,我們研究了磺胺嘧啶治療和GLRX5基因沉默對HNC細胞系和小鼠腫瘤異種移植模型的影響。我們通過細胞活力和死亡、脂質活性氧(ROS)和線粒體鐵產生、不穩定鐵池、mRNA/蛋白表達和丙二醛測定對此進行分析。
技術路線:

結果:
1.抑制GLRX5促進HNC細胞鐵性細胞死亡
Cyst(e)ine deprivation、erastin或SAS會誘導HNC細胞系鐵死亡。HN3和HN4細胞的存活率以Cyst(e)ine deprivation的時間依賴性方式和erastin或SAS的劑量依賴性方式降低(圖1A-C)。與HN3和HN4細胞相比,耐順鉑的HN3R和HN4R細胞對Cyst(e)ine deprivation、erastin或SAS治療的敏感性相對較低。接下來我們驗證了順鉑耐藥的HNC細胞鐵死亡誘導劑的低敏感性是否通過抑制GLRX5來克服的。GLRX5的基因沉默顯著增加了SAS誘導的鐵死亡引起的HN3R和HN4R的PI陽性細胞分數(圖1D-F)。去鐵胺預處理或與鐵抑制素-1或α-生育酚聯合處理可抑制細胞死亡。當siGLRX5轉染到兩個HNC細胞系中時,GLRX5的mRNA和蛋白質表達顯著降低(圖1G,1H)。此外,與載體對照組相比,GLRX5基因沉默也顯著增加了SAS處理的癌細胞的脂質ROS生成(圖1G–I)。
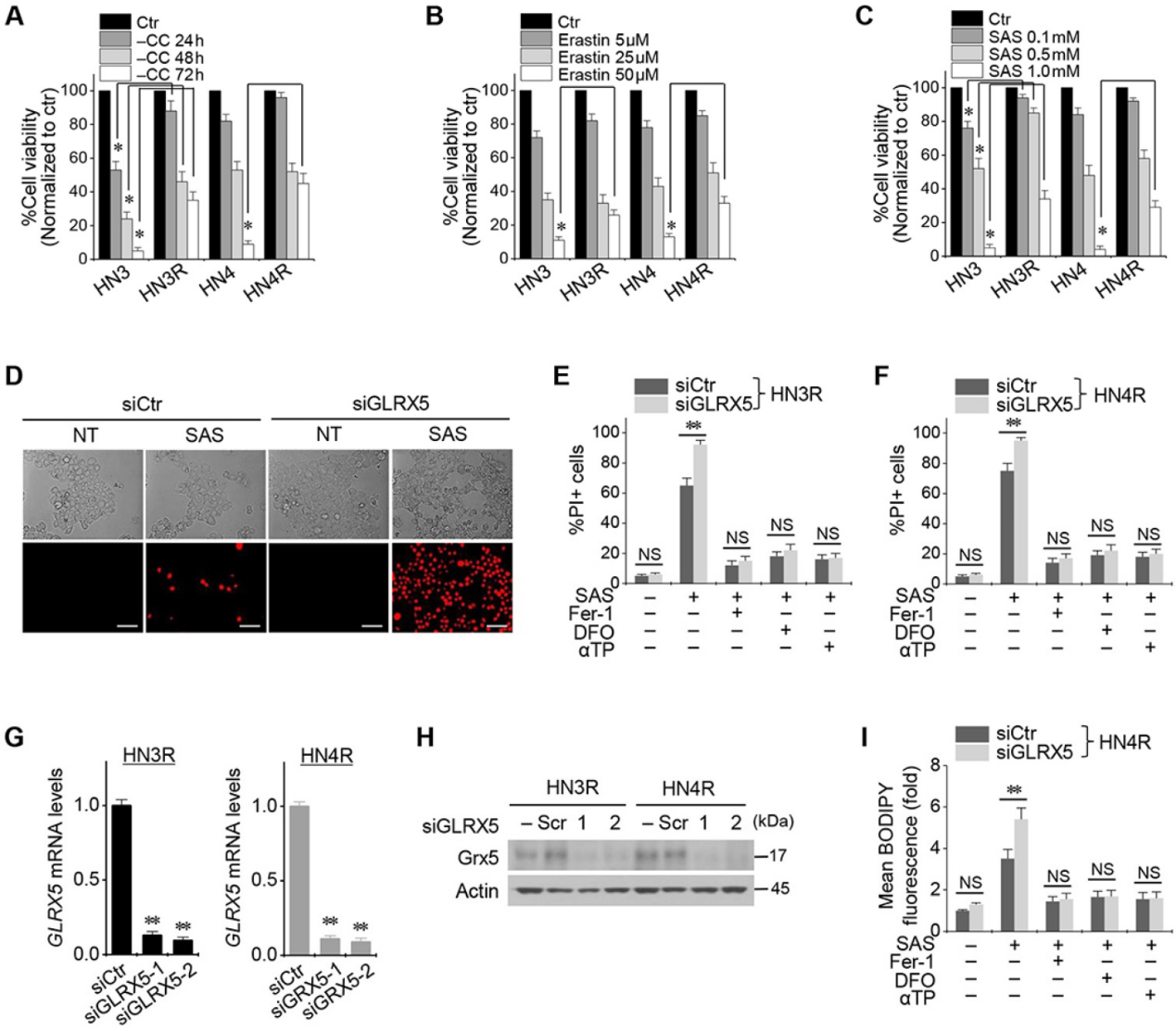
2.GLRX5基因沉默增加鐵死亡和脂質過氧化
當shGLRX5或載體在HN4和HN4R細胞中穩定轉化時,經SAS處理的兩種細胞系中PI陽性細胞分數顯著增加(圖2A-B)。穩定的shGLRX5轉導可顯著降低GLRX5的蛋白表達,但不影響xCT和GPX4這兩個與鐵死亡相關的關鍵分子(圖2C)。SAS誘導HNC細胞總ROS和脂質ROS水平顯著升高,GSH含量降低。與非載體或載體對照組相比,隨著GLRX5基因沉默,細胞和脂質ROS顯著增加(圖2D-E)。SAS處理降低了GSH水平,但對照組和shGLRX5基因沉默的HN4R細胞之間的GSH含量變化沒有顯著差異(圖2F)。
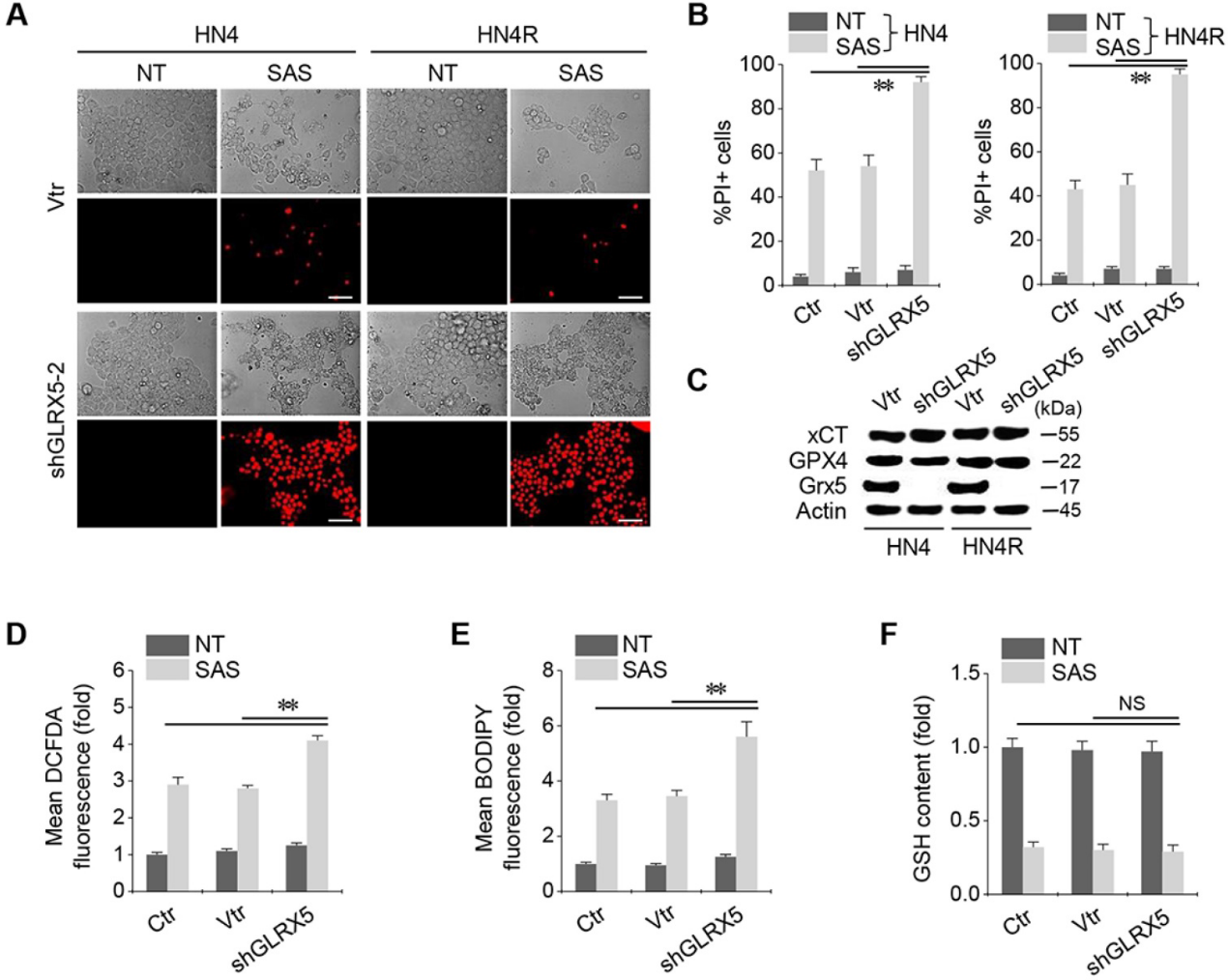
3.抑制GLRX5可提高細胞內游離鐵水平
在順鉑耐藥的HN3R和HN4R細胞中建立了穩定的GRX-shRNA和載體轉導。SAS處理可顯著提高HNC細胞的不穩定鐵和亞鐵(Fe2+)水平。SAS治療后LIP增加,shGLRX5轉化的癌細胞的LIP顯著高于非載體和載體對照組(圖3A-B)。SAS治療后,shGLRX5轉化的癌細胞的細胞和線粒體Fe2+水平顯著高于對照組(圖3C-D)。
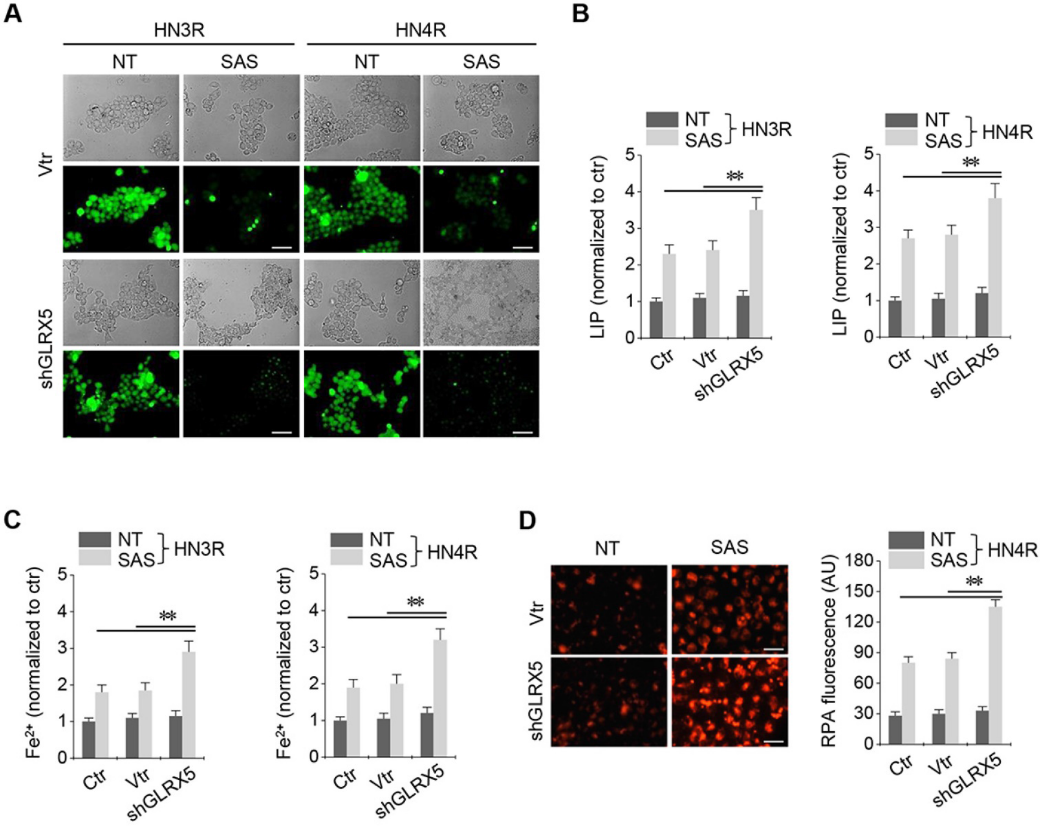
4.抗GLRX5 cDNA可挽救鐵死亡和游離鐵增加
用靶向于GLRX5和耐GLRX5 cDNA(GLRX5res)或無催化活性的突變GLRX5 cDNA(GLRX5res K101Q)共或不共轉導的shRNA轉染順鉑耐藥的HN4R細胞。GLRX5res轉導恢復了HN4R細胞中由shGLRX5穩定轉導抑制的GLRX5蛋白表達(圖4A)。經SAS處理的shGLRX5轉導細胞的PI陽性細胞分數比載體對照增加更多,而在shGLRX5和GLRX5res轉染的HN4R細胞中,PI陽性細胞百分率恢復到載體對照水平(圖4B)。shGLRX5基因沉默可顯著增加SAS治療后脂質ROS、LIP、游離鐵和線粒體鐵的積累,GLRX5res轉導可使其恢復(圖4C-F)。

5.抑制GLRX5可上調缺鐵反應
在HN4R細胞中建立了穩定的shGLRX5和一個抗性GLRX5res cDNA或一個無催化活性突變的GLRX5res K101Q cDNA的穩定轉導。GLRX5基因沉默增強了SAS治療后的鐵饑餓反應。在穩定轉染shGLRX5的HN4R細胞中進行SAS處理后,TfR1和IRP2的蛋白質和mRNA表達增加,但FTH1和Fpn的蛋白質和mRNA表達減少,通過共轉導耐藥的GLRX5res而恢復(圖5A-D)。此外,GLRX5基因沉默可顯著降低烏頭酸酶和α-KGDH活性,GLRX5res轉導可恢復它們的活性(圖5E-F)。GLRX5的蛋白質表達受到shGLRX5轉導的抑制,而GLRX5res或GLRX5res K101Q則恢復了這種表達(圖5G)。除了SAS治療外,GLRX5基因沉默導致增加的PI陽性細胞分數也被GLRX5res挽救(圖5H)。

6.GLRX5抑制可使抗治療HNC細胞對SAS治療敏感
所有小鼠在腫瘤細胞植入及SAS或載體治療期間及之后均存活良好。他們在治療28天后被死。轉染載體和shGLRX5的癌細胞之間的腫瘤體積和重量沒有差異(圖6A-B)。與載體對照組相比,SAS治療能顯著抑制體內腫瘤生長,這一點在shGLRX5轉化癌細胞移植的小鼠體內更為顯著。對照組和SAS治療組的體重和每日食物攝入量沒有顯著變化(圖6C)。SAS治療的腫瘤組織中脂質ROS、RPA和亞鐵的水平顯著高于載體對照組(圖6D-F)。此外,SAS治療后shGLRX5轉導的腫瘤中的脂質ROS、RPA和亞鐵水平的增加明顯高于載體轉導的腫瘤。GLRX5沉默導致TfR1增加和Fpn降低(圖6G)。當腫瘤經歷GLRX5沉默時,SAS治療的腫瘤組織中脂質ROS、MDA濃度的最終產物增加更多(圖6H)。

結論:
GLRX5的抑制通過增加細胞內游離鐵和脂質過氧化,促進鐵死亡。增強的鐵死亡被GLRX5res挽救。總之,GLRX5的抑制使耐治療的HNC細胞易發生鐵死亡。






