腸道菌群也能限制病毒感染和傳播?
基孔肯雅熱病毒(CHIKV)是一種可以通過蚊子傳播的新興的alpha病毒。盡管大多數CHIKV感染會導致持續數周的急性發熱性疾病,但其中一部分會持續數月至數年,持續發展為肌肉骨骼疼痛和炎癥。在感染的早期階段,先天免疫反應控制著CHIKV的傳播。CHIKV復制在人類患者和實驗感染的小鼠的血清中誘導I型干擾素(IFN)。盡管甲型病毒血癥是決定疾病嚴重程度和載體傳播的關鍵因素,但對影響人類宿主循環中病毒水平的獲得性和遺傳因素知之甚少。2020年6月29號,華盛頓大學醫學院的Winkler等人聯合發表于Cell的一篇文章。該文證明腸道微生物組調節先天免疫以控制循環單核細胞的α病毒感染。微生物組擾動會抑制pDC中的TLR7-MyD88反應,使I型干擾素產生減弱和單核細胞ISG表達。單個梭菌屬物種或其相關的次級膽汁酸可恢復抗病毒反應,從而抑制CHIKV感染。
文章亮點:
A 腸道微生物組的擾動導致甲型病毒感染增強
B 微生物組的改變減弱了單核細胞和pDC中的I型IFN反應
C 用單個梭狀芽胞桿菌共生可恢復抗病毒免疫力
D 次級膽汁酸可恢復pDC和IFN反應,從而限制CHIKV的傳播
技術路線:

結 果:
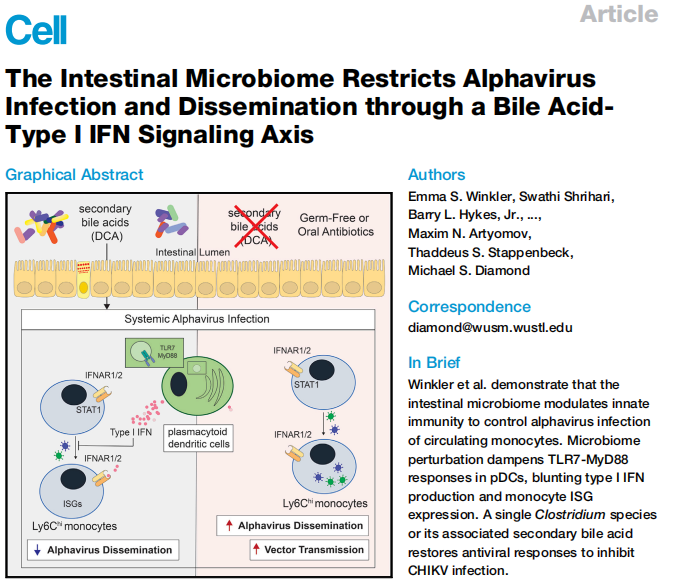
1.腸道微生物組的耗竭增加全身性CHIKV負擔
為了改變常規飼養的小鼠中腸道細菌微生物組的組成,動物接受了兩次口服Abx,氨芐青霉素和萬古霉素(AV)或媒介物治療3天。為了測試這些病毒學表型是否是由于腸道微生物組的改變而引起的,作者進行了微生物重建研究。為了確認腸道微生物在調節CHIKV感染中的作用,作者使用了一種生生物小鼠模型。結果在GF和Abx處理的小鼠中,發現腸道微生物組在調節全身部位CHIKV感染而不是在接種部位局部調節CHIKV感染中的作用。這些結果說明了,在無菌細菌小鼠或口服抗生素治療的常規飼養的小鼠腸道菌群耗盡的小鼠中,病毒接種后1天之內會出現更大的CHIKV感染和傳播。
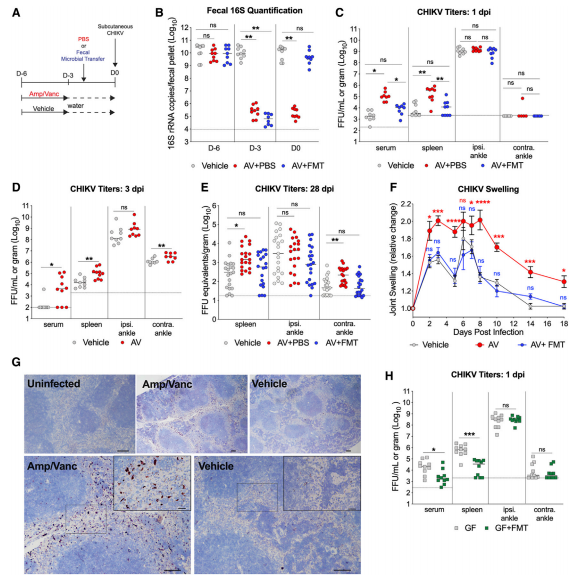
2.Abx處理或GF小鼠的循環單核細胞更適合CHIKV
鑒于經AV治療的小鼠脾臟紅髓中的病毒RNA含量增加,作者假設增強的傳播表型可能是由于循環髓樣細胞的感染所致。該實驗證實了腸道微生物組改變后生產性單核細胞感染。因此,微生物組調節Ly6Chi單核細胞對血液中CHIKV的允許性,從而影響感染早期的病毒血癥,即循環中的單核細胞表達較少的IFN刺激基因,并允許其感染CHIKV。
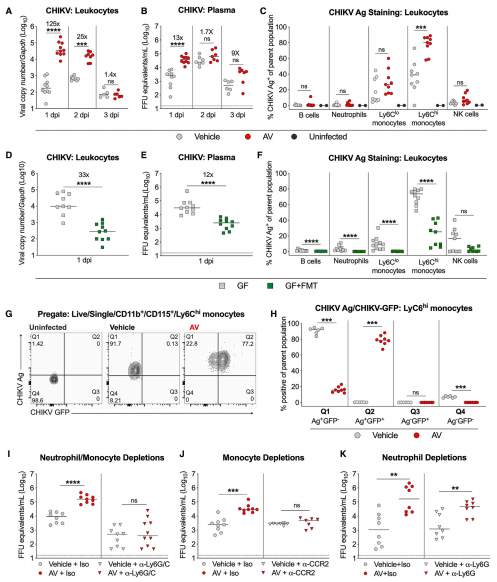
3.腸道微生物組的變化改變Ly6Chi單核細胞的抗病毒ISG反應
為了確定微生物組如何改變單核細胞對感染的敏感性,作者在未經媒介和經AV處理的未感染和CHIKV感染(1 dpi)小鼠中進行了外周血白細胞的單細胞RNA測序。通過使用抗體包被的磁珠進行陰性選擇,作者豐富了骨髓細胞。結果顯示,腸道微生物組的耗竭導致外周血單核細胞中ISG誘導的減少,這很可能使這些細胞被α病毒感染所允許。為了確定抗病毒應答中的微生物組依賴性差異是否是由于細胞內在變化或環境提示的改變所致,作者使用從AV或媒介物處理的CCR2 + GFP +轉基因小鼠中收獲的供體單核細胞進行了過繼轉移實驗。 結果表明,微生物組依賴性免疫提示可促進Ly6Chi單核細胞中的最佳抗病毒反應,從而限制α病毒感染。作者假設其他細胞類型可能無法產生I型干擾素,從而導致Ly6Chi血單核細胞中ISG應答減弱。結果表明,除I型干擾素外,其他抗病毒途徑也可能受到AV治療的影響。因此,在微生物組消耗后觀察到的病毒血癥差異取決于LysM +髓樣細胞(包括單核細胞)中的IFN和Stat1信號傳導。
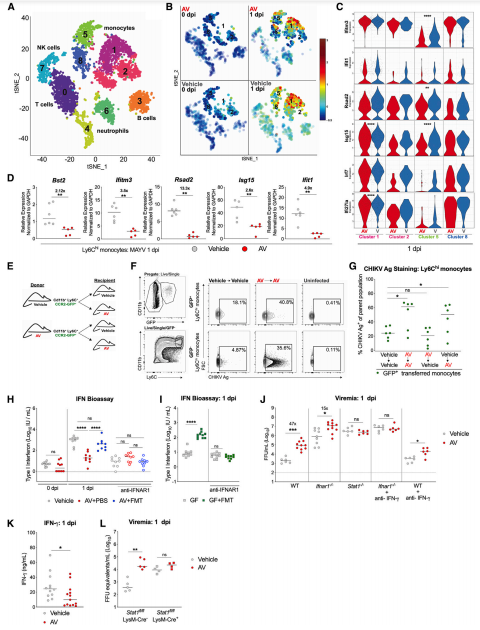
4.微生物組消耗后,細胞固有的方式會削弱pDC中的I型IFN誘導
生產I型IFN的介導和全身性CHIKV感染的抑制至少部分地由pDC介導,這是由腸道微生物組調節的。為了剖析腸道微生物組如何改變pDC的抗病毒功能,作者使用NanoString平臺在MAYV感染之前(第0天)或感染后1天使用分類的脾臟pDC詢問了547個免疫基因的表達水平。盡管ISG表達轉錄下降較大,但兩組的Ifna1和Ifna2水平相似。因為NanoString平臺中僅包含Ifna和Ifna2,所以作者使用qRT-PCR評估了Ifna4,Ifna5和Ifna6的表達。結果表明,腸道微生物組改變了pDC的抗病毒而非基礎轉錄免疫應答程序。鑒于AV治療小鼠的pDC中Irf7,Ifna5和Ifna6的表達水平降低,作者用CHIKV接種了AV或媒介物治療的Irf7 /小鼠,并測量了血清中的病毒載量。結果表明pDCs中I型IFN的產生受到腸道微生物組的調節,但僅在對特定的炎癥刺激作出反應時才觀察到差異。
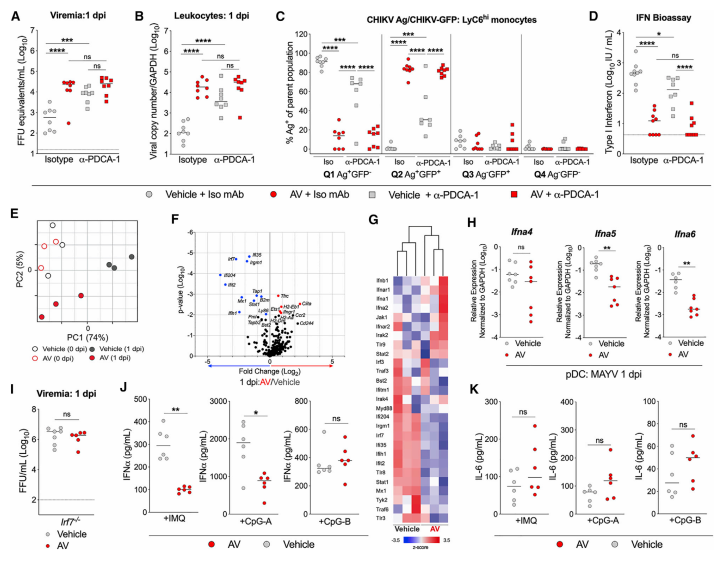
5.CHIKV傳播的微生物組依賴性限制取決于pDC中的MyD88信號傳導
作者評估了特定的模式識別受體信號通路是否介導了CHIKV感染的微生物組依賴性限制。為了確定pDC中是否需要MyD88信號傳導來產生I型IFN和控制CHIKV感染,作者使用了混合骨髓(BM)嵌合體來消除MyD88在pDCs中的表達。結果表明,pDC中依賴MyD88的信號傳導途徑整合了CHIKV感染后的微生物組信號和抗病毒反應。作者假設參與特定的MyD88依賴的TLR可能會觸發全身性IFN反應,從而限制血液中的CHIKV感染并阻止傳播。研究數據表明微生物組會影響pDC,因此它們可以通過TLR7和MyD88依賴性信號傳導軸快速響應循環中的CHIKV,從而產生限制單核細胞感染和病毒傳播的I型IFN反應。
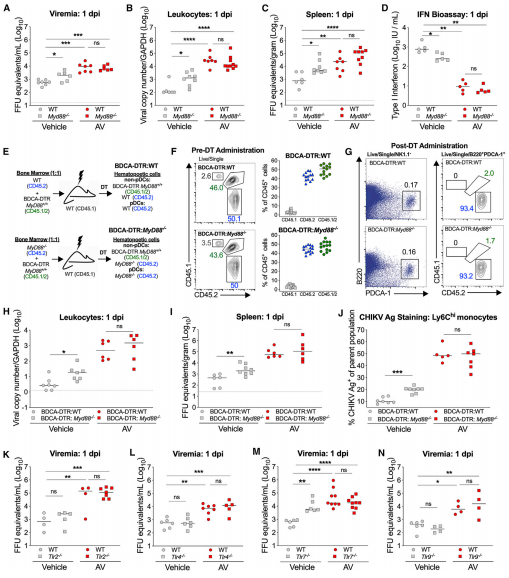
6.梭菌細菌定植限制了CHIKV感染
作者調查了特定的細菌類群或群落是否介導了微生物群的保護作用。因為CHIKV維持在傳播周期中,其中病毒血癥是媒介物感染的決定因素,所以作者評估了微生物組的操作是否會影響向蚊子媒介物的傳播。從接受媒介物或AV或AV處理的小鼠中以1 dpi采集血液,并定殖于梭狀芽胞桿菌,然后喂食白紋伊蚊。蚊子口服充血后,在7天后,通過實時定量PCR對包含唾液腺的頭部中的CHIKV滴度進行定量。因此,在改變微生物組的情況下,用梭狀芽孢桿菌定居的小鼠可以限制哺乳動物宿主中的CHIKV病毒血癥,并防止傳播回蚊媒。通過驗證這些假設,作者證明用單個細菌物種梭狀梭狀芽孢桿菌或其衍生的代謝物,即次級膽汁酸脫氧膽酸重建,可以恢復pDC和MyD88依賴性的I型IFN反應,從而限制全身性CHIKV感染并傳播回媒介蚊子。
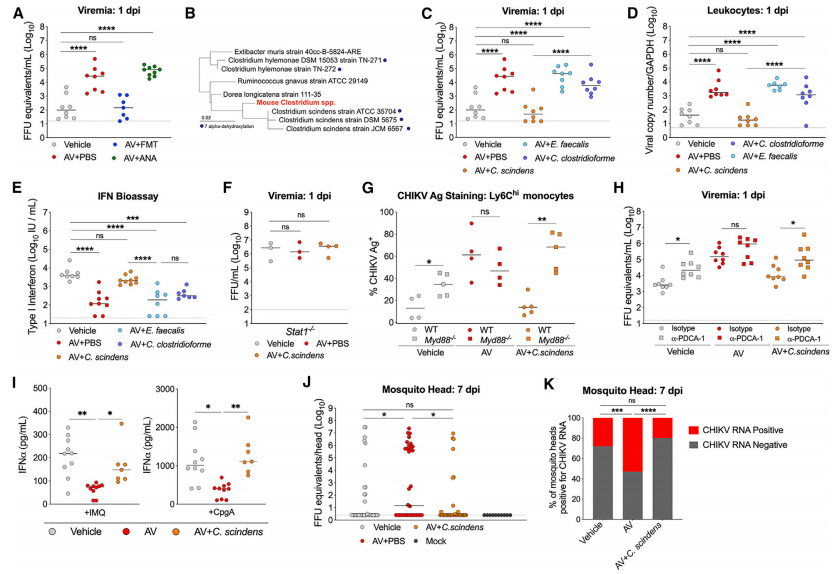
7.微生物衍生和外源性次生BA促進全身性I型IFN反應并限制CHIKV感染
作者假設梭狀芽胞桿菌產生DCA可能會限制AV治療小鼠的全身CHIKV感染。,并對該假設進行驗證,結果顯示,微生物組衍生的繼發性BA在促進MyD88依賴性I型IFN應答中的功能作用,即使在不受干擾的微生物組的情況下,該應答也限制了循環中的CHIKV感染。
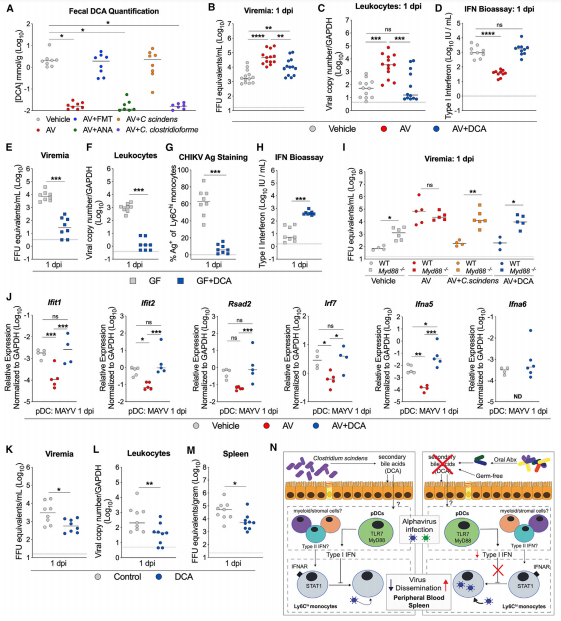
結 論:
總之,作者表明了微生物組調節特定的免疫細胞和信號傳導途徑,以限制循環免疫細胞中α病毒的感染和隨后的傳播。特定細菌及其相關代謝產物可以限制α病毒傳播的發現,可能為人類臨床疾病的變異性提供見識,并為減輕α病毒感染的結果以及可能的途徑提供了途徑,以減輕其傳播給蚊媒和流行病的可能性。






