單細胞RNA測序簡直不要太強悍!分分鐘揭示腫瘤浸潤NK細胞的機制
在癌癥的免疫治療中如何提高免疫細胞的功能仍然是臨床醫學的重要挑戰。缺氧是實體腫瘤的共同特征,細胞通過上調轉錄因子HIF-1α適應缺氧環境。本文通過使用單細胞RNA測序(scRNA-seq)技術揭示了小鼠腫瘤浸潤自然殺傷(NK)細胞的轉錄譜,并于2020年6月16日發表在Immunity(IF:22.553)期刊上。
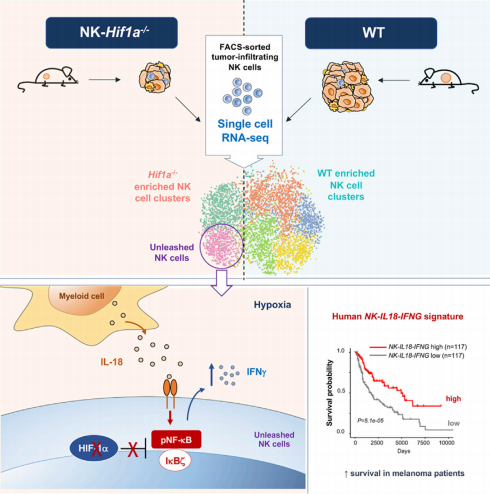
圖解摘要如下:
A. NK細胞缺乏HIF-1α會降低腫瘤的生長;
B. 單細胞RNA測序技術揭示腫瘤中HIF-1α-/-NK細胞被激活;
C. IL-18驅動HIF-1α-/-NK細胞中NK-kB、Ikb和Ifng高表達;
D. NK-IL18-IFNGhi特征與癌癥患者生存率的增加相關。
結果如下:
1、HIF1a缺失的NK細胞展現出抗腫瘤活性和抑制腫瘤生長的潛力
實體腫瘤具有缺氧特征,這可以重塑免疫細胞的功能,為了探究HIF-1α在長時間暴露于缺氧和實體腫瘤組織中調節NK細胞響應中的作用,作者構建了NKp46+細胞HIF-1α缺失的小鼠,并發現HIF-1α敲除不改變NK細胞在不同器官中的數量或成熟分化標志物CD27和CD11b的表達,如脾臟,血液,肺和肝等。
為了進一步探究HIF1a缺失的NK細胞的抗腫瘤活性,作者構建了不同類型的腫瘤模型,然后檢測發現,與野生型小鼠相比,HIF1a缺失的NK細胞小鼠中的腫瘤大小顯著下降,而MHC缺失對照組的腫瘤大小則沒有明顯改變(圖1A)。與此一致的是,HIF1a缺失的NK細胞小鼠的脾臟中NK細胞具有更高的IFN-g和granzyme B的表達,并對腫瘤細胞變現出更強的異常調控(圖1B)。隨后作者注射了肺癌細胞重現了上述研究(圖1C)。為了檢測HIF1a缺失的NK細胞的細胞內在潛能,作者將HIF1a缺陷的NK細胞轉入敲除T、B、NK細胞的Rag2-/-Il2rg-/-小鼠體內,再接種腫瘤細胞。結果發現這導致腫瘤生長顯著下降(圖1D),表明HIF-1α具有細胞內在調控NK細胞抗腫瘤活性的功能。
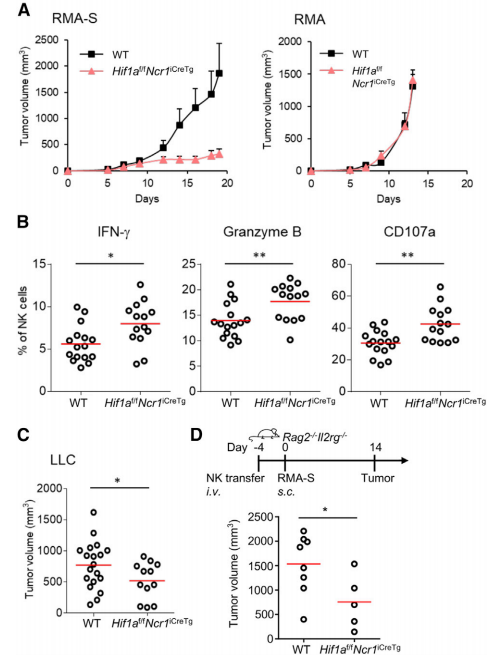
圖1 NK細胞HIF1a缺失導致腫瘤生長減少
2、腫瘤浸潤NK細胞的高通量scRNA-seq發現在Hif1a - / -小鼠中發現一個獨特的NK效應亞群
本文中高通量scRNA-Seq共分析了5721個NK細胞,3075個來自WT小鼠,2646個來自HIF-1α缺失小鼠,并分別從野生型和HIF-1α缺失NK細胞中鑒定到1763和1563個轉錄本。對所有細胞進行無差別聚類,共聚成6類,而野生型和HIF-1α缺失NK細胞明顯具有不同分布(圖2B-C)。值得注意的是,HIF-1α缺失NK細胞約有近60%聚為1和4類種群,而在1和4類種群中大約有90%的細胞是來源于HIF-1α缺失NK細胞(圖2D-E)。與此相反,野生型NK細胞大多分布在2,3,5,6類群中。此外,來自1,2,3類群中的細胞明顯分為Cd11blowCd27high兩種趨勢分布,而來自4,5,6類群中的細胞明顯分為Cd11bhighCd27low兩種趨勢分布(圖2F-G)。其余的幾種基因表達也發現了類似的情況,如f Klrg1, Ncr1 (NKp46), Klrb1c (NK1.1), Itga2 (CD49b, DX5), Klra3 (Ly49C), and Klra9 (Ly49I)。另外,1,2,3類群中的細胞部分轉錄本的表達增加,如PD-1,TIGIT,CTLA4(圖2G)。而趨化因子Ifng和CD69在HIF-1α缺失NK細胞上調(圖2H)。在4類群中,占總細胞總數10%的WT NK細胞也表現出Hif1a的低表達(圖2I)。在WT NK細胞中,Hif1a及其靶基因的低表達與Ifng轉錄升高相關(圖2I),說明Hif1a在調節NK細胞激活和效應功能方面的負作用。

圖2 腫瘤浸潤NK細胞的高通量scRNA-Seq顯示Hif1a - / -簇具有獨特的轉錄特征
隨后,作者分析了上述差異表達基因的通路富集情況,發現HIF-1α缺失NK細胞富集于NF-kB通路,或者涉及到NF-kB激活的其它通路(圖3A)。其中包括轉錄本NFkB1(p50 / p105)(Nfkb1),RelA(p65)(Rela)和其他NF-kB家族成員的轉錄本,例如NF-kB2(p52 / p100)(Nfkb2),c-Rel(Rel) 和RelB(Relb)(圖3B)。此外,還報道了編碼IkBz的NF-kB靶基因Nfkbiz的表達,IkBz是一種據報道在細胞因子刺激后可驅動NK細胞產生IFN-g的核因子(圖3C和2F)。其他NF-kB靶基因,例如Nfkbia,Nr4a1,Ccl3,Ccl4和Icam1,主要在類群4中共表達(圖3C和2F)。重要的是,NF-kB激活的這種富集與Ifng基因的高表達(圖3D)以及NK細胞活化特征相關(圖3E)。為了證實HIF-1α缺失的腫瘤浸潤NK細胞中NF-kB途徑的激活,使用流式細胞儀確定了磷酸化的p65(p-p65),p50和IkBz的表達。結果證實與WT腫瘤浸潤NK細胞相比,HIF1a缺失中NK細胞中p-p65和p50表達增加以及IkBz的誘導增加(圖3F)。
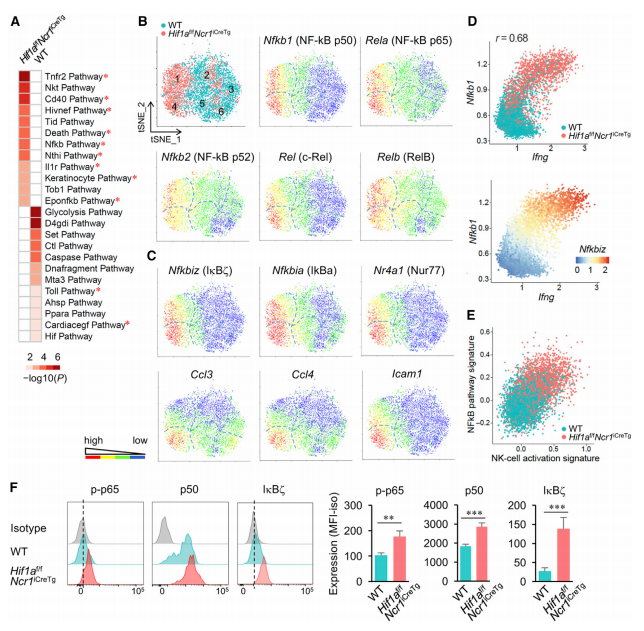
圖3 scRNA-seq識別腫瘤中活化的HIF1a - / - NK細胞亞群
3、HIF1a - / - NK細胞的抗腫瘤活性依賴于骨髓細胞來源的IL-18
為了探索驅動腫瘤浸潤的Hif1a - / - NK細胞中增強NF-kB活性的因素,分析了全腫瘤組織中的細胞因子和趨化因子轉錄譜。 與scRNA-seq數據一致,與WT小鼠相比,Ifng是Hif1af / fNcr1iCreTg小鼠腫瘤組織中表達最高的轉錄物(圖4A)。腫瘤細胞分類分析和腫瘤浸潤免疫細胞顯示II18轉錄主要存在于腫瘤浸潤免疫細胞中,如單核細胞和巨噬細胞,而樹突狀細胞在較低的范圍內表現出II18的高表達(圖4B)。觀察到腫瘤組織中IL-18蛋白含量與基因型無關(圖4C),表明IL-18的可用性在這些腫瘤之間沒有差異。
但是,與WT NK細胞相比,包含IL-18受體(IL-18R)下游信號分子(包括IkBz和其他NF-kB家族成員)的IL-18途徑在Hif1a缺陷NK細胞中含量很高(圖4D)。因此,通過使用mAb注射中和IL-18來研究IL-18在RMA-S腫瘤控制中的作用。在野生型小鼠中,IL-18的中和作用不會改變腫瘤的生長(圖4E)。相反,抗IL-18 mAb的應用消除了Ifng是Hif1af/f Ncr1iCreTg小鼠中腫瘤的延遲生長(圖4E)。一致地,與對照小鼠相比,IL-18中和作用降低了來自Ifng是Hif1af / fNcr1iCreTg的腫瘤浸潤NK細胞中pp65和p50的表達,并消除了IkBz的上調(圖4F)。總之,這些發現表明,缺乏HIF-1a可以增強NK細胞對IL-18的反應能力,這是控制Ifng是Hif1af / fNcr1iCreTg小鼠腫瘤生長所必需的。

圖4 HIF1a -/- NK細胞介導的抗腫瘤活性依賴于髓細胞來源的IL-18
4、小鼠NK中HIF-1a抑制導致效應功能增強和細胞代謝提高
為了進一步證實HIF1a -/- NK細胞中IL-18誘導的效應功能機制,在1%氧氣的缺氧條件下培養脾臟HIF1a -/- NK細胞和WT NK細胞。結果發現,與WT相比,IL-12和IL-18刺激后,缺氧暴露的HIF1a -/- NK細胞中IFN-γ的產量更高(圖5B)。使用藥理抑制劑TPCA-1抑制NF-kB激活能完全阻斷IFN-γ的產生(圖5C),而不影響細胞活力和下游IL-18R的產量。這些表明NF-kB通路參與IL-18暴露中NK細胞的多種效應功能調控。
據報道HIF-1α調節免疫細胞分化和效應功能而參與細胞代謝。與代謝激活的WT相比,HIF-1α缺失NK細胞暴露于延遲缺氧7天,氧氣消耗速率(OCR)沒有顯著差異,而暗示糖酵解的細胞外的酸化速率(ECAR)在后者中顯著下降(圖5D)。經IL-12和IL-18刺激后,ECAR升高至相似值,而OCR值在HIF-1α-/-NK細胞中較高。OCR升高,因此OCR/ECAR比例升高,與HIF-1α-/-NK細胞的IFN-γ產量提高有關(圖5E)。因此,缺氧暴露的HIF-1α-/-NK細胞產生IFN-γ的能力增強與NF-kB途徑的激活和代謝改變有關。
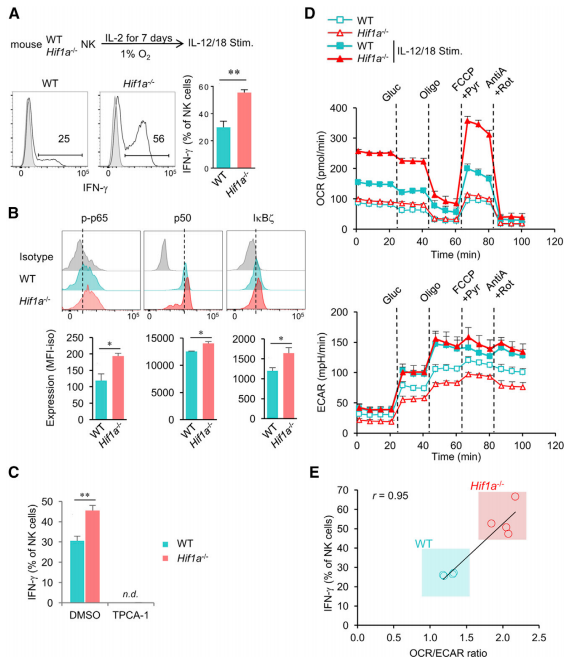
圖5 HIF1a缺失的NK細胞經刺激后IFN-γ的產生增強與NF-kB通路激活和耗氧率增加有關
5、HIF-1α抑制導致激活的人NK細胞效應響應增強
為了研究抑制HIF-1α是否能以類似的方式增強人NK細胞的效應功能,用小分子化合物KC7F2,據報道可以抑制HIF-1α蛋白的穩定性和其靶基因轉錄,處理純化的人外周血NK細胞。結果顯示,人NK細胞使用KC7F2處理后在IL-2存在的情況下,顯著增強了細胞脫粒作用以及IFN-γ和TNF-α的產生(圖6A)。這些發現強調了HIF-1α抑制劑誘導高功能性人NK細胞的潛力。為了探究HIF-1α是否能夠影響人NK細胞抗腫瘤響應,分析了NK細胞浸潤非小細胞肺癌的轉錄表達譜。作者發現腫瘤浸潤NK細胞表現出HIF1A高表達。這與其靶基因上調和IFNG下調的相關(圖6B)。與腫瘤周圍部位相比,NK-IL18-IFNG信號降低,進一步支持了NK細胞效應功能在腫瘤中的負調控,這與單個NK細胞中HIF1A的表達呈負相關(圖6C)。這些結果表明人腫瘤浸潤NK細胞的癌癥病人中HIF1A表達與他們的抗腫瘤潛力呈負相關。
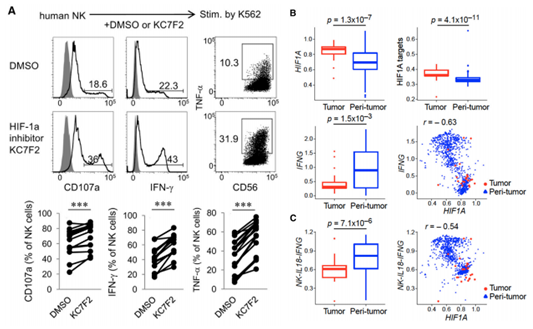
圖6 HIF-1a在人NK細胞中的激活與抗腫瘤活性的降低相關
6、一個NK-IL18-IFNG信號預測改善不同癌癥病人總體生存率
本文中,腫瘤微環境中IL-18的存在導致NK細胞反應增強,這由NF-kB激活和Ifng表達表明,而沒有HIF-1a,則導致腫瘤生長減少。因此,單個人腫瘤浸潤NK細胞中的NK-IL18-IFNG信號與HIF1A表達負相關。因此,分析了人類腫瘤樣品中的整體NK-IL18-IFNG信號是否可預測癌癥患者存活率的提高。對來自TCGA數據集的皮膚黑色素瘤(SKCM)的469位患者樣品的分析顯示,SKCM腫瘤中IL18和IFNG基因表達呈正相關(圖7A)。此外,NK細胞相關基因(NCR1,NCR3,KLRB1,CD160和PRF1)的表達與IL18-IFNG基因表達呈正相關(圖7B)。重要的是,與SKCM患者中的NK-IL18-IFNGlow信號相比,NK-IL18-IFNGhigh信號的SKCM患者與更好的總體存活率相關(圖7C)。在乳腺癌(BRCA,n = 1,093)和宮頸癌(CESC,n = 304)患者中發現了相似的相關性(圖7D-7I)。這些數據表明NK-IL18-IFNG標記在不同癌癥實體中可能的預后作用。

圖7 在不同的腫瘤中,NK-IL18-IFNG的特征與提高患者的總體生存率相關
總之,本文的結果提高了對HIF-1a介導的控制NK細胞效應功能在其微環境中的機制理解。本文的數據表明,IL-18供應與NK特異性HIF-1a靶向的組合方法有望改善NK細胞敏感性實體瘤的治療策略。
參考文獻:
Ni Jing., Wang Xi., Stojanovic Ana., Zhang Qin., Wincher Marian., Bühler Lea., Arnold Annette., Correia Margareta P., Winkler Manuel., Koch Philipp-Sebastian., Sexl Veronika., H?fer Thomas., Cerwenka Adelheid.(2020). Single-Cell RNA Sequencing of Tumor-Infiltrating NK Cells Reveals that Inhibition of Transcription Factor HIF-1α Unleashes NK Cell Activity. Immunity, 52(6), 1075-1087.e8. doi:10.1016/j.immuni.2020.05.001






