微生物群通過腸-腦回路操控交感神經元?
腸道和大腦之間的連接監視腸道組織及其微生物和飲食含量,調節生理腸道功能,例如營養吸收和運動性,以及通過腦線喂養的行為。因此,有可能存在檢測腸道微生物并將其傳遞到中樞神經系統區域的電路,這些區域進而調節腸道生理。

美國紐約Rockefeller 大學聯合日本Rockefeller 大學,于2020年7月8日發表于Nature的一篇文章“Microbiota modulate sympathetic neurons via a gut–brain circuit.” 該研究通過結合生物組學小鼠模型與轉錄組學,電路追蹤方法和功能操作,來表征微生物群對腸道相關神經元的影響。作者發現腸道微生物組可調節腸道外源性交感神經元:微生物群耗竭可導致神經元轉錄因子cFos的表達增加,而無菌細菌定殖于產生短鏈脂肪酸的細菌會抑制腸道交感神經節中cFos的表達。化學遺傳學的操作,翻譯輪廓和順行性跟蹤確定遠端腸投射迷走神經元的子集,其定位在微生物群介導的腸道交感神經元的調節中具有不同的作用。腸道壁逆行的多突觸神經元示蹤顯示了在微生物耗竭過程中激活的腦干感覺神經核,以及調節胃腸道轉運的各種交感神經運動前谷氨酸能神經元。這些結果揭示了通過腸道-大腦回路對腸道外源性交感激活的微生物群依賴性控制。
結 果:
外源性腸相關神經元(eEAN)包含感覺傳入和自主神經傳入,可同時感測腸道的多個區域,并將信息傳輸到其他組織,且補充內在EAN(iEAN)來控制腸道功能。為了確定eEAN細胞體的位置,作者將熒光逆行示蹤劑,霍亂毒素β亞基(CTB)注入了不同腸段的壁中,并解剖了伸向腸道的外在神經節,特別是感覺結節神經節和背側神經節。結果顯示,不同的腸道區域的感覺和交感神經支配是由不重疊的周圍神經元細胞群體介導的。轉錄核糖體的CTB示蹤對結節神經節的GO分析表明,無菌小鼠中與突觸信號傳導和神經元激活相關的基因豐富。免疫熒光分析證實,從無菌小鼠中分離出的CG-SMG與SPF對應物相比,顯示出更多的cFos +神經核。這些數據表明,缺乏微生物群會導致腸道外源性交感神經活動水平升高。
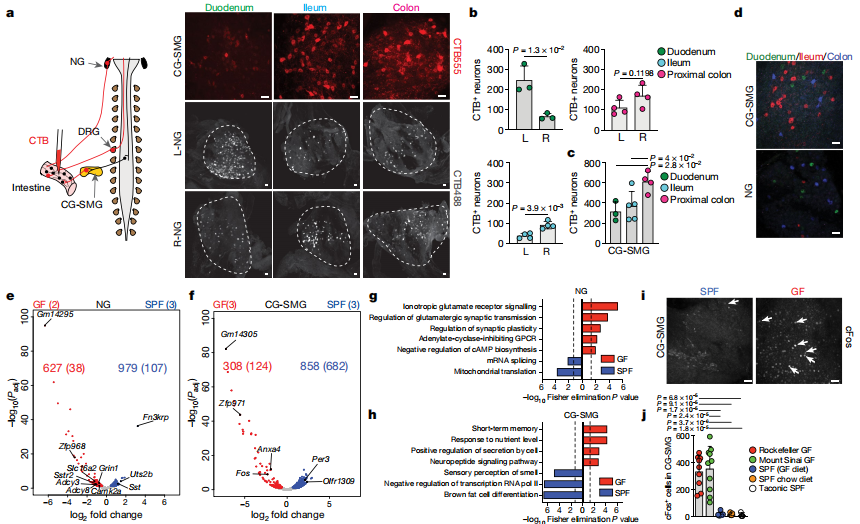
為了解決特定的微生物是否可以介導CG-SMG神經元的強直抑制,作者將糞便從SPF供體轉移到無菌小鼠中,可使CG-SMG神經元cFos恢復到與SPF條件相當的水平,這表明微生物群可以抑制腸道外源性交感神經元。用單獨的抗生素治療足以促進交感性cFos表達,表明了細菌的特定亞群能夠抑制cFos激活。此外,一次鏈霉素的口服灌胃會導致灌胃后12小時和24小時CG-SMG神經元活化,治療后5天恢復到基礎水平。通過將熒光CTB注射到經廣譜抗生素治療的FosGFP小鼠回腸CG-SMG中觀察到CTB +和cFos +神經元之間的廣泛共定位,增強了微生物耗竭后激活的交感神經元投射到腸道的可能性。最后,作者發現對微生物耗盡的小鼠中兒茶酚胺釋放的阻滯可以挽救其胃腸道蠕動的變化,這表明交感神經活動的增強部分歸因于這些小鼠的運動能力下降。這些結果表明,特定的微生物可以抑制腸道交感神經元中cFos的表達,并且腸道特定的交感活性可以反映腸道微生物群落的變化。作者還觀察到,當定義微生物群落時,無菌的操作導致CG-SMG神經元抑制。
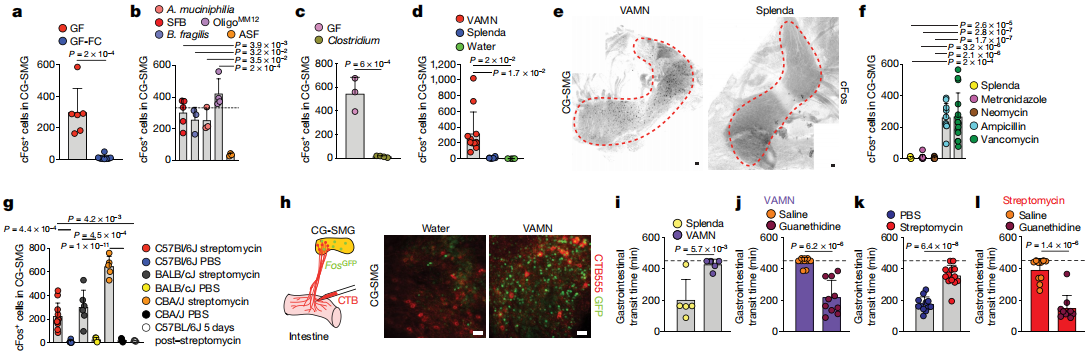
SCFAs抑制交感性cFos的能力最有可能是由周圍的過程介導的。SCFAs可以通過激活G蛋白偶聯受體抑制組蛋白脫乙酰基酶或通過調節蛋白來調節靶細胞。總體而言,以上結果確定了SCFA和其他腸道相關代謝產物或體液因子是腸道交感神經元活化的生理調節劑。從不同腸段進行的雙重PRV示蹤表明,每個這些腦干區域中的大多數神經元都連接到腸的多個段。這些實驗定義了一組常見的傳出的運動前腦干神經元,這些神經元多突觸連接到腸道的不同區域并可以控制腸的交感神經活動。結果表明,谷氨酸能LPGi / RVLM腦干神經元可以驅動腸道交感神經活動,從而減慢胃腸道的運輸。
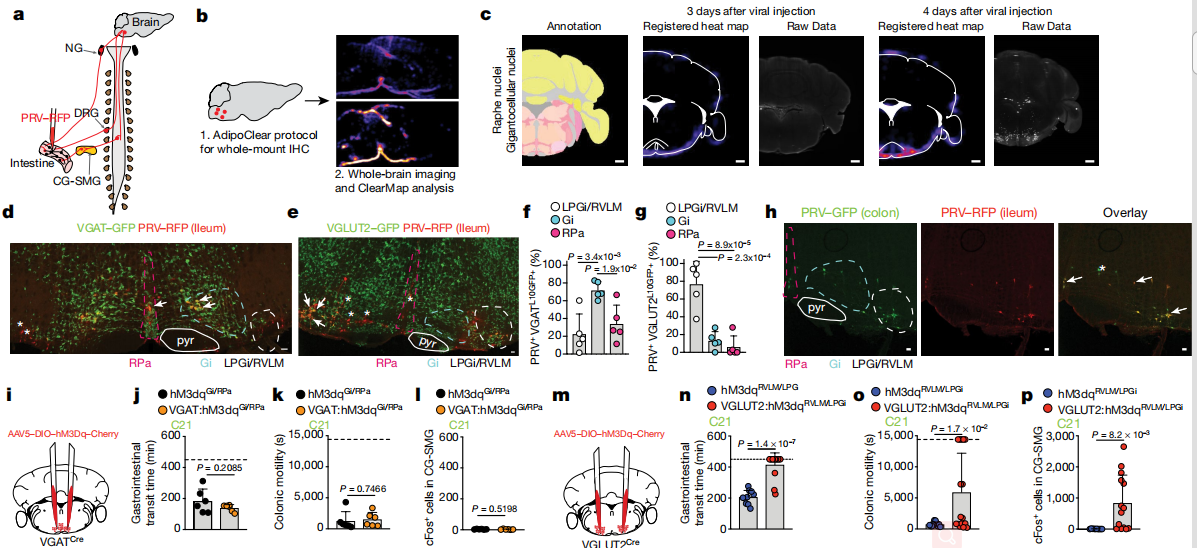
在鏈霉素治療后,作者觀察到NTS和術后區域的cFos表達總體增加。腦干感覺細胞核經過調整以檢測腸道微生物群或其代謝產物的變化。微生物耗竭后,NTS /視網膜后區域中cFos表達的增加表明傳入感覺神經元在調節腸道交感神經活動中具有功能性作用。腸道上皮,粘膜和肌層的外在神經元感測主要由結節神經節和DRG25中的感覺傳入來執行。
為了確定是單獨抑制結節神經節還是抑制結節神經節和DRG都是造成這種表型的原因,作者首先使用了腸道投射TRPV1+傳入神經元的化學和遺傳消融方法。作者發現這種治療方法并不能阻止CG-SMG中抗生素誘導的cFos表達,也不能在未治療的SPF小鼠中誘導cFos表達,這表明在微生物耗竭過程中,DRG感覺神經元在激活的回路中沒有主要作用。最后,對特定迷走神經傳入的調節足以驅動腸道交感神經活動。
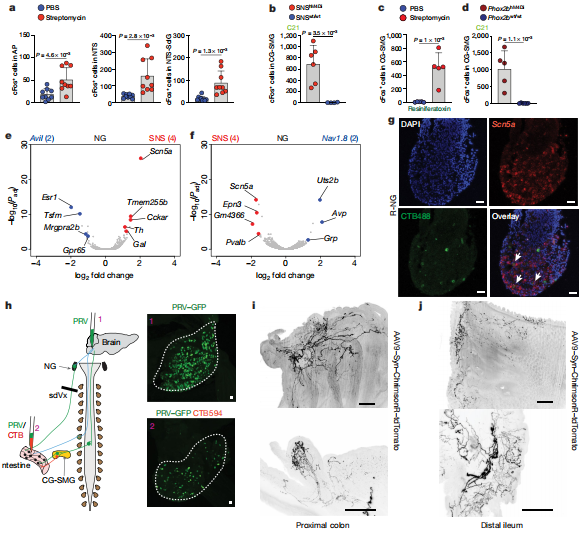
此處進行的功能,回路和基因表達研究表明,直接或間接通過上皮細胞對微生物或其代謝產物進行EAN檢測是一種核心感覺系統,微生物組成的改變足以充分激活腸道投射神經元。額外的CG-SMG諸如脾臟,胰臟和肝臟之類的靶標也可能受到微生物群的調節,可能對全身免疫和代謝產生影響。
結 論:
作者確定了許多潛在的微生物群來源的信號,可以調節腸道交感神經活動和神經元人口與腸突觸連接。進一步了解自主神經系統的微生物調節以及整合微生物信號的其他回路的特性,可能是了解腸道運動,內臟疼痛,腸內免疫和免疫調節的關鍵。與腸腦軸有關的系統性疾病,是定義治療策略必不可少的知識。






