腫瘤內腸道菌群的積累促進了基于CD47的免疫治療
越來越多的證據表明,調節腸道微生物群會影響宿主對各種癌癥治療的反應,尤其是免疫治療。目前,CD47正作為一種潛在的癌癥治療靶點在多項臨床試驗中進行研究。今天小編為大家介紹一篇發表于“Journal of Experimental Medicine”的文章“Intratumoral accumulation of gut microbiota facilitates CD47-based immunotherapy via STING signaling”。這篇文章揭示了腸道菌群優先在腫瘤部位定植并通過STING信號通路促進基于CD47的免疫治療。

結果:
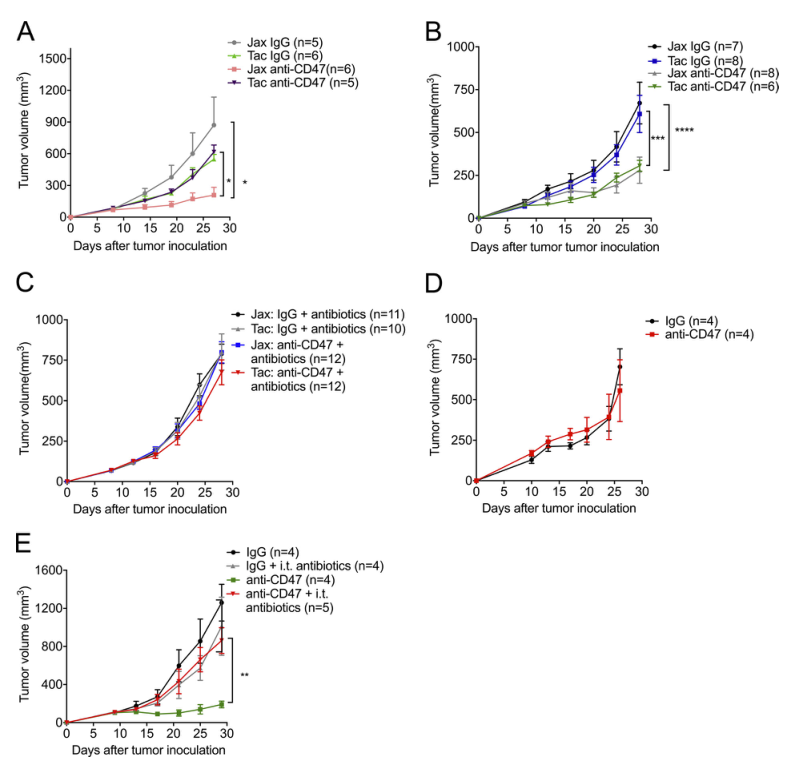
1)CD47阻斷的抗腫瘤反應依賴于胃腸道外積累的腸道微生物群
為了研究CD47抗體的抗腫瘤作用是否由小鼠體內的腸道菌群決定,我們使用WT小鼠、抗生素喂養的小鼠和無菌小鼠來檢測CD47免疫治療的抗腫瘤作用。據報道,來自Jackson實驗室(Jax)和Taconic Biosciences(Tac)的WT小鼠有一種獨特的腸道微生物群,有助于它們的獨特免疫特征。我們觀察到荷瘤Jax小鼠對CD47阻斷有反應,而荷瘤Tac小鼠無反應(圖1A)。為了探討抗CD47免疫治療的反應是否歸因于它們的腸道微生物群,我們將Jax小鼠和Tac小鼠同居3周;WT-Jax小鼠和Tac小鼠在同居后對CD47阻斷反應類似(圖1b)。這一結果表明,小鼠應答者(Jax小鼠)的共生菌經口轉移或接觸傳播,可以充分挽救CD47阻斷的非應答者(Tac小鼠)的抗腫瘤反應。為了證實腸道菌群在基于CD47的免疫治療中的重要作用,我們在接種腫瘤之前給Jax和Tac小鼠喂服抗生素混合物以減少腸道菌群。喂食抗生素混合物的Jax小鼠對抗CD47治療無效(圖1C)。為了進一步確認腸道微生物群對反應至關重要,還使用了無菌小鼠(圖1D)。無菌小鼠對抗CD47抗體治療無效。抗生素喂養介導全身微生物群的系統性減少。此外,瘤內注射抗生素混合物降低了小鼠應答者抗CD47治療的療效(圖1E)。這些發現表明,聚集在胃腸道外的共生腸道微生物在促進基于CD47的免疫治療中的有效作用。
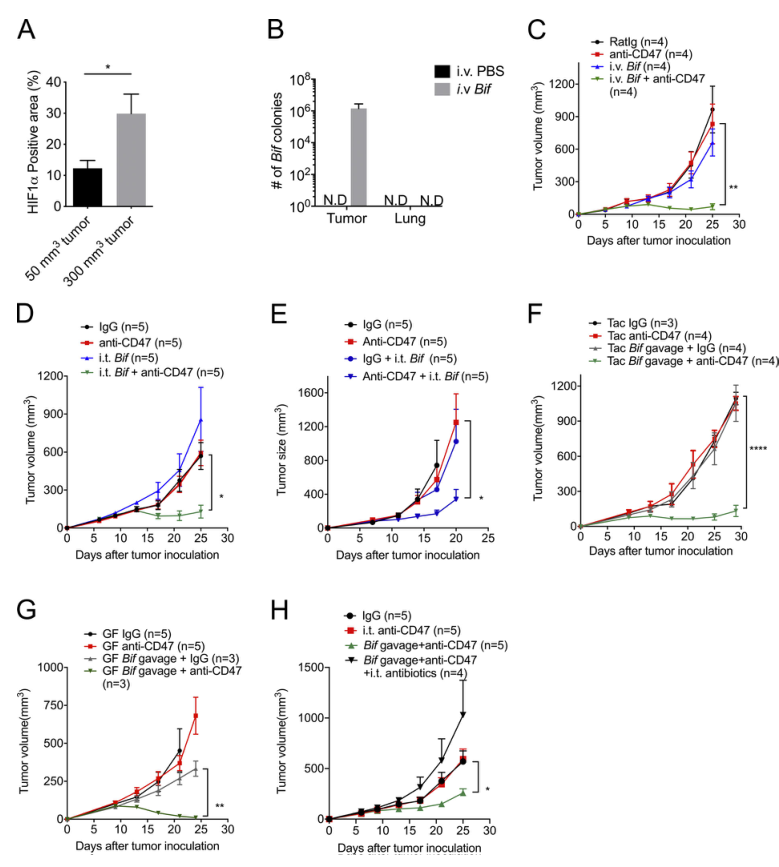
2)雙歧桿菌,一種腫瘤靶向的微生物群成員,可充分恢復無應答者抗CD47免疫治療的抗腫瘤療效
厭氧菌主要存在于胃腸道。隨著腫瘤大小的增加,TME變得更缺氧(圖2A)。雙歧桿菌是一種功能性腸道微生物群,通過改善DCs的功能促進基于PDL1的免疫治療。但雙歧桿菌如何以及在何處增強免疫力還沒有很好的定義。為了追蹤共生厭氧菌(如雙歧桿菌)如何與免疫細胞相互作用,我們給Tac小鼠注射了雙歧桿菌混合物(雙歧桿菌、長雙歧桿菌、乳雙歧桿菌和短雙歧桿菌)。令人驚訝的是,在全身給藥7d后,通過使用厭氧培養板選擇性培養雙歧桿菌和16S rDNA鑒定,可在腫瘤組織中容易檢測到雙歧桿菌(圖2B)。然而,在肺中沒有檢測到雙歧桿菌。盡管單用雙歧桿菌的全身給藥不能控制腫瘤生長,但它挽救了對CD47阻斷無效的小鼠的抗腫瘤效果(圖2C)。提示雙歧桿菌的腫瘤靶向性是腸道微生物群影響抗腫瘤反應的可能機制之一。
為了進一步探討雙歧桿菌在全身給藥后對腫瘤的抗腫瘤作用,我們也采用了雙歧桿菌的瘤內注射給藥的方法。使用低劑量的雙歧桿菌也可以通過CD47阻斷小鼠結腸腫瘤或淋巴瘤腫瘤的無應答者來恢復腫瘤控制的能力,這與系統處理雙歧桿菌的結果一致(圖2D- E)。這些結果表明,雙歧桿菌在TME中的積累能充分提高抗CD47免疫治療的抗腫瘤作用。
最近,口服共生細菌作為一種抗腫瘤策略備受關注。研究表明,口服更高劑量的雙歧桿菌恢復了基于CD47的免疫療法對無應答小鼠(Tac小鼠)和無菌小鼠(圖2、F和G)的抗腫瘤作用。然而,口服熱滅活細菌并沒有顯示出挽救效果。這一結果顯示口服活雙歧桿菌而非滅活雙歧桿菌足以促進CD47阻斷的治療效果。此外,在雙歧桿菌灌胃的小鼠中,低劑量抗生素混合物的瘤內注射給藥足以消除CD47阻斷的作用(圖2 H)。
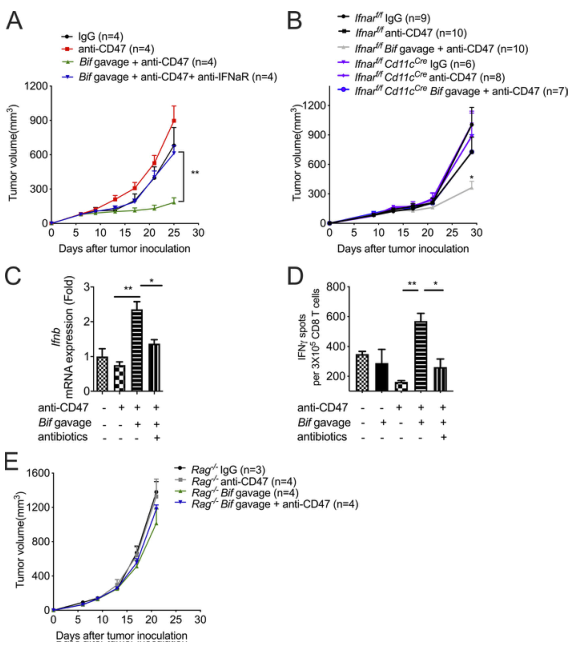
3)I型IFN信號和T細胞是雙歧桿菌介導的腫瘤控制的關鍵
據報道,CD47阻斷的抗腫瘤作用依賴于I型IFN信號和腫瘤相關樹突狀細胞的交叉啟動。研究發現,即使是雙歧桿菌給藥,I型IFN信號阻斷也會導致對CD47阻斷的耐藥性(圖3A)。為了確定TME中哪些細胞群需要I型IFN信號才能在雙歧桿菌給藥和CD47阻斷后產生有效的抗腫瘤反應,我們使用了在DCs中Ifnar被敲除的小鼠。口服雙歧桿菌不能促進Ifnarf/fCd11cCre小鼠中CD47的阻斷(圖3 B)。這一發現表明,DCs中的I型IFN信號通路對雙歧桿菌促進的CD47阻斷的治療效果至關重要。為探討雙歧桿菌對DCs中I型IFN信號轉導的影響,對分離的腫瘤DCs中IFNβ的表達進行了檢測。雙歧桿菌和抗CD47治療無效小鼠的腫瘤樹突狀細胞中IFNβ的表達升高(圖3C)。骨髓來源的樹突狀細胞與MC38腫瘤細胞和雙歧桿菌共培養也得到了類似的結果。另一方面,口服雙歧桿菌后用抗生素混合物消除雙歧桿菌,可降低腫瘤樹突狀細胞中IFNβ的表達(圖3C)。綜上所述,這些發現證明了I型干擾素信號在通過CD47阻斷的雙歧桿菌局部促進腫瘤控制中的重要作用。
據報道,I型IFN信號轉導可促進樹突狀細胞的交叉啟動,從而刺激適應性免疫反應。ELISPOT法檢測腫瘤DCs的交叉啟動能力。只有接受了雙歧桿菌和抗CD47抗體的瘤內注射的Tac小鼠的腫瘤樹突狀細胞才能誘導CD8+T細胞中IFNγ的增加(圖3D)。用抗生素混合物消除雙歧桿菌降低了腫瘤樹突狀細胞的交叉啟動能力。此外,雙歧桿菌給藥無法恢復CD47阻斷對Rag-/-小鼠的抗腫瘤作用(圖3E)。雙歧桿菌以IFNβ依賴和T細胞依賴的方式共同促進了基于CD47的免疫治療。
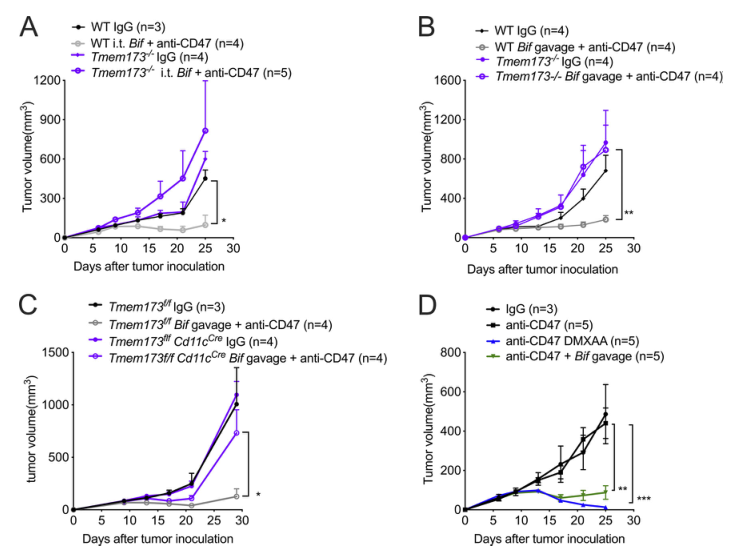
4)雙歧桿菌通過STING信號促進CD47免疫治療
STING途徑在抗D47介導的抗腫瘤作用中調節I型IFN的表達。然而,STING途徑與雙歧桿菌的抗腫瘤作用之間的直接關系尚未明確。我們觀察到,注射雙歧桿菌未能促進Tmem173–/–小鼠的抗CD47免疫治療,在該治療中,小鼠的STING被擊倒(圖4A)。因此,STING信號通路對雙歧桿菌的抗腫瘤作用至關重要。當Tmem173–/–小鼠口服雙歧桿菌時也得到了類似的結果(圖4B)。口服雙歧桿菌也未能促進Tmem173f/fCd11Cre小鼠的抗CD47免疫治療,證實雙歧桿菌的抗腫瘤功能依賴于DCs內的STING信號通路(圖4C)。本研究提示以腫瘤組織為靶點的STING激動劑可能有效。事實上,與雙歧桿菌相比,注射DMXAA(一種小鼠刺激性激動劑)同樣提高了WT-TAC小鼠抗CD47治療的抗腫瘤效果(圖4D)。
結論:
本研究為臨床研究腫瘤微環境內的微生物與免疫治療的協同作用開辟了一條新的途徑,揭示了一些患者對免疫治療無反應的情況。






