小膠質外泌體與帕金森氏病
帕金森氏病的病理特征包括黑質中多巴胺能神經元的丟失和突觸核蛋白(a-syn)的積累。小膠質細胞是大腦中的主要免疫細胞,在帕金森氏癥中吞噬死細胞并幫助清除錯誤折疊的a-syn聚集體。分泌外泌體是小膠質細胞抗原呈遞和釋放機制的一部分。小膠質外泌體是否影響帕金森氏病,這篇文章來為大家解答。

技術路線:

結果:
1. 外泌體介導神經元之間的a-syn的傳播
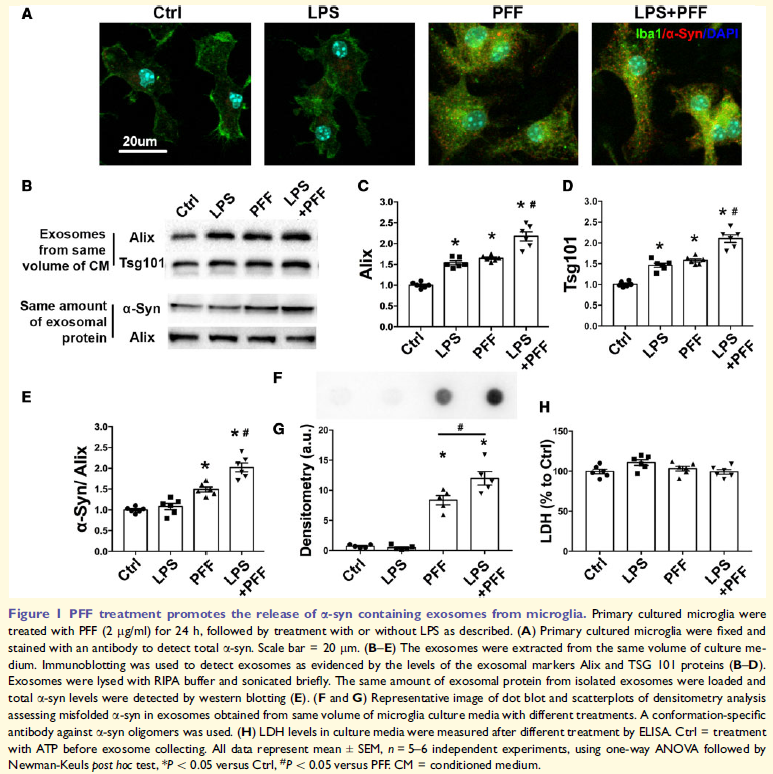
PFF或PFF/LPS組合處理的小膠質細胞中檢測到a-syn,表明小膠質細胞可以攝取PFF,但缺乏有效降解纖維性a-syn的能力。LPS、PFF、LPS/PFF處理的小膠質細胞增加了外泌體的釋放,PFF增加外泌體中的a-syn水平,PFF和LPS共處理增加最多,表明外泌體可能在消除細胞內異常a-syn中發(fā)揮重要作用。PFF處理小膠質細胞衍生的外泌體中可檢測到具有神經毒性的寡聚a-syn的存在。這些表明PFF處理的小膠質細胞釋放包含a-syn的外泌體,LPS進一步增強PPF的效應。
2. 外泌體介導a-syn在小膠質細胞和神經元之間的傳遞
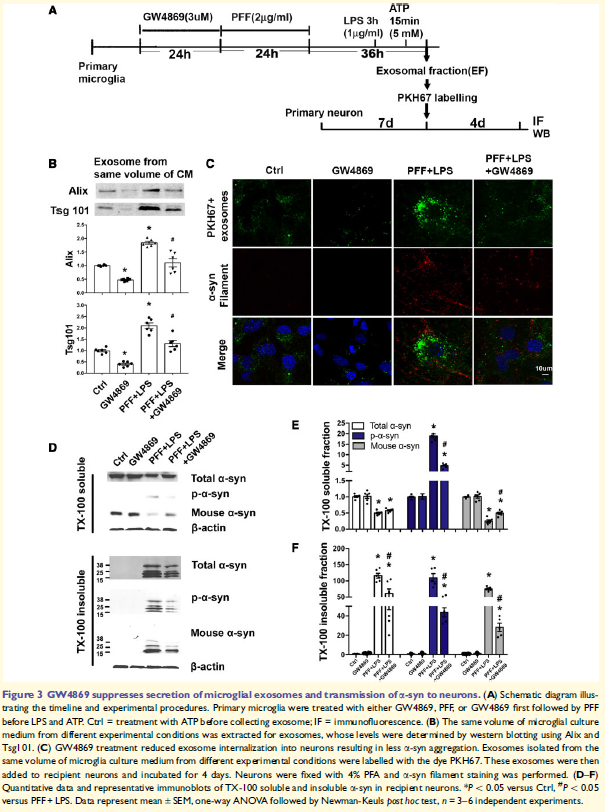
外泌體EF(來自PFF處理的小膠質細胞),和EF-c(未治療的小膠質細胞的外泌體)或無外泌體條件培養(yǎng)基分別與皮層神經元孵育4天。TX-100不溶性a-syn在受體神經元中的聚集在EF組顯著增加,而可溶性內源性a-syn減少,表明包含a-syn的外泌體招募內源性a-syn形成不溶性。


3. 外泌體合成的抑制減少a-syn從小膠質細胞到神經元的傳遞
外泌體抑制劑GW4869處理小膠質細胞發(fā)現(xiàn)外泌體的分泌減少,外泌體進入神經元明顯減少,a-syn聚集減少,減少TX-100不溶性a-syn,提示降低小膠質細胞釋放含a-syn的外泌體可減少a-syn擴散到神經元。
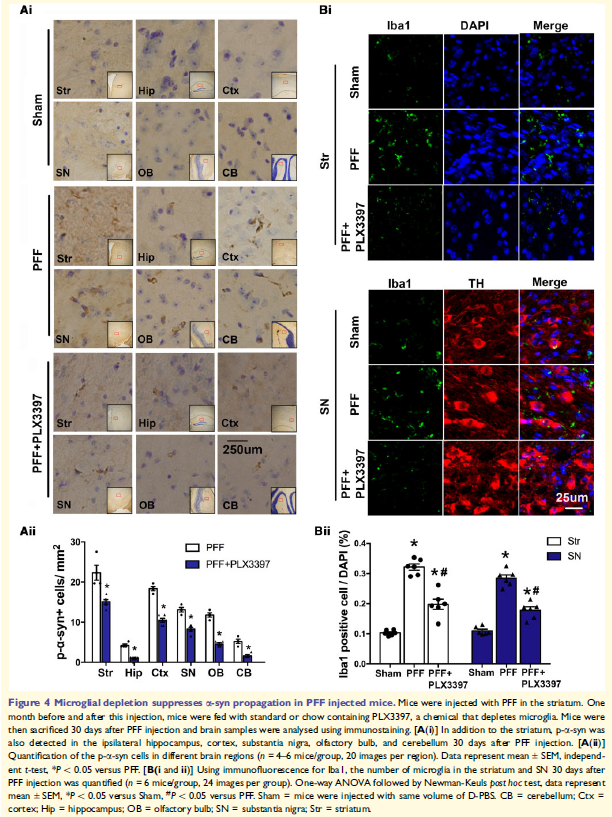
4. 小膠質細胞耗竭抑制PFF誘導的a-syn在體內傳播
小鼠背側紋狀體立體定向注射PFF 30天后,p-a-syn積累存在于大腦多個區(qū)域,SN和紋狀體中的Iba1陽性小膠質細胞增加,表明小膠質細胞參與了a-syn的傳播。消耗小膠質細胞藥物PLX3397喂食老鼠處理大大減少大腦中Iba1陽性小膠質細胞的數(shù)量。PFF + plx3397處理的小鼠SN和紋狀體中iba1陽性的小膠質細胞減少,異常p-a-syn聚集明顯減少,僅PLX3397處理沒有影響。這些表明小膠質細胞耗竭抑制a-syn聚合和傳輸。
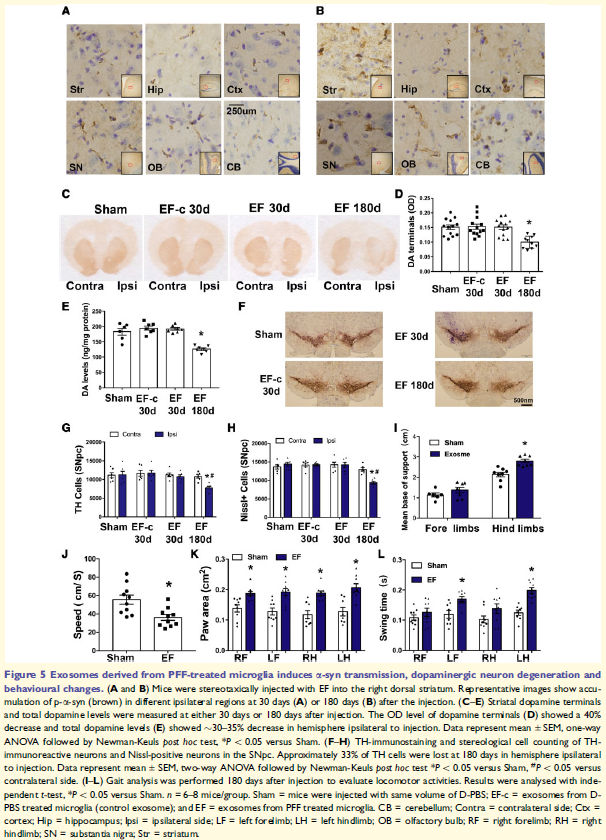
5. 小膠質外泌體介導a-syn在大腦中傳播
注射EF的小鼠大腦可檢測到p-a-syn的積累,多巴胺能終密度減少,紋狀體多巴胺總含量減少,同側SNpc中TH陽性細胞相應丟失,這些表明小膠質外泌體在黑質紋狀體通路中以一種依賴于時間的方式觸發(fā)逆行細胞死亡。
檢測到小鼠的行為變化,發(fā)現(xiàn)后肢的支撐基礎增加,平均步行速度減少,兩只腳的爪面積增加。以上這些變化表明步行速度減少,總體活動沒有明顯改變。這些表明小膠質細胞外泌體a-syn與帕金森病的進展有關。
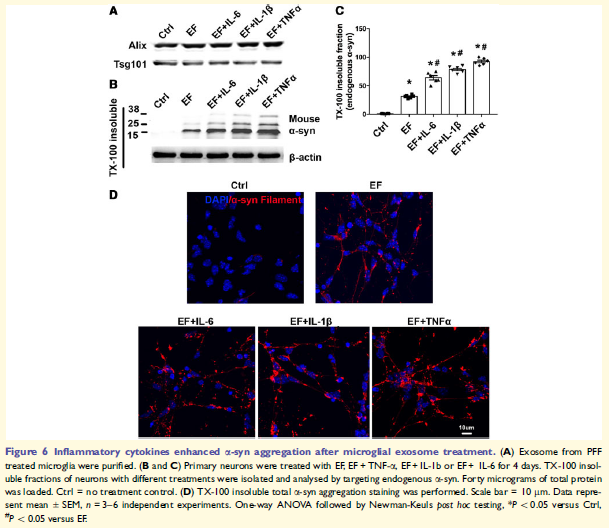
6. 促炎細胞因子增強小膠質外泌體誘導的a-syn的聚集
小膠質細胞活化同時釋放促炎因子,EF與促炎細胞因子共處理神經元細胞增加TX-100不溶性內源性a-syn,表明EF介導a-syn傳輸,小膠質細胞炎癥反應加速這一過程。
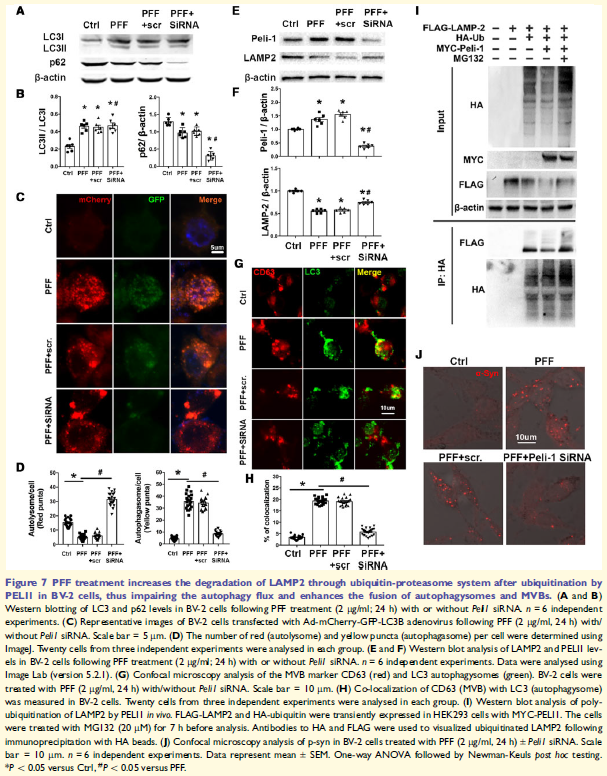
7. PELI1介導的溶酶體故障導致小膠質細胞自噬通量失調和外泌體分泌
自噬是a-syn降解的重要途徑,觀察到PFF處理的BV-2細胞誘導自噬體積累。研究發(fā)現(xiàn),在PF F處理的BV-2細胞中溶酶體結構蛋白LAMP2的水平明顯減少,CD63 + LC3 +濃度增加,這些表明PFF引起溶酶體功能障礙。PFF處理BV-2細胞E3泛素連接酶PELI1水平增加,在HA泛素存在下,LAMP2被有效多泛素化,而PELI1過表達增強LAMP2的降解。沉默PELI1逆轉PFF誘導的LAMP2減少,減弱自噬體積累,恢復自噬通量,并減少自噬體與MVB的融合。
8. 帕金森氏癥患者CSF小膠質細胞/巨噬細胞來源外泌體誘導神經元a-syn聚集
CSF中CD11b +外泌體超過總外泌體,帕金森氏病和MSA患者中小膠質細胞/巨噬細胞外泌體中總a-syn的含量。CD11b +外泌體與皮質神經元一起孵育,觀察到帕金森氏病和MSA患者的CD11b +外泌體誘導TX-100不溶性a-syn。這些表明小膠質細胞/巨噬細胞衍生的外泌體含有a-syn,在細胞間傳播中起重要作用。







