外泌體與糖尿病傷口愈合
目前,開發改善糖尿病個體傷口愈合的治療策略仍然具有挑戰性。外泌體代表了一種有前途的納米材料,可以從中分離出microRNA(miRNA)。這些miRNA具有發揮治療作用的潛力,因此,確定外泌體中循環的特定miRNA的潛在治療作用非常重要。在這里,小編與大家分享一篇近期發表于Small上的文章“Circulating Exosomal miR-20b-5p Inhibition Restores Wnt9b Signaling and Reverses Diabetes-Associated Impaired Wound Healing”。在本研究中,我們從2型糖尿病患者或健康對照組中分離出外泌體,并評估了其在糖尿病傷口愈合中的作用。

結果:
1.來自患有或不患有2型糖尿病的志愿者的外泌體特征
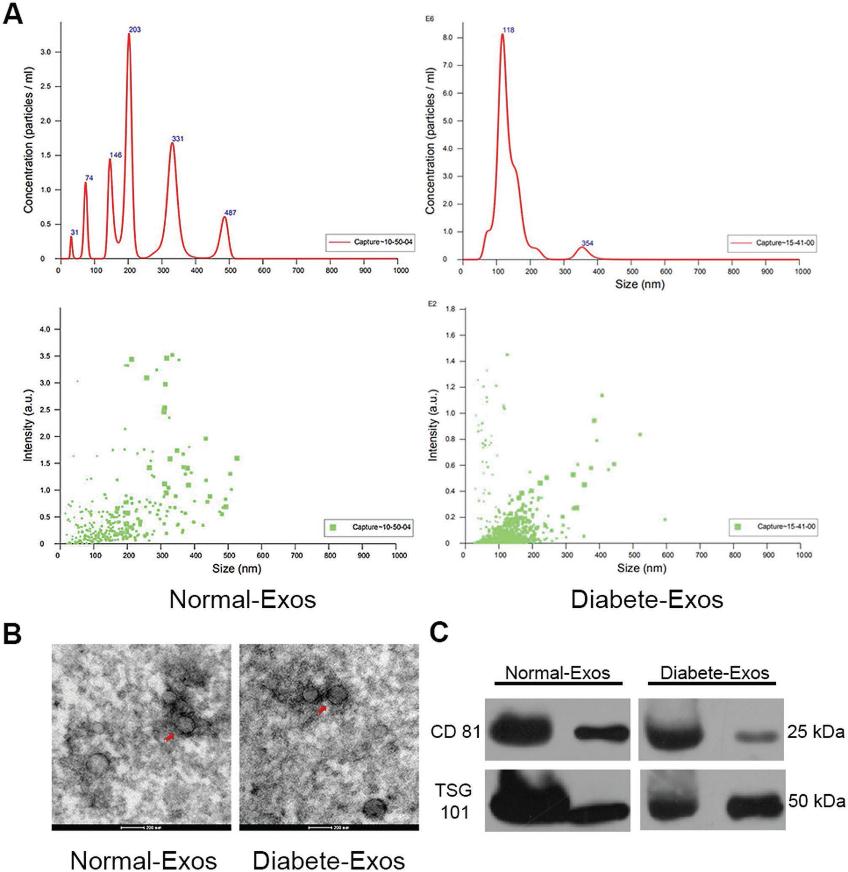
我們首先通過透射電子顯微鏡(TEM),動態光散射(DLS)和WB評估從志愿者患者血漿中分離的外泌體。DLS揭示了外泌體大小在30到200 nm之間,與先前有關外泌體大小的報道一致(圖1A)。透射電鏡顯示這些顆粒具有杯狀或球形的形態(圖1B)。[12] WB進一步證實,這些顆粒包含外泌體表面標記,例如CD81和TSG101(圖1C)。 這些結果一起證實了分離的循環納米顆粒是外泌體。
2.來自2型糖尿病患者的外泌體阻礙小鼠創面愈合
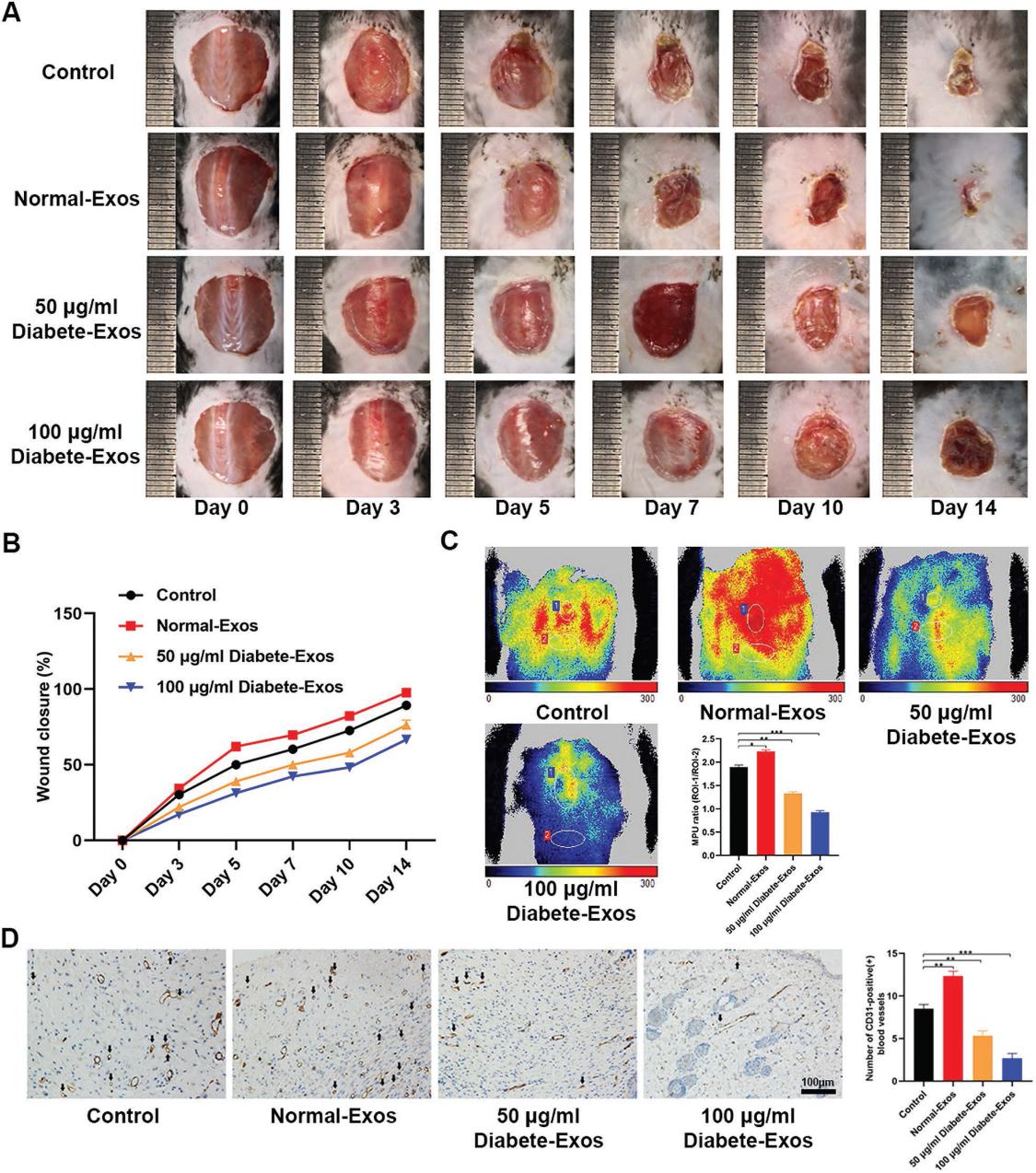
我們探索了來自2型糖尿病患者的外泌體對傷口愈合能力的影響。我們觀察到注射糖尿病患者的外泌體時傷口閉合速率明顯降低(圖2A,B),與非糖尿病外泌體對照相比,治療后10天傷口部位的平均灌注單位(MPUs)比率更低(圖2C) 。 此外,我們量化了傷口部位的CD31表達,進一步證實了糖尿病患者的外泌體能夠抑制局部血管生成(圖2D)。 這些發現共同表明,糖尿病患者的外泌體能夠延遲體內傷口愈合。
3.來自2型糖尿病患者的外泌體抑制人臍靜脈內皮細胞(HUVEC)增殖和血管形成并促進細胞凋亡
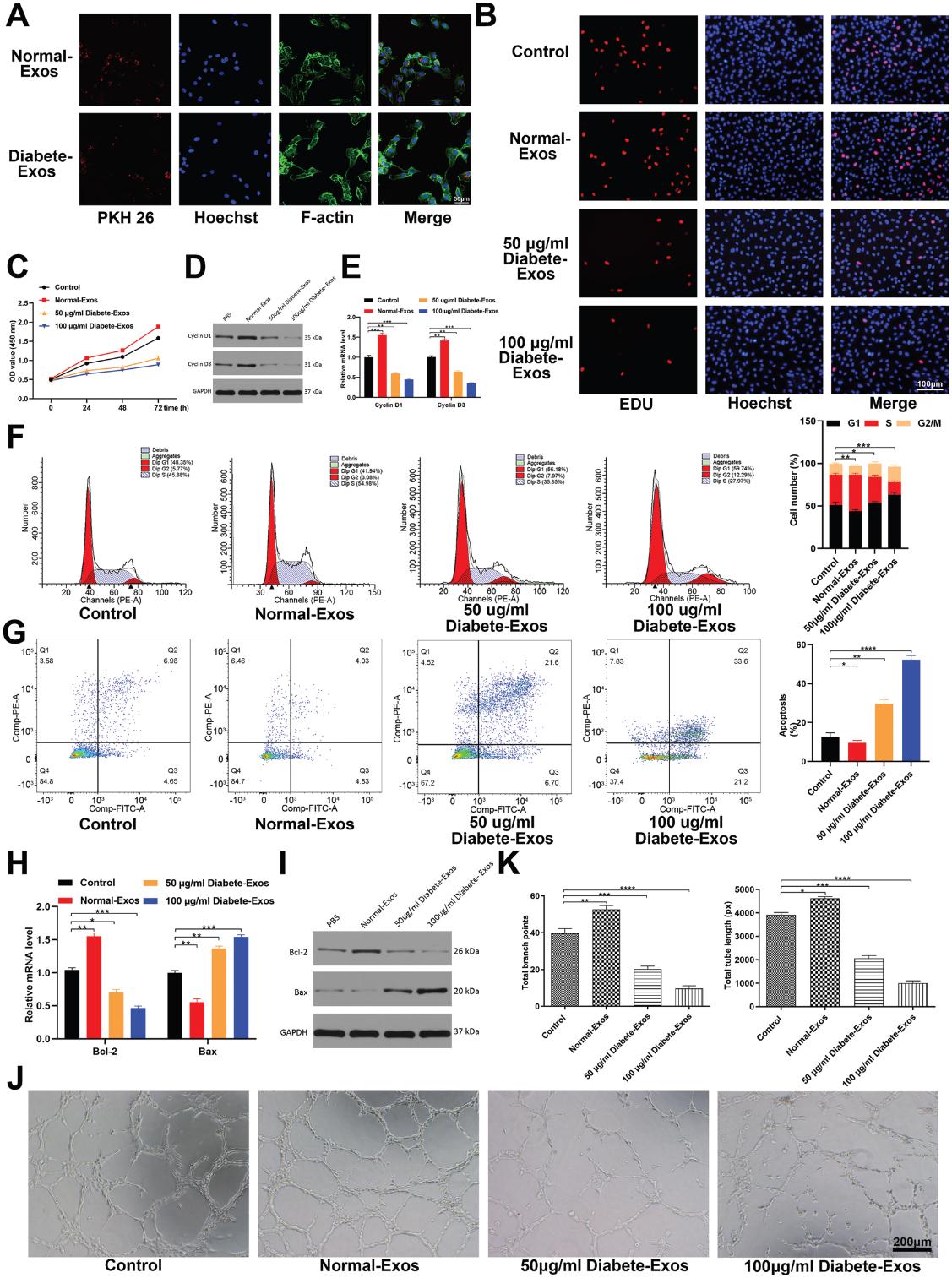
我們通過用PKH26染料標記外泌體并將其添加到HUVEC培養基中來評估HUVEC在體外吸收循環外泌體的能力。結果顯示,基于細胞中的紅色熒光染色,HUVECs能夠在12小時內吸收非糖尿病和糖尿病患者的外泌體(圖3A)。接下來,我們使用CCK-8和EDU摻入法評估了HUVEC增殖,從而探討了糖尿病患者的外泌體對HUVEC功能的影響。 我們發現,相對于非糖尿病患者的外泌體治療,用50-100μg mL-1糖尿病患者的外泌體治療HUVEC足以以劑量依賴性方式顯著降低HUVEC增殖(圖3B,C)。 我們進一步發現,在糖尿病患者的外泌體治療的HUVEC中,與增殖相關的蛋白Cyclin D1和Cyclin D3減少了(圖3D,E)。 流式細胞術進一步定量處理細胞的細胞周期分布和凋亡率,發現糖尿病患者的外泌體處理后進入S期的細胞比例明顯下降,而HUVEC凋亡相應增加(圖3F,G)。 此外,我們觀察到糖尿病患者的外泌體治療后Bcl-2表達降低,而Bax表達升高(圖3H,I)。最后,我們探索了糖尿病外泌體調節HUVEC血管生成的能力,并發現糖尿病患者的外泌體治療后管形成顯著減少(圖3J,K)。 總之,這些發現表明來自2型糖尿病患者的外泌體會損害體外傷口的愈合。
4.2型糖尿病外泌體含有高水平的miR-20b-5p并將此miRNA轉移到HUVECs
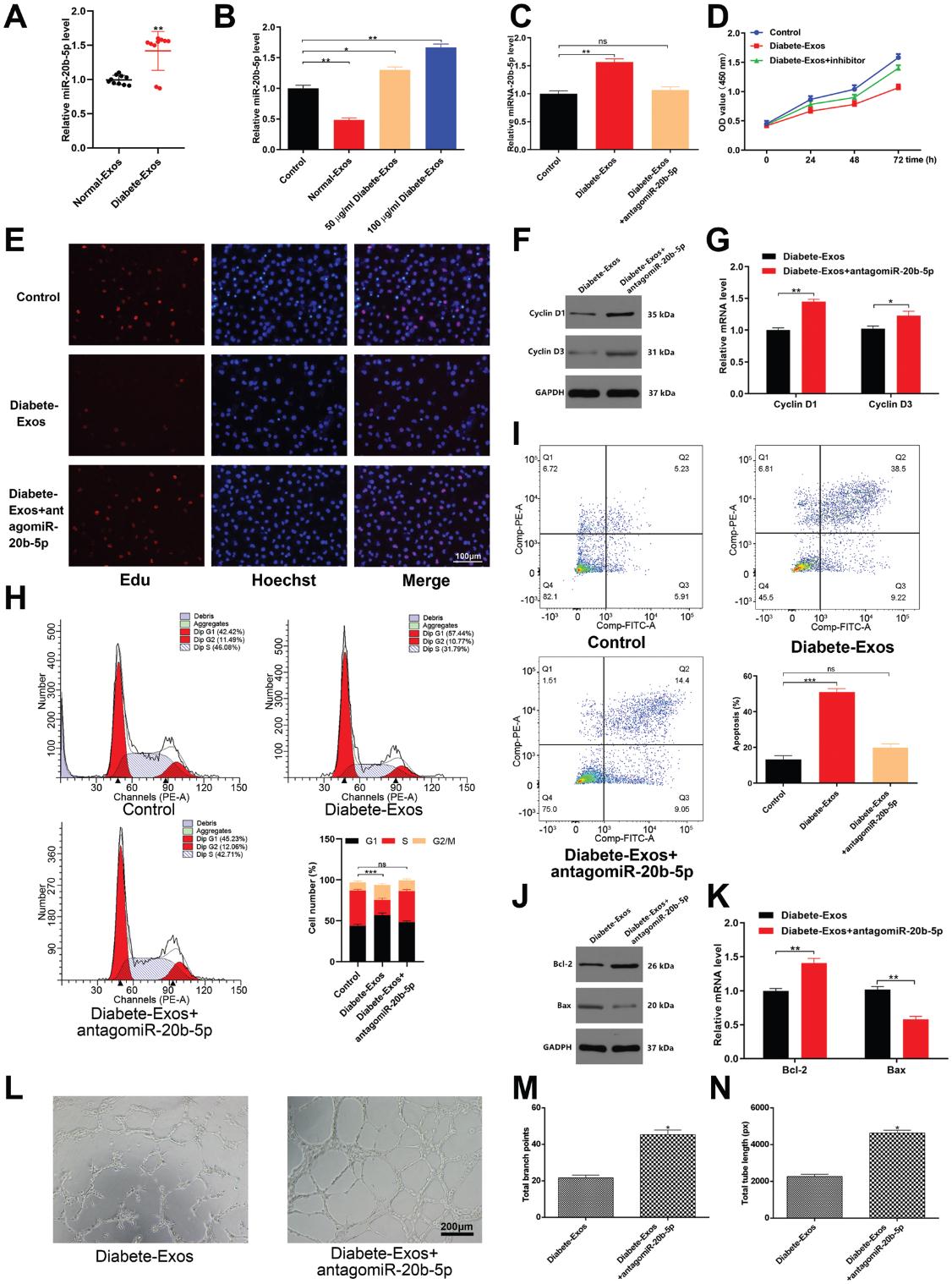
在先前的研究中,已發現miR-20b-5p在2型糖尿病患者的外泌體中高表達,同樣,我們證實了與非糖尿病對照組相比,糖尿病患者的外泌體中該miRNA的水平升高(圖4A )。 迄今為止,我們已經表明糖尿病患者的外泌體可以被HUVEC吸收,接下來我們評估包裹在這些外泌體中的miRNA是否可以被類似地吸收并在HUVEC中保持功能。與這種功能一致,我們發現相對于非糖尿病患者的外泌體治療的HUVEC,miR-20b-5p水平在糖尿病患者的外泌體治療的HUVEC中有顯著增加(圖4B)。為了探索miR-20b-5p介導糖尿病患者的外泌體對HUVEC功能的影響,我們用miR-20b-5p抑制劑(antagomiR-20b-5p)轉染了這些外泌體處理的細胞,結果顯示antagomiR-20b-5p轉染后miR-20b-5p表達下降(圖4C)。 CCK8和EDU分析證實,如果還用antagomiR-20b-5p處理,則用糖尿病患者的外泌體處理的細胞的增殖也會增強(圖4D,E)。 AntagomiR-20b-5p轉染還導致Cyclin D1和Cyclin D3表達增加,以及在S期的HUVEC百分比更高(圖4F,H)。我們同樣證實了antagomiR-20b-5p處理降低了糖尿病患者的外泌體誘導的HUVEC凋亡的能力(圖4K),并且在antagomiR-20b-5p處理的細胞中,血管的形成活性也得到了類似的增強(圖4L,N)。總之,這些結果表明,糖尿病患者的外泌體中富含miR-20b-5p,可以調節HUVEC功能。
5.miR-20b-5p抑制HUVECs的血管生成作用
我們探索了miR-20b-5p通過使用agomiR或agomiR-20b-5p處理細胞而直接影響HUVEC的能力,后者顯著提高了miR-20b-5p的表達(圖5A)。 處理后,CCK8和EDU結果證實了miR-20b-5p抑制HUVEC增殖(圖5B,C)并降低細胞周期蛋白D1和D3表達的能力(圖5D,E)。 經agomiR-20b-5p處理后,HUVECs更多地處于G1期和凋亡(圖5F,G),而用該miRNA轉染后,Bax表達增加而Bcl-2表達降低(圖5H,I)。 同樣,miR-20b-5p抑制了HUVEC管的形成(圖5J L)。這些結果證實了miR-20b-5p在體外直接抑制HUVEC功能的能力。
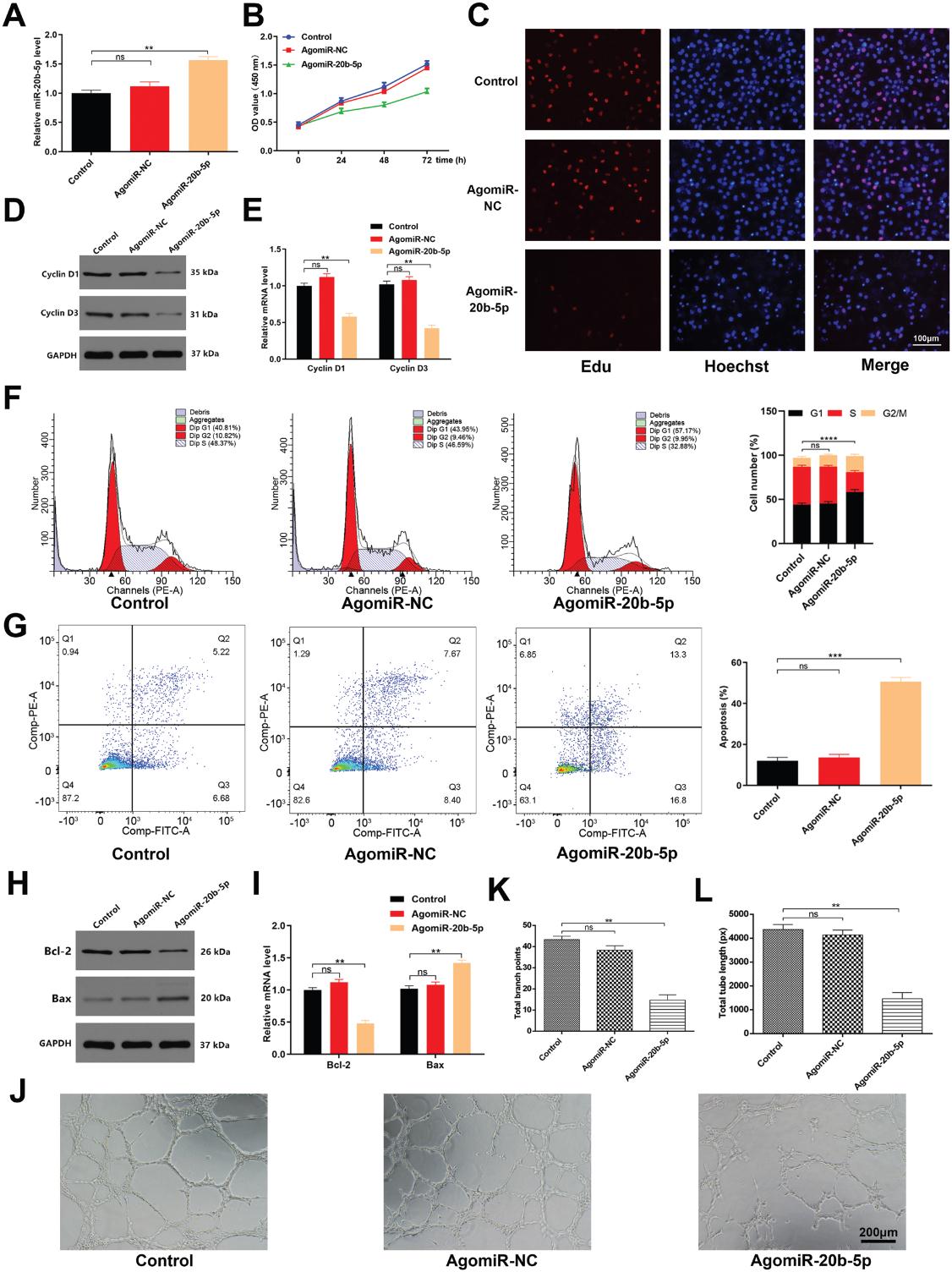
6.miR-20b-5p發揮抗血管新生的影響通過抑制Wnt9b /β-Catenin通路
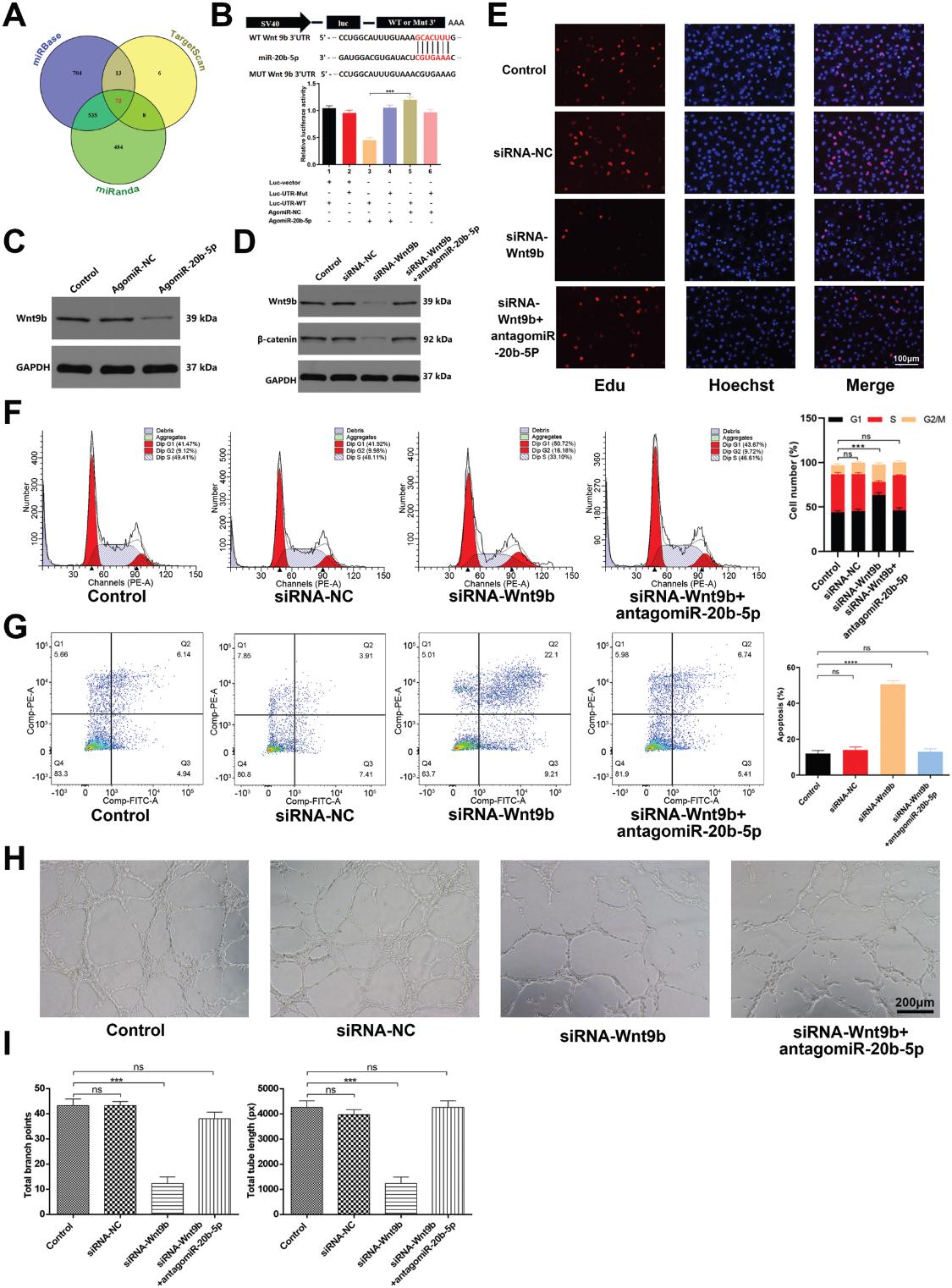
我們評估了miR-20b-5p抑制HUVEC功能的分子機制。為此,我們試圖使用miRbase,Targetscan和miRanda鑒定推定的miR-20b-5p靶標,從而使我們將Wnt9b鑒定為值得驗證的靶標基因。如圖6A所示,鑒定出73個基因為miR-20b-5p靶基因。先前的研究報道血管生成與wnt /β-catenin信號通路密切相關。在仔細篩選了73個基因后,我們發現Wnt9b可能是參與miR-20b-5p介導的血管生成的最有潛力的基因。此外,我們發現miR-20b-5p過表達顯著抑制Wnt9b的表達的(圖6B)。我們通過熒光素酶報告基因實驗證實miR-20b-5p能夠特異性結合到Wnt9b mRNA的預測靶區。當這個靶區發生突變時,miRNA不再能夠結合抑制熒光素酶活性(圖6C)。為了證實HUVEC血管生成依賴于Wnt9b,我們使用針對Wnt9b的siRNA轉染HUVECs。該siRNA顯著降低了處理過的細胞中Wnt9b和β-catenin的表達(圖6D),抑制了細胞增殖和管形成,同時促進了細胞凋亡(圖6E-I)。抑制miR-20b-5p活性部分逆轉了siRNA-Wnt9b對HUVECs的抗血管生成作用。這些發現支持miR-20b-5p直接靶向Wnt9b的能力,從而抑制HUVEC的血管生成,因此表明該miRNA至少部分地通過調節Wnt9b/β-catenin 信號通路起作用。
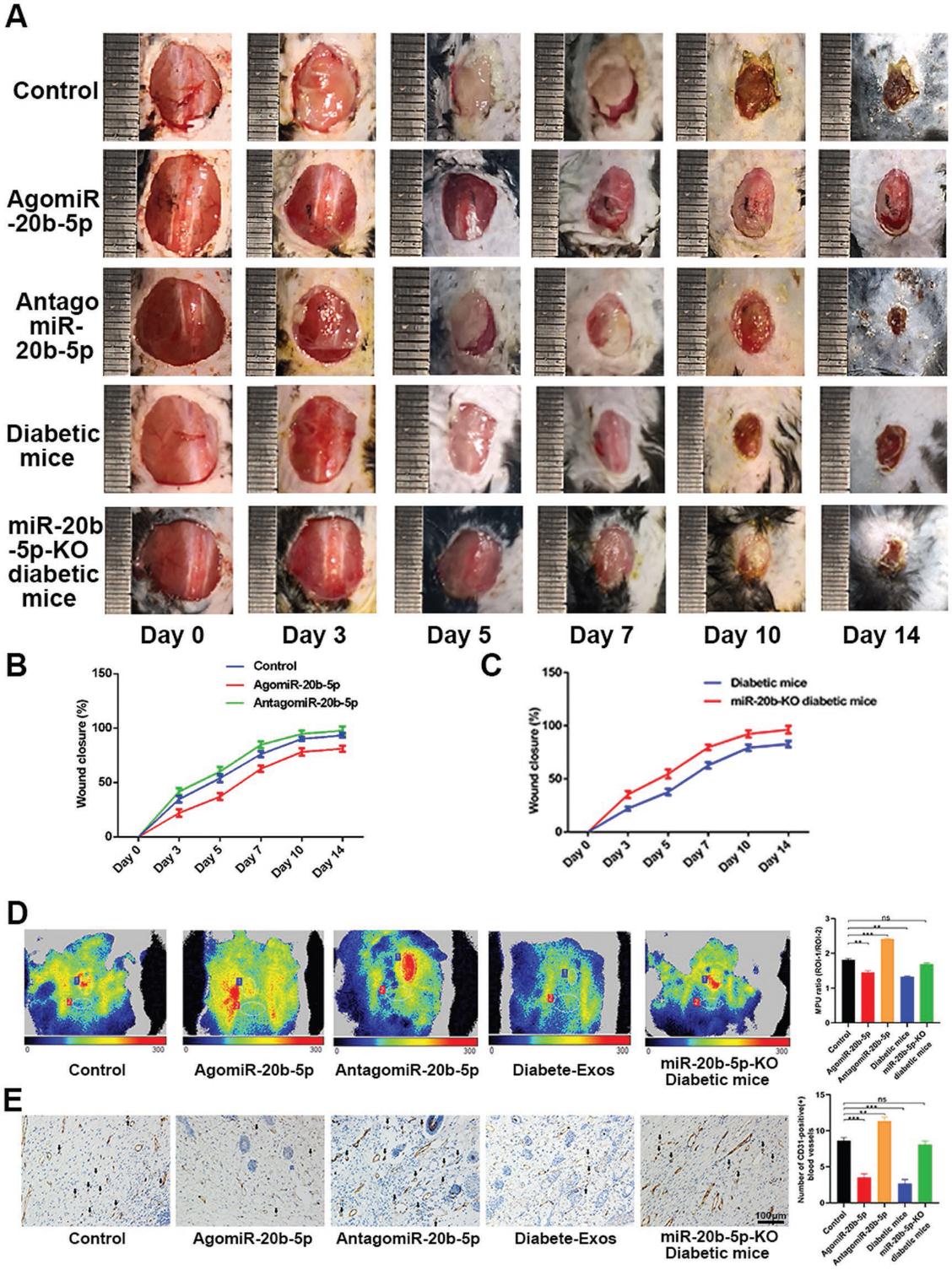
7.miR-20b-5p在體內延遲傷口愈合
最后,我們在0、3、5、7、9和11天局部注射PBS、agomiR-20b-5p或antagomiR-20b-5p來評估miR-20b-5p抑制體內傷口愈合的能力。我們發現局部的agomiR-20b-5p注射顯著損害了傷口的愈合,局部MPU比值降低與miRNA延遲傷口修復的能力一致。 為了進一步探索這種miRNA如何影響傷口愈合,我們在WT或miR-20b KO糖尿病模型小鼠的背部產生了傷口,并在miR-20b KO糖尿病小鼠中觀察到了優異的傷口愈合(圖7A-E)。因此這些發現表明miR-20b-5p沉默能促進傷口愈合,從而突出其作為糖尿病個體治療靶點的潛力。
結論:
我們的體外和體內研究結果均表明,糖尿病患者血漿外泌體通過在體外和體內影響血管內皮細胞的血管生成活性來抑制皮膚傷口愈合。miR-20b-5p在外泌體中的富集通過抑制Wnt9b /β-catenin信號通路在損害傷口愈合中起重要作用。 因此,將納米材料與miR-20b-5p抑制劑結合使用可能是將來促進糖尿病傷口愈合的有前途的治療方法。






