系統性紅斑狼瘡造血干細胞和祖細胞的轉錄組分析
造血干細胞和祖細胞(HSPCs)是多能性細胞,可產生髓系和淋巴系。我們認為系統性紅斑狼瘡(SLE)免疫細胞異常可以追溯到HSPCs。HSPCs通過髓樣偏移對炎癥刺激作出積極反應,但這可能導致疲勞、功能下降、炎癥風險增加、適應性免疫下降和心血管死亡率增加。今天小編為大家帶來最新發表于Translational science雜志上的文章“Transcriptome reprogramming and myeloid skewing in haematopoietic stem and progenitor cells in systemic lupus erythematosus”。在本研究中,我們通過RNA測序、通路富集分析,構建骨髓源性HSPCs的全球基因表達圖譜,通過流式細胞術檢測HSPCs的細胞周期狀態和凋亡狀態,通過免疫熒光法檢測DNA損傷情況。

結果:
1.小鼠狼瘡HSPCs的轉錄譜表現為髓樣偏倚
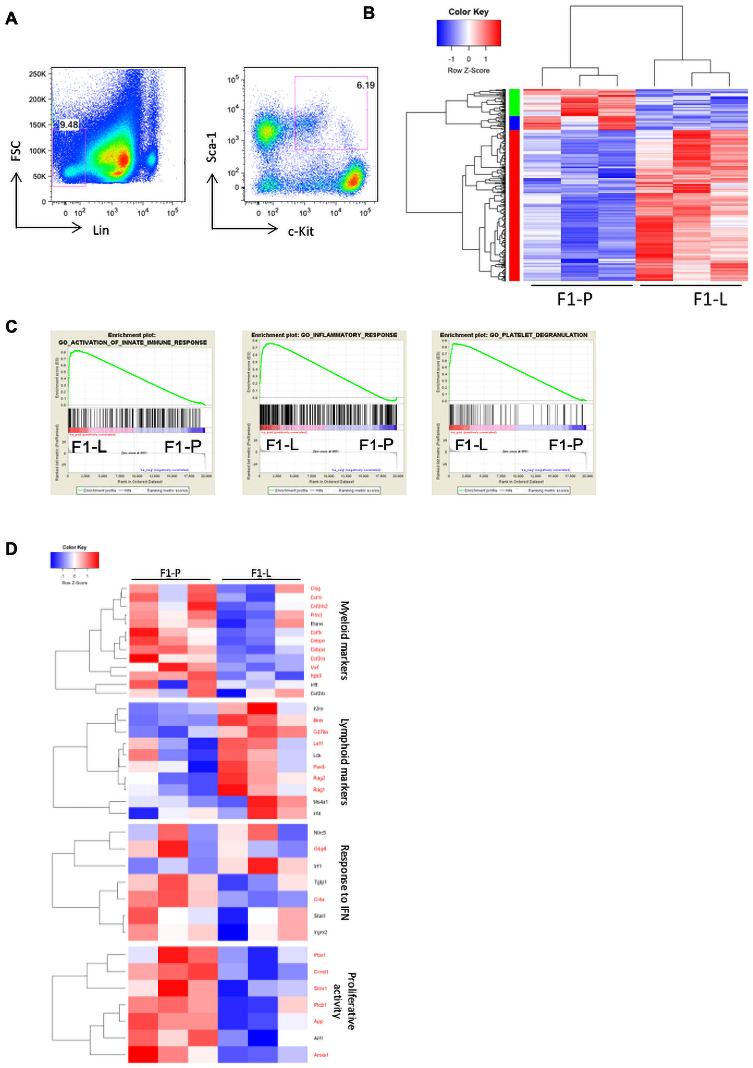
為了研究HSPCs在SLE中是否出現轉錄改變,我們使用小鼠模型NZBW/F1。年齡相當的雌性C57BL/6小鼠作為對照組。采用流式細胞術從NZBW/F1狼瘡和C57BL/6對照小鼠髓樣中篩選HSPCs,并在LSK室中進行基因分析(圖1A)。共鑒定了F1-P和F1-L小鼠之間的758個差異表達基因(圖1B)。在F1-L小鼠中,基因集富集分析顯示與炎癥反應、先天免疫反應激活和血小板脫顆粒相關的信號呈正相關(圖1C)。值得注意的是,F1-L小鼠中LSK表現出較強的增殖和較強的髓特征(圖1D)。IFN相關基因(Gbp6和Ciita)在F1-L LSK中上調,表現出強I型IFN信號,這是活性SLE的一個標志(圖1D)。總之,這些轉錄組學數據表明,F1-L LSK向髓系/粒細胞系的增殖和分化增強。
2.小鼠狼瘡HSPCs細胞的活性增殖和復制應激
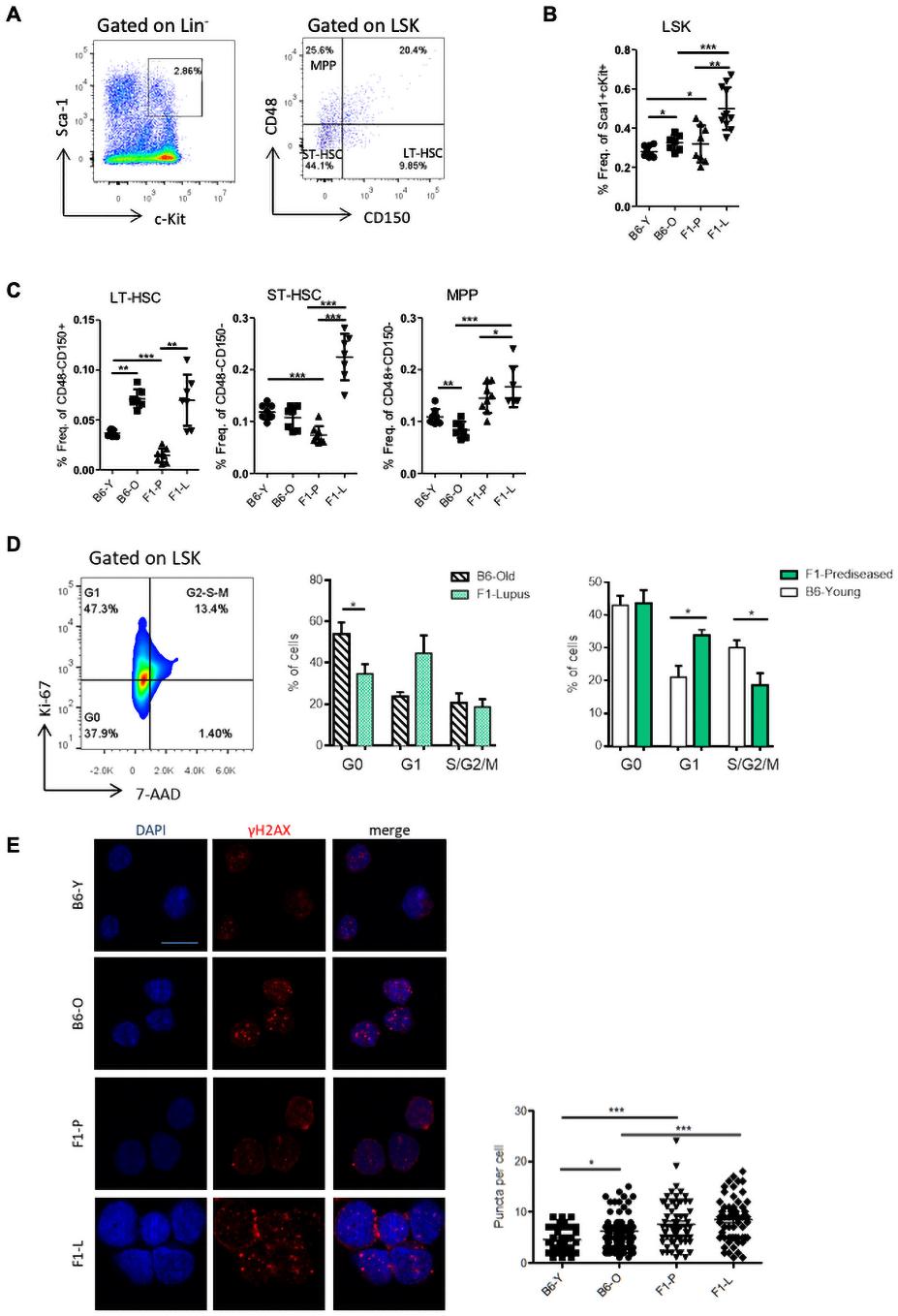
為了驗證轉錄組數據,我們分析了髓樣LSK腔室及其亞群。與F1-P相比,F1-L小鼠的LSK增加了近兩倍(圖2A,B)。在LSK室,F1-L小鼠中,短期造血干細胞和多能祖細胞的頻率更高(圖2A,C)。在穩定狀態下,HSPCs相對靜止,維持一個低數量的循環細胞,這些細胞將分化為成熟的血細胞。狼瘡LSK細胞周期分析顯示,與B6-O對照組相比,在G0期,F1-L LSK細胞增殖增加,數量減少(圖2D)。此外,與B6相比,狼瘡LSK表現出更多的雙鏈DNA斷裂(圖2E),這表明狼瘡小鼠的LSK處于復制應激狀態。
3.狼瘡疾病進展中CMPs的分化停滯
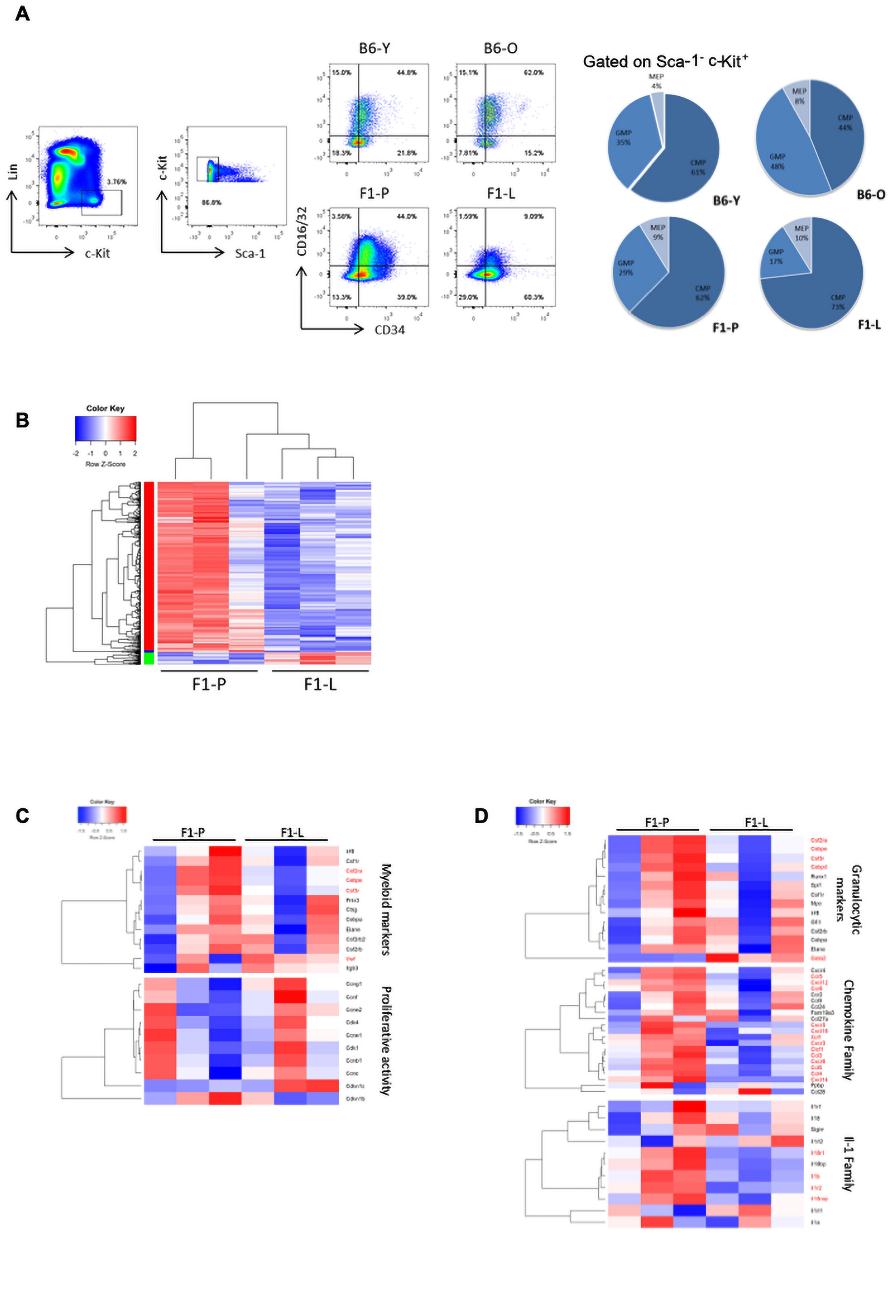
為了描述LSK期后的造血分化,我們對每個譜系的祖細胞進行了描述。F1-L組CMPs增加2.5倍,而與F1-P組相比,GMPs減少2倍(圖3A)。接著,為了進一步研究骨髓分化的調控,我們進行了轉錄分析。721個DEGs中的大部分在F1-L CMPs中下調(圖3B)。另外,髓樣標志物下調,而增殖標志物無差異表達(圖3C)。DEGs參與了與髓磷脂介導免疫、粒細胞激活、中性粒細胞遷移和補體激活相關的通路。因此,我們檢查了特異性粒細胞標記的表達(圖3D)。在F1-L CMPs中,IL-1家族的趨化因子和調節因子被下調。主要調節因子如Cebpe,Cebpd,Csf3r和Csf2rα在CMPs F1-L階段被抑制(圖3 D)。總的來說,這些結果提示骨髓祖細胞水平的分化停滯。
4.狼瘡BM中中性粒細胞增多
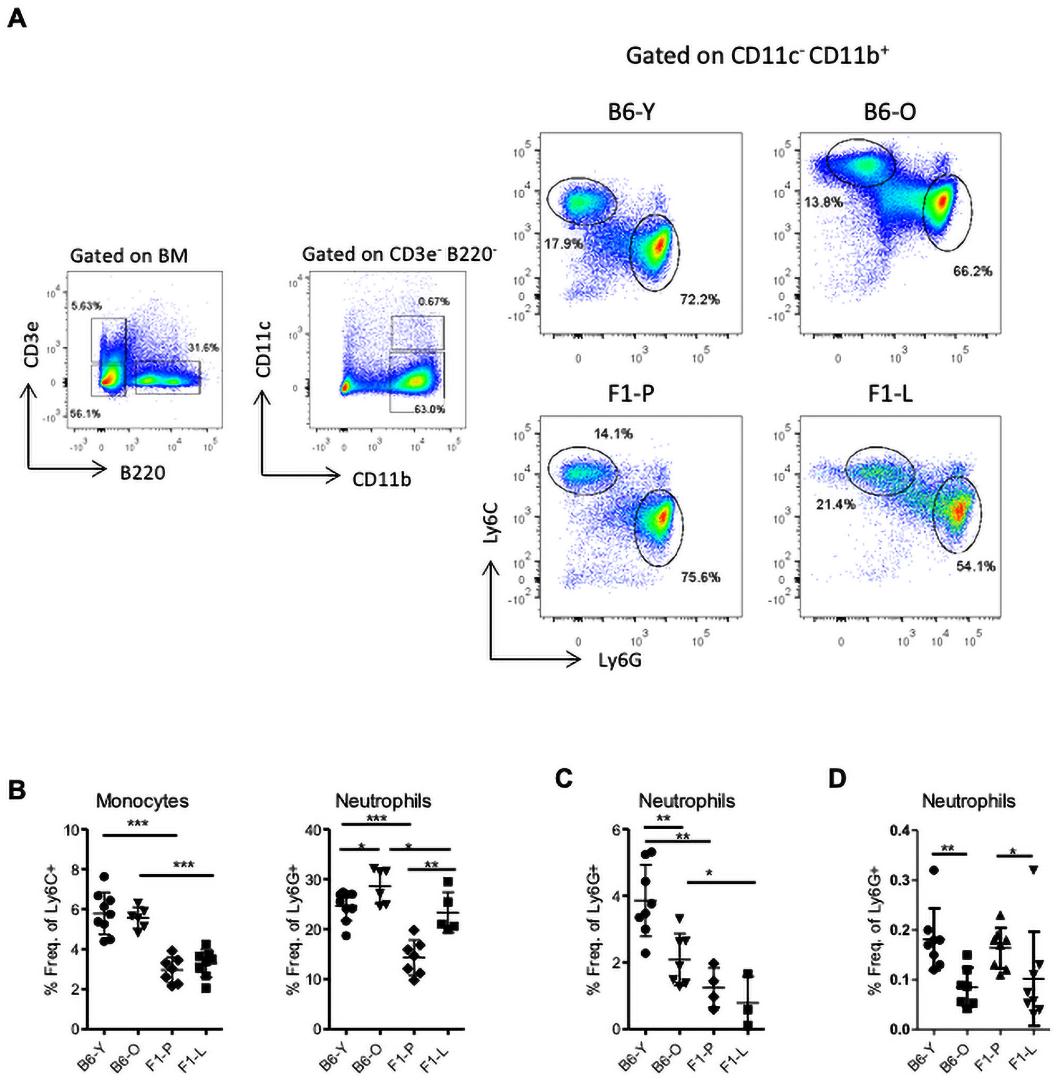
鑒于分化停滯,我們假設終末分化細胞可能會減少。然而,與F1-P相比,F1-L小鼠的中性粒細胞增加了1.6倍,而BM的單核細胞水平與之相當(圖4A,B)。衰老比對照組小鼠中性粒細胞增加1.16倍。與之相反,F1-L小鼠血液和脾臟中性粒細胞明顯減少(圖4C,D)。
5.人SLE CD34+轉錄組表現為活躍的增殖和髓樣偏移
接下來,我們研究是否可以追蹤人類疾病中的狼瘡LSK信號。為此,我們從女性SLE和HC患者的BM中純化CD34+細胞。我們在SLE和HC患者中鑒定出2364個DEGs,其中包含832個上調基因和1532個下調基因(圖5A)。SLE患者淋巴樣標志物表達下調,而髓樣標志物在患者體內表達變化較大(圖5B)。此外,系統性紅斑狼瘡CD34+細胞表現出增強擴散,而GSEA與ATR在復制應激、細胞周期和DNA依賴的DNA復制下的激活呈正相關(圖5C)。針對增強擴散,γ-H2AX評估檢查CD34+細胞是否存在增殖壓力。結果表明,SLE HSPCs表現出更多的雙鏈DNA斷裂(圖5D)。亞組分析顯示,嚴重和中度SLE患者髓樣標志物存在變化(圖5E)。值得注意的是,與中度疾病患者相比,重度SLE患者粒細胞生成特異性標志物如CEBPZ、CEBPD、GATA2的表達增加(圖5E),這與我們在小鼠狼瘡LSK中的發現一致。GSEA與細胞因子-細胞因子受體相互作用和嚴重SLE患者的運動的正調節呈正相關(圖5F)。利用上調的基因對嚴重SLE患者進行富集分析,發現粒細胞和中性粒細胞的趨化和遷移過度(圖5G)。總之,與HC相比,HSPCs在SLE患者中被激活和增殖,在重癥患者中有明顯的轉錄分化。
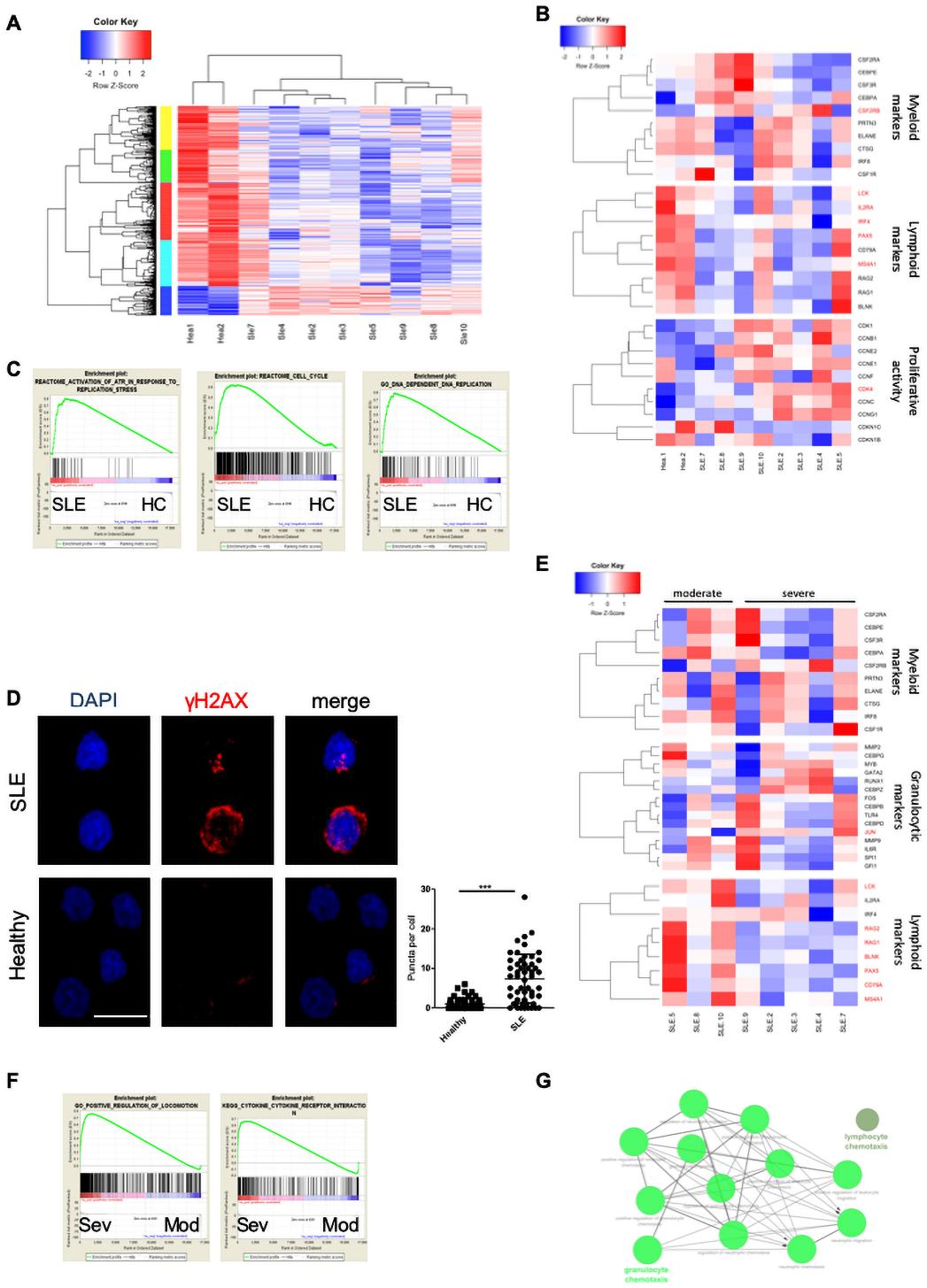
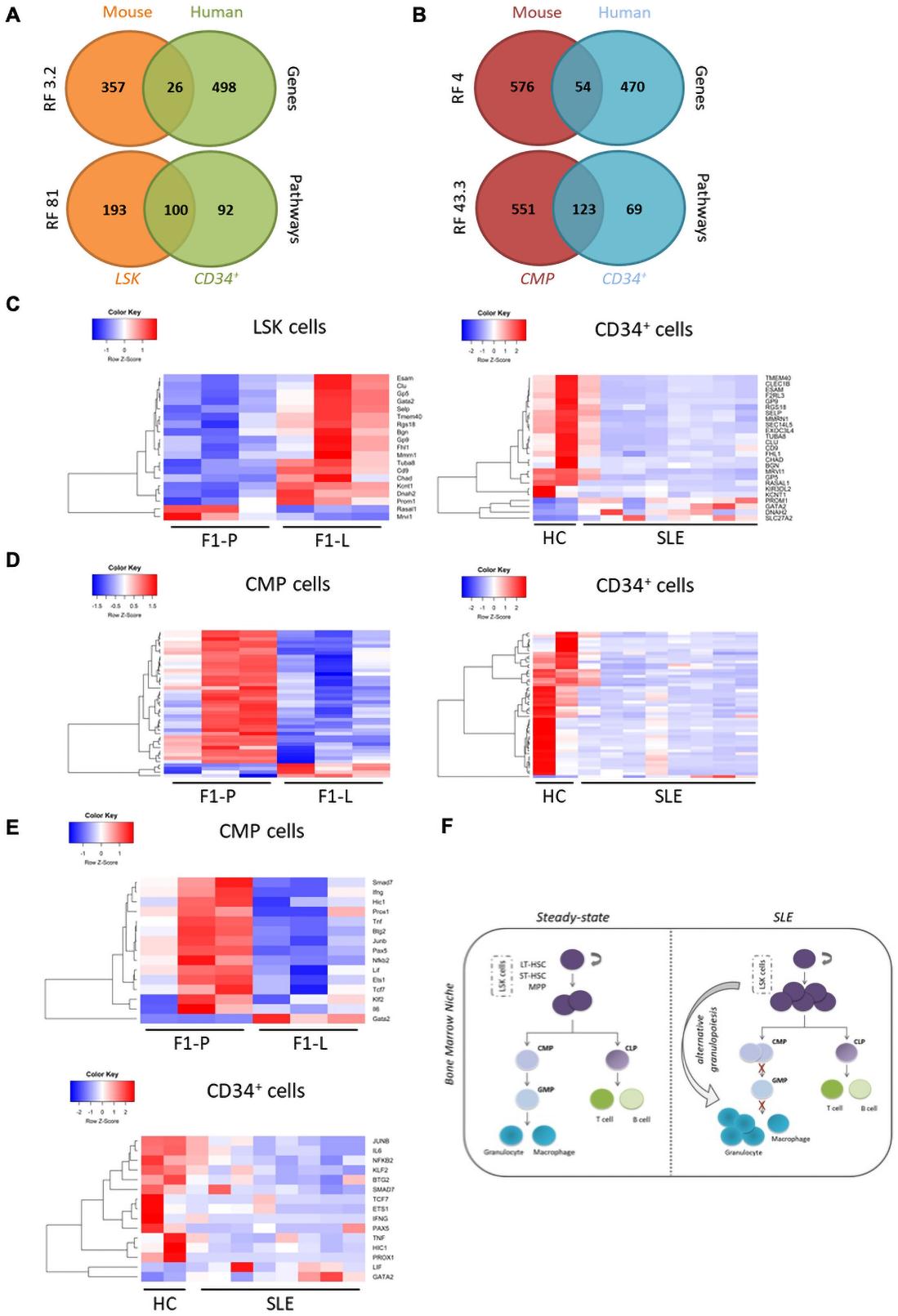
6.人類狼瘡CD34+與小鼠狼瘡CMP轉錄組的比較顯示了在祖細胞期阻滯的共同特征
接下來,我們將人類CD34+轉錄組與LSK和CMP數據進行比較。我們發現LSK DEGs和CMPs DEGs與人類CD34+ DEGs存在顯著重疊(圖6A,B)。在人類SLE患者中,小鼠LSK和人類CD34+細胞共享的DEGs大部分下調,而在小鼠狼瘡患者中沒有下調(圖6C)。然而,小鼠CMPs與人類CD34+細胞間的共同DEGs表達存在共性(圖6D)。因此,SLE CD34+轉錄組特征更容易讓人聯想到小鼠狼瘡CMPs而不是小鼠狼瘡LSK。使用RNEA,我們發現狼瘡CMPs和CD34+ SLE細胞中有15個被抑制的調節因子。其中,有重大疾病特定效應器如IFNγ和il - 6等,以及干細胞穩態分化平衡的調節因子如Ets1和Pax5(圖6 E)。總的來說,狼瘡患者的CD34+細胞在小鼠狼瘡CMPs的轉錄譜中表現出更多的共性。
結論:
系統性紅斑狼瘡的免疫細胞異常可以追溯到來源骨髓的HSPCs。HSPCs的啟動和異常的骨髓生成調節可能導致炎癥和耀斑的風險。






