外泌體和MYC在急性髓性白血病治療抵抗中的作用
導語:
急性髓細胞性白血病(AML)是由白細胞,紅細胞或血小板的異常產生引起的。白血病細胞通過直徑為30-100 nm的納米囊泡外泌體與其微環境進行通訊。外泌體通過充當腫瘤細胞和微環境之間的信使以及誘導致癌因子(例如c-Myc)來支持白血病的生長。GSK-3是一種絲氨酸/蘇氨酸蛋白激酶,PP2A激活藥物(PADs)可有效拮抗白血病的發生。作者總結了外泌體,激酶抑制劑和磷酸酶激活劑的發現為白血病患者提供了新的希望。
技術路線:
研究結果:
1 AML中的耐藥機制。
外泌體是直徑為30–100nm的納米囊泡。外泌體運輸各種各樣的成分,包括信使RNA,微小RNA(miRNA),長非編碼RNA,蛋白質,分子伴侶,膽固醇,鞘磷脂,神經酰胺,磷脂酰絲氨酸,四跨膜蛋白和Fas配體。通過使用多種標記物(例如ALIX,CD63,CD81,CD9,syndecan-1,腫瘤易感性基因101(TSG 101),主要組織相容性復合物(MHC)分子和熱休克蛋白70( HSP 70)。AML衍生的外泌體在患者來源的異種移植小鼠模型中介導的免疫抑制。已知白血病來源的外泌體可誘導調節性T細胞(Tregs)和巨噬細胞極化。還已知外泌體會干擾免疫細胞的細胞分化。外泌體可以抑制DC從前體細胞分化。外泌體也可以觸發產生TGFβ的MSC的發展。Fas陽性外泌體可通過與Fas-配體結合而觸發T細胞死亡。
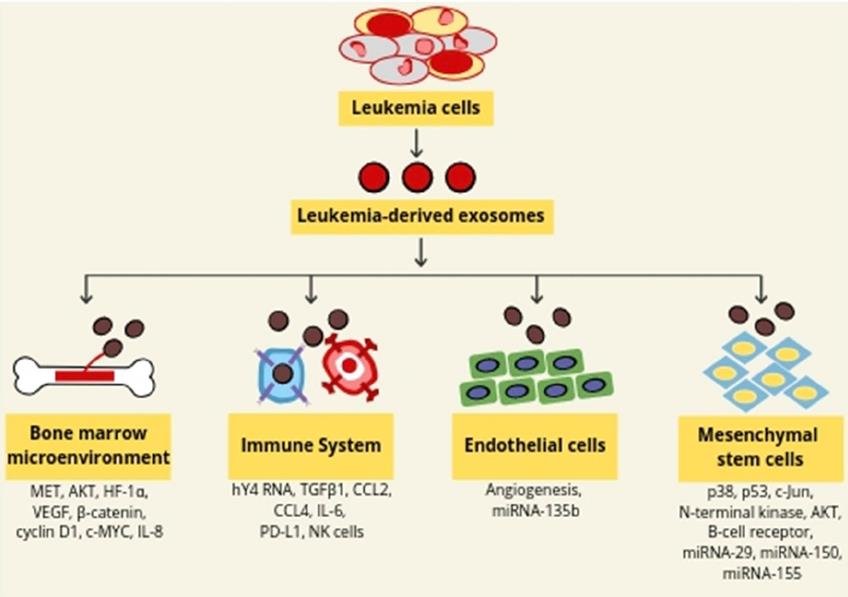
2.外泌體和白血病進展。
癌癥來源的外泌體維持腫瘤微環境并介導與腫瘤細胞的侵襲性和耐藥性相關的幾種信號轉導途徑。外泌體的改變可能導致人類白血病惡變。AML細胞的外泌體運輸改變了共培養的基質和造血祖細胞系的增殖,遷移和血管生成反應。外泌體還可以通過調節CXCR4–CXCL12信號傳導來促進白血病的生長。癌癥外泌體可以像腫瘤發生模型一樣改變骨髓微環境。 MET是肝細胞生長因子受體或酪氨酸激酶受體,外泌體介導的MET從腫瘤細胞轉運至骨髓祖細胞,黑色素瘤來源的外泌體在制造腫瘤中至關重要。源自外泌體的B細胞慢性淋巴細胞性白血病(B-CLL)患者可以激活CLL-BMSCs中的AKT / m-TOR / p70S6K /HIF-1α軸。外泌體還調節β-catenin途徑并增強骨髓間充質干細胞(BMSC)中c-MYC和cyclin D1的表達。CLL外泌體可以使骨髓微環境重塑為惡性進展。CML細胞分泌的外泌體可以刺激人BMSC產生IL-8,從而提高白血病細胞的生長和存活率,維持惡性表型需要CML-BMSC串擾。外泌體可以通過將遺傳信息從惡性細胞轉移到正常的造血細胞來誘導惡性表型。
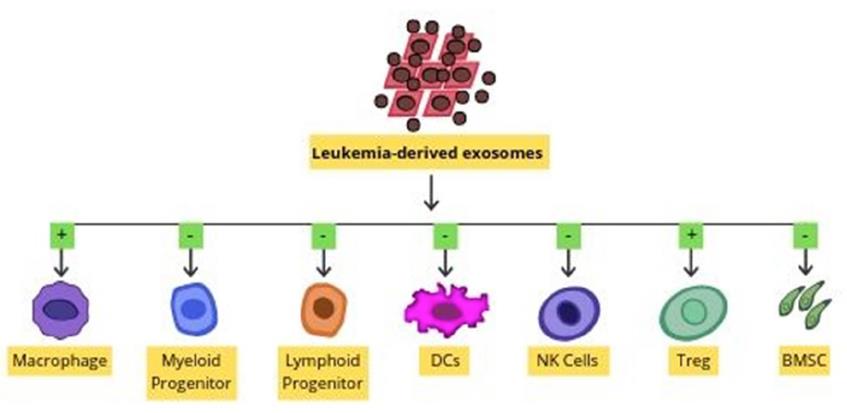
多發性骨髓瘤骨髓間充質基質細胞(MM BM-MSC)衍生的外泌體可以轉移至MM細胞。這導致體內腫瘤的調節增長。MM BM-MSC的外泌體增強了腫瘤的生長,而正常BM-MSC的外泌體則抑制了腫瘤的生長。還報道了外泌體與AML發病機制有關。提供了關于轉移的RNA的規范功能的證據。 AML外泌體也可調節骨髓功能,AML外泌體通過基質成分直接或間接誘導白血病的骨髓侵襲。 AML衍生的外泌體可以抑制造血干細胞和祖細胞(HSPC)的功能。這是通過利基保留因子的基質重編程介導的。 AML外泌體定向的miRNA轉運至HSPC也可能導致造血功能的系統性喪失。AML衍生的外泌體通過調節多個分子(例如Rab27a,DKK1,CXCL12,KITL和IGF1)將骨髓小生境轉變為白血病允許的環境。 AML衍生的循環外泌體也可以將免疫抑制貨物遞送至受體細胞,從而抑制抗腫瘤活性。

3.白血病來源的外泌體可以改變內皮細胞的功能。
白血病細胞通過將外泌體miRNA轉移到內皮細胞中來促進血管生成。將K562細胞與人臍靜脈內皮細胞(HUVEC)共培養。miR-17-92的水平在K562細胞中較高,而在HUVEC中則顯著較低, K562細胞通過外泌體將miRNA轉移到HUVEC中。還觀察到miR-92a K562細胞轉移到HUVEC中。用Cy3標記的pre-miR-92a轉染后,在HUVEC細胞中未觀察到Cy3-miR-92a信號。此外,GW4869通過抑制神經酰胺的生物合成抑制了外泌體miRNA的分泌。此外,在內皮細胞中,miRNA135b標記的外泌體與抑制缺氧誘導因子1(FIH-1)的因子相互作用。在缺氧條件下基質細胞被CLL衍生的外泌體促進了增殖和炎性細胞因子的分泌,增強了內皮細胞中的血管生成特性。總之,白血病來源的外泌體將miRNA轉移到內皮細胞和基質細胞中,導致血管生成增加。LAMA 84 CML細胞衍生的外泌體修飾了HUVECs中的腎小管分化,β-catenin和E-cadherin的丟失,增加細胞運動。 CML外泌體誘導的鼠內皮細胞生長和Matrigel栓塞血管形成與HUVEC中的src活化有關。酪氨酸激酶抑制劑消除了白血病的外泌體作用。強調白血病細胞衍生的外泌體直接影響內皮細胞并調節新血管形成。
4.外泌體和耐藥性。
BMSC外泌體可防止藥物介導的細胞凋亡,并誘導對硼替佐米的耐藥。BMSC衍生的外泌體顯著調節MM細胞中的c-Jun,p53,p38,AKT和N端激酶。源自BMSC的外泌體可以調節腫瘤的生長,血管生成,并抑制抗腫瘤NK細胞免疫的誘導。來自CLL血漿的外泌體包含與疾病結果降低相關的miRNA。外泌體miRNA150和miRNA155可以隨著B細胞受體(BCR)的激活而增加。依魯替尼使BCR失活大大降低了CLL患者血漿中的外泌體水平。可以得出結論,白血病來源的外泌體是耐藥性的重要組成部分,并且是疾病負擔的指標。
5.外泌體可以用作AML診斷的生物標志物。
負責運輸的內體分選復合體(ESCRT)在調節生物學過程(例如細胞脫落,MVB生物發生和病毒出芽)中起著主導作用。在將囊泡內容物運輸至溶酶體以進行降解中也需要它。可溶性NSF附著蛋白受體(SNARE)是靶細胞中外泌體釋放過程中必需的分子成分。在合成的各個階段中,存在于不同內體上的特定膜輪廓分子類似于其親本細胞特征。因此,外泌體可用作推定的非侵入性生物標記。因為外泌體是從體液中提取的,所以它們的分子可以預測一個人的病理生理狀態。
6.微環境不僅在白血病的發作中而且在白血病的進展中都是必不可少的。
移植研究表明該疾病起源于微環境。 Dicer1缺陷的小鼠骨祖細胞發展為骨髓增生異常,最終發展為AML。小鼠成骨細胞中的β-catenin活化突變可導致白血病。此外,成骨細胞中活化的β-連環蛋白刺激Notch配體鋸齒狀1表達。已經報道造血干細胞(HSCs)生態位的改變支持疾病的進展。 白血病干細胞(LSC)限于具有長期造血干細胞(LTHSC)表型的細胞。骨髓增生性腫瘤(MPN)逐步重塑了白血病小環境,有利于骨髓纖維化和白血病干細胞功能。腫瘤微環境的變化可能有助于白血病細胞抵抗抗白血病藥物。生態位的基質細胞可為AML,ALL和CLL提供保護環境。基質細胞可通過釋放抗凋亡因子減輕白血病細胞的凋亡。白血病細胞的存活取決于抗原與骨髓微環境的直接接觸。內皮細胞的微環境也支持白血病細胞的增殖和存活。靶向白血病細胞和內皮細胞微環境之間的通訊或抑制微環境的改變對于白血病治療可能是一種有吸引力的方法。外泌體與白血病微環境的相互作用有助于白血病細胞入侵免疫系統。
7.cMyc及其調節劑在耐藥中的作用。
原癌基因c-Myc可維持增殖,分化,凋亡和細胞周期。 c-Myc調節對于維持健康細胞的細胞增殖至關重要。 c-Myc的表達降低在白血病中起重要作用。在大多數人類造血惡性腫瘤中觀察到c-Myc的過度表達。 c-Myc在AML細胞的白血病發生誘導中起重要作用。 c-Myc在許多人類造血惡性腫瘤中的表達與不良預后相關。癌基因如PLZF-RARA,PML-RARA和AML1-ETO促進了髓樣白血病的發生。
8.糖原合酶激酶3(GSK-3)是自然界普遍存在的絲氨酸/蘇氨酸激酶。
有兩種亞型存在,即GSK-3α和GSK-3β。該激酶調節多種細胞過程,例如信號轉導和基因表達,并可以決定細胞命運。 GSK-3在多種人類疾病(包括神經系統疾病,2型糖尿病,中風和腫瘤)中起著至關重要的作用。 GSK-3與幾乎40種與癌癥發病相關的底物發生反應。 GSK-3β是重要的腫瘤抑制因子,可將磷酸基團引入促癌分子。腫瘤促進途徑激活β-連環蛋白并穩定c-Myc蛋白以促進腫瘤發生。GSK-3的藥理抑制作用可降低白血病細胞的細胞周期進程,增殖并增加其髓系分化,后者轉化為嵌合MLL癌蛋白。在正常的造血過程中,HOX基因在造血干細胞和祖細胞中持續表達。 MLL融合蛋白會顯著影響HOX的異常表達,而MEIS1會枚舉HOX的異常表達以維持白血病細胞的轉化。
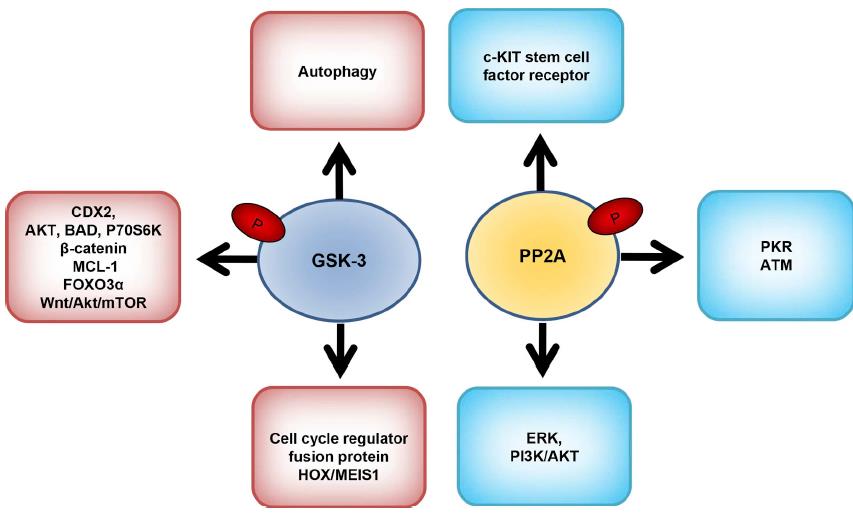
9.蛋白磷酸酶2A(PP2A)是一種以二聚體和三聚體形式存在的Ser / Thr磷酸酶。
它起著抑癌作用,并逆轉大多數激酶驅動的細胞內信號轉導。在固體和血液系統惡性腫瘤中,這種磷酸酶的活性被顯著抑制。PP2A活性的降低通常與存活率的提高和凋亡的抑制有關。 PP2A-Aα和PP2A-Aβ亞基的結構突變導致B和C亞基的結合受損。這會抑制PP2A活性并促進細胞轉化。在大多數AML患者中,通常會觀察到Aβ亞基的下調。 c-KIT是干細胞因子受體或酪氨酸激酶的一種,存在于與干細胞因子結合的細胞表面。 c-KIT中的突變導致AML患者的支架蛋白表達改變和調節亞基改變。 c-KIT促進分化,存活和增殖。致癌性c-KIT中的突變通過降低PR55α,PR61α,PR61γ,PR61δ和PR65α的蛋白質水平來抑制PP2A活性。可以通過恢復c-KIT + AML患者的PP2A活性來逆轉耐藥性。促進PR55α和AKT失活的策略可能是AML治療的潛在途徑。
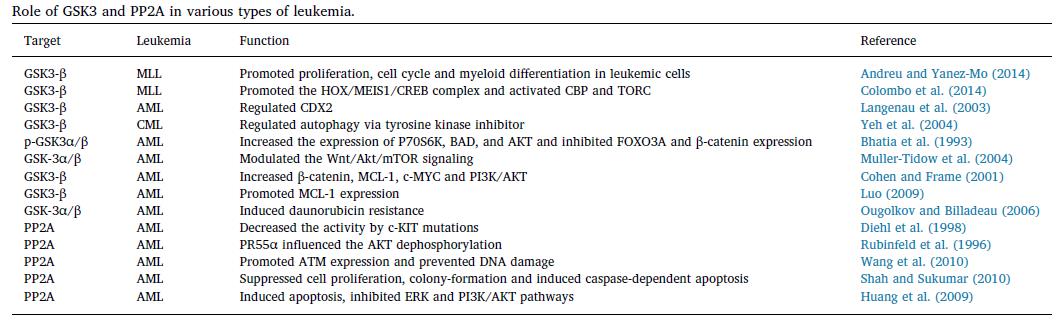
10. 基于GSK3和PP2A的藥物可用于白血病細胞的化學增敏。
但許多免疫學障礙阻礙了白血病的治療。GSK3抑制劑調節可能影響白血病發生的多種途徑,例如存活率,化療耐藥性,白血病干細胞生長和CML細胞自噬。GSK-3β還可作為HSCs分子標記缺失后疾病進展和MDS患者生存的預后標志物。GSK-3α和GSK-3β相關途徑可幫助轉化為MDS和隨后的AML。這為潛在的治療靶標。FGF / Ras / ERK和Wnt通路參與了AML患者對AC220的耐藥性發展。MCL-1是AML細胞中GSK的關鍵靶標。 GSK-3的藥理抑制或基因敲低可以防止MCL-1減少。臨床前研究還證明了AML,ALL和CML中GSK3抑制劑的前景。在體外和體內白血病模型中,6-溴二氮卓比30肟(BIO)已顯示出療效。 GS-87是GSK3的特異性抑制劑,可在AML細胞中誘導分化。AML患者中GSK3抑制劑LY2090314的功效。在患者中觀察到GSK-3抑制。因此,與其他藥物聯合使用時,該藥物可能會產生潛在的益處。
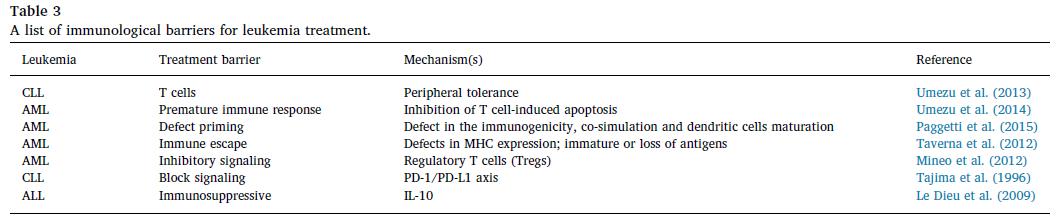
總結:
外泌體對白血病相關的惡性腫瘤的治療潛力已通過許多研究證明。 MSC衍生的外泌體可以強迫患者的外周血單核細胞,促炎性細胞因子反應和改善的臨床移植物抗宿主病癥狀得到緩解。外泌體能有效地將藥物,miRNA和抗原遞送到靶細胞中血液系統惡性腫瘤。含有siRNA的外泌體也可以穿過血腦屏障。外泌體的這一特性可用于治療對化學療法反應較差的中樞神經系統相關的白血病。正在開發一些方法,以選擇性地沉默外泌體傳遞的信息,從而促進癌癥的發展。從以上內容可知,白血病骨髓和外泌體介導的信號傳導有助于白血病的進展。外泌體是調節受體細胞中白血病發展的重要信使。惡性白血病細胞還可以通過外泌體的介導發展抗藥性機制。另一方面,正常造血或組織細胞分泌的外泌體介導抗腫瘤反應。外泌體已成為血液惡性腫瘤的敏感,特異和非侵入性生物標志物。由GSK-3抑制劑的脫靶活性引起的不良反應是通過與ATP競爭性結合位點結合的藥物獲得的。 PP2A抑癌活性的藥理學恢復可有效拮抗白血病的發生。更多研究應在臨床上檢查基于GSK-3和PP2A的藥物的療效。需要新的方法來降低GSK-3和PP2A抑制劑對AML患者的不利影響。






