缺氧膠質瘤細胞分泌的外泌體miR-301a的作用機制
最近的證據表明,miRNAs可以被釋放到細胞外微環境中,并通過外泌體介導細胞與細胞之間的通訊。今天小編帶大家了解近期發表于Molecular therapy上的一篇關于缺氧膠質瘤細胞分泌的外泌體miR-301a通過靶向TCEAL7激活Wnt/β-catenin信號并促進放療抵抗的文章。本研究的目的是鑒定參與膠質母細胞瘤(GBM)抗放療的外泌體miR-301a(exo-miR-301a),并揭示其可能的機制。

技術路線:

結果:
1.exo-miR-301a由缺氧GBM細胞特異性表達和分泌
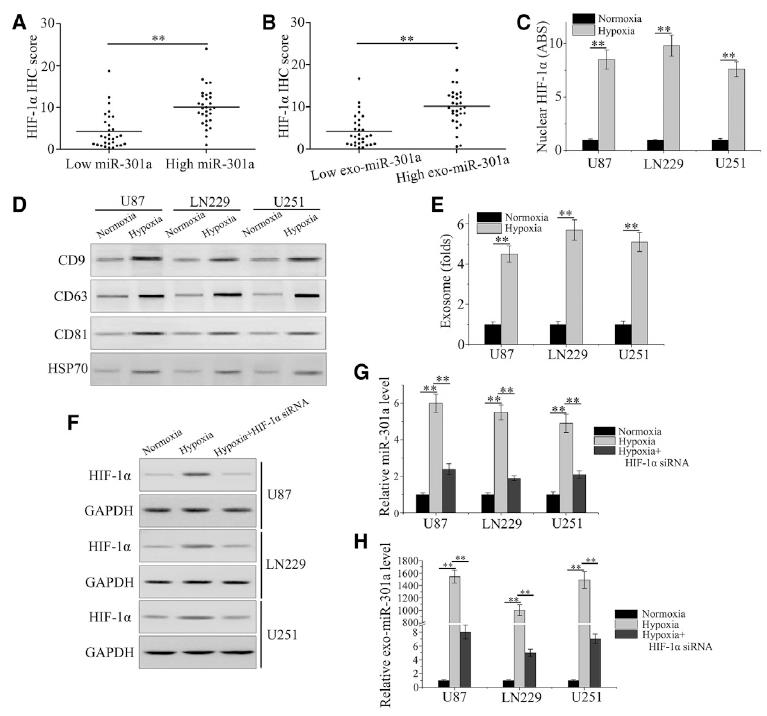
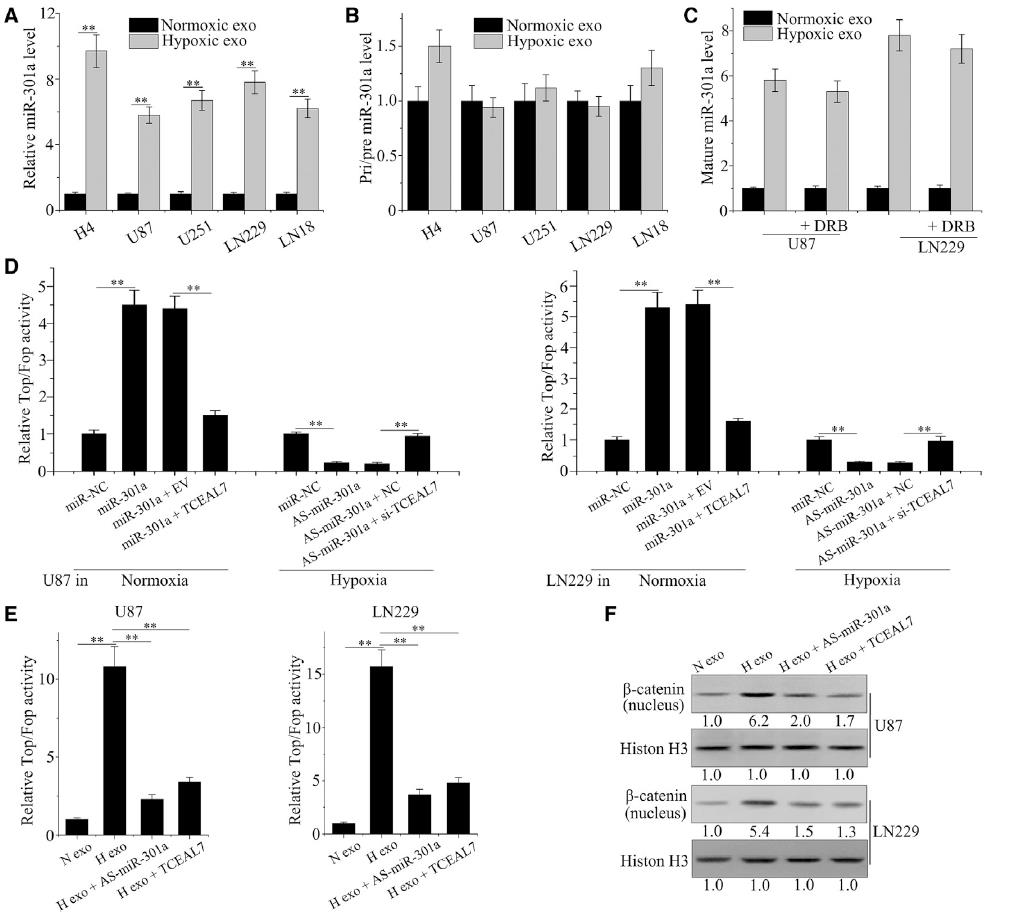
根據我們之前的觀察,miR-301a在膠質瘤組織中顯著上調。在此,我們檢測exo-miR-301a在缺氧人GBM中的功能。HIF-1α表達作為缺氧生物標志物,與miR-301a在膠質瘤患者中的表達進行比較。HIF-1α水平高的患者miR-301a表達水平較高(圖1A),血清exo-miR-301a的百分比根據HIF-1α免疫組化評分分布(圖1B)。ELISA結果顯示,GBM細胞對缺氧的反應是通過增加細胞核中HIF-1α的水平(圖1C)。從正常或缺氧條件下暴露的GBM細胞中檢測含有CD9、CD63、CD81和HSP70的外泌體標記物。如圖1D所示,缺氧細胞中所有外泌體標記物的水平均高于常氧細胞。低氧條件也顯著增加了外泌體中存在的囊泡數量,這可以通過納米顆粒跟蹤分析檢測到(圖1E)。為了探討miR-301a表達增加與HIF-1α之間的關系,我們觀察了miR-301a和exo-miR-301a在HIF-1α不同狀態下的水平。缺氧誘導HIF-1α, siRNA干擾后降低(圖1F)。缺氧顯著增加了miR-301a和exo-miR-301a的表達;同時,HIF-1α的下調顯著降低了miR-301a和exo-miR-301a的表達(圖1G和1H)。綜上所述,我們證明exo-miR-301a是由缺氧GBM細胞特異性分泌的,與HIF-1α狀態有關。
2.來自缺氧膠質瘤細胞的exo-miR-301a直接作用于常氧膠質瘤細胞中的TCEAL7
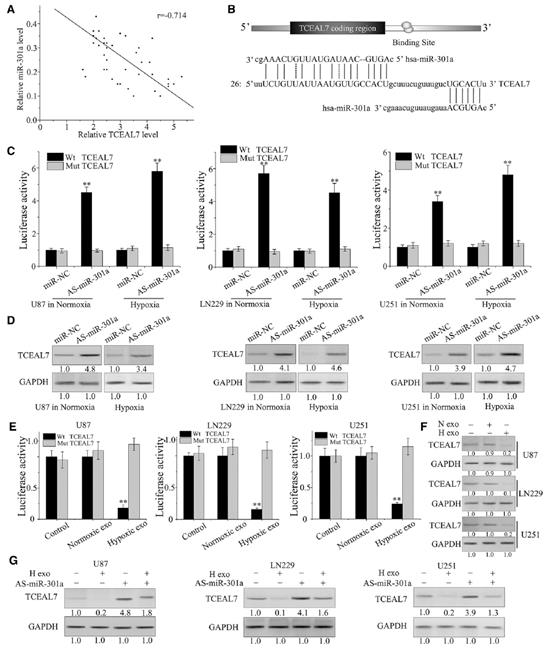
為了探討miR-301a在TCEAL7調控中的作用,我們檢測了exo-miR-301a與TCEAL7蛋白在膠質瘤患者中的關系。TCEAL7水平與miR-301a的表達水平呈負相關(圖2A)。為了證實miR-301a與TCEAL7的直接結合,設計熒光素酶報告實驗,利用含有野生型(WT)和突變體(MT)的熒光素酶報告質粒TCEAL7 3’UTRs與miR-301a結合位點進行。TCEAL7 3‘UTR包含miR-301a的兩個高度保守的靶位點,第一個靶位點被證明是結合位點(圖2B)。如圖2C所示,與TCEAL7- 3’UTR突變組相比,miR-301a在常氧和缺氧條件下均顯著干擾了轉染luc -TCEAL7-UTR的細胞的熒光素酶活性。與熒光素酶報告實驗結果一致,在常氧和缺氧條件下,轉染As-miR-301a導致TCEAL7表達顯著下降(圖2D)。此外,我們還檢測了正常培養的GBM細胞中TCEAL7的表達。與對照組和常氧外泌體組相比,缺氧外泌體處理降低了熒光素酶活性(圖2E)。此外,與正常組和對照組相比,缺氧外泌體處理顯著改變了TCEAL7蛋白水平(圖2F)。通過轉染As-miR-301a,可以阻止缺氧衍生的外泌體對TCEAL7下調的影響(圖2G)。
3.TCEAL7在膠質瘤惡性腫瘤中經常下調
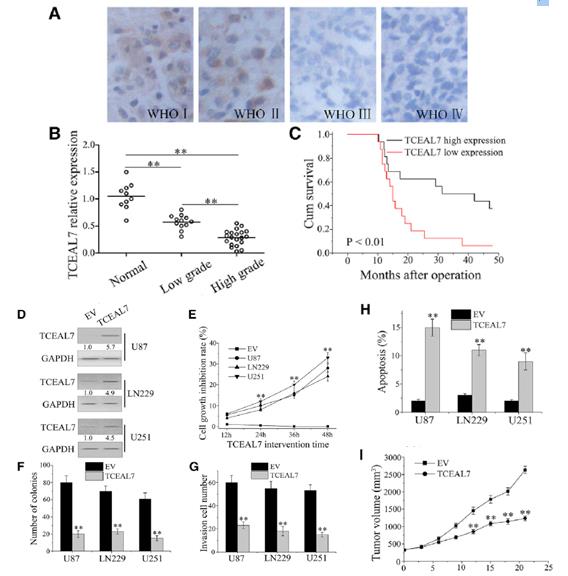
在相似的組織中檢測到TCEAL7蛋白水平,并隨著惡性腫瘤程度的增加而下調(圖3A)。采用qPCR技術分析TCEAL7在膠質瘤及正常腦組織中的表達。如圖3B所示,TCEAL7在膠質瘤組織中的表達低于正常組織,且隨著病理分級的升高而降低。生存分析顯示TCEAL7高表達患者的生存率明顯高于TCEAL7低表達患者(圖3 C)。與對照組相比,在TCEAL7載體組中TCEAL7蛋白水平顯著升高(圖3D)。 MTT結果顯示,經TCEAL7處理的細胞存活率低于陰性對照組細胞(圖3E)。克隆實驗表明,轉染TCEAL7載體的細胞在軟瓊脂上形成的菌落明顯少于對照組(圖3F)。此外,上調TCEAL7表達可顯著降低GBM細胞侵襲能力(圖3G)。采用Annexin V/propidium iodide(PI)雙染色,TCEAL7載體中凋亡細胞比例顯著增加(圖3H)。接下來,我們建立了皮下腫瘤U87細胞株,如圖3I所示,兩組在腫瘤大小的前9天無明顯差異;然而,從第10天開始,與對照組相比,TCEAL7載體組的異種移植瘤的大小明顯減小。
4.TCEAL7通過與β-catenin結合負調控Wnt/β-catenin轉錄通路,而不抑制β-catenin的穩定性
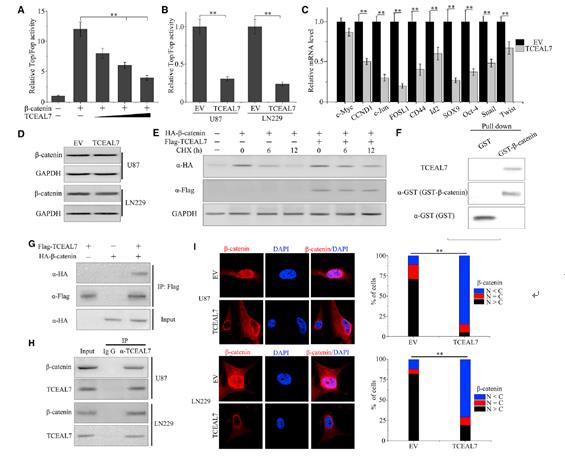
為了研究TCEAL7與Wnt/ β-catenin信號通路之間的相互作用,我們首先研究了TCEAL7過表達對H4細胞中β-catenin/T細胞因子(TCF)轉錄活性的影響。β-catenin的加入顯著增強了TOP FLASH活性。然而,TCEAL7的過表達抑制了β-catenin刺激的TOP FLASH報告基因的活性(圖4A)。另外,通過TOP/FOP reporter構建的高級別膠質瘤細胞U87和LN229中檢測到,TCEAL7的高表達顯著抑制了Wnt/β-catenin活性(圖4B)。然后我們檢測TCEAL7是否調控wnt靶向基因的表達。結果表明,在TCEAL7過表達細胞中,wnt靶向基因的表達水平顯著降低(圖4C)。但過表達TCEAL7并沒有抑制β-catenin蛋白水平(圖4D)。為了進一步研究TCEAL7過表達對β-catenin穩定性的影響,我們進行了環己酰亞胺追蹤實驗。結果顯示過表達TCEAL7的細胞與對照細胞相比,β-catenin沒有顯著變化(圖4E)。為了深入了解TCEAL7抑制表面TCF活性的機制,我們研究了TCEAL7是否與β-catenin發生物理作用。結果表明純化后的TCEAL7與GST-β-catenin共沉淀,但不單獨與GST共沉淀(圖4F)。此外,HA-β-catenin與FLAG-TCEAL7共沉淀(圖4G)。內源性β-catenin與內源性TCEAL7共沉淀,在U87和LN229細胞中形成復合物(圖4H)。最后,當我們增加TCEAL7在膠質瘤細胞中的表達時,我們檢測了β-catenin的核易位。免疫熒光圖4I顯示,與空白對照相比,TCEAL7過表達阻斷了β-catenin從細胞質向細胞核的易位。
5.從缺氧膠質瘤細胞中提取的exo-miR-301a轉移到正常膠質瘤細胞中,通過靶向TCEAL7增加Wnt/ β-catenin信號的活性
為了證實缺氧膠質瘤細胞分泌的miR-301a可以通過外泌體轉移到正常細胞中,我們測量了不同膠質瘤細胞經正常或缺氧處理后分泌的外泌體miR-301a水平。在源自受體缺氧細胞的外泌體中,成熟miR-301a的細胞水平升高(圖5A),但未觀察到pri-或pre-miR-301a在外泌體攝取方面的變化(圖5B)。此外,經外泌體處理的細胞中miR-301a的水平沒有受到RNA聚合酶II抑制劑的顯著影響(圖5C)。我們研究了Wnt/β-catenin的轉錄活性,以闡明TCEAL7參與exo-miR-301a介導的Wnt/β-catenin信號通路。圖5D和圖5E顯示,miR-301a模擬轉染和缺氧膠質瘤細胞源性外泌體暴露顯著增加了Wnt/β-catenin信號的表達和轉錄活性。相反,高水平的TCEAL7降低了miR-301a模擬物或暴露于缺氧外泌體誘導的Wnt/β-catenin活性。同樣,在缺氧細胞中抑制TCEAL7可以消除As-miR-301a在TOP-FOP檢測中的作用。此外,As-miR-301a和TCEAL7載體挽救了缺氧細胞來源的外泌體對Wnt/β-catenin活性的影響(圖5F)。
6.miR-301a參與缺氧外泌體共培養膠質瘤細胞的放射敏化
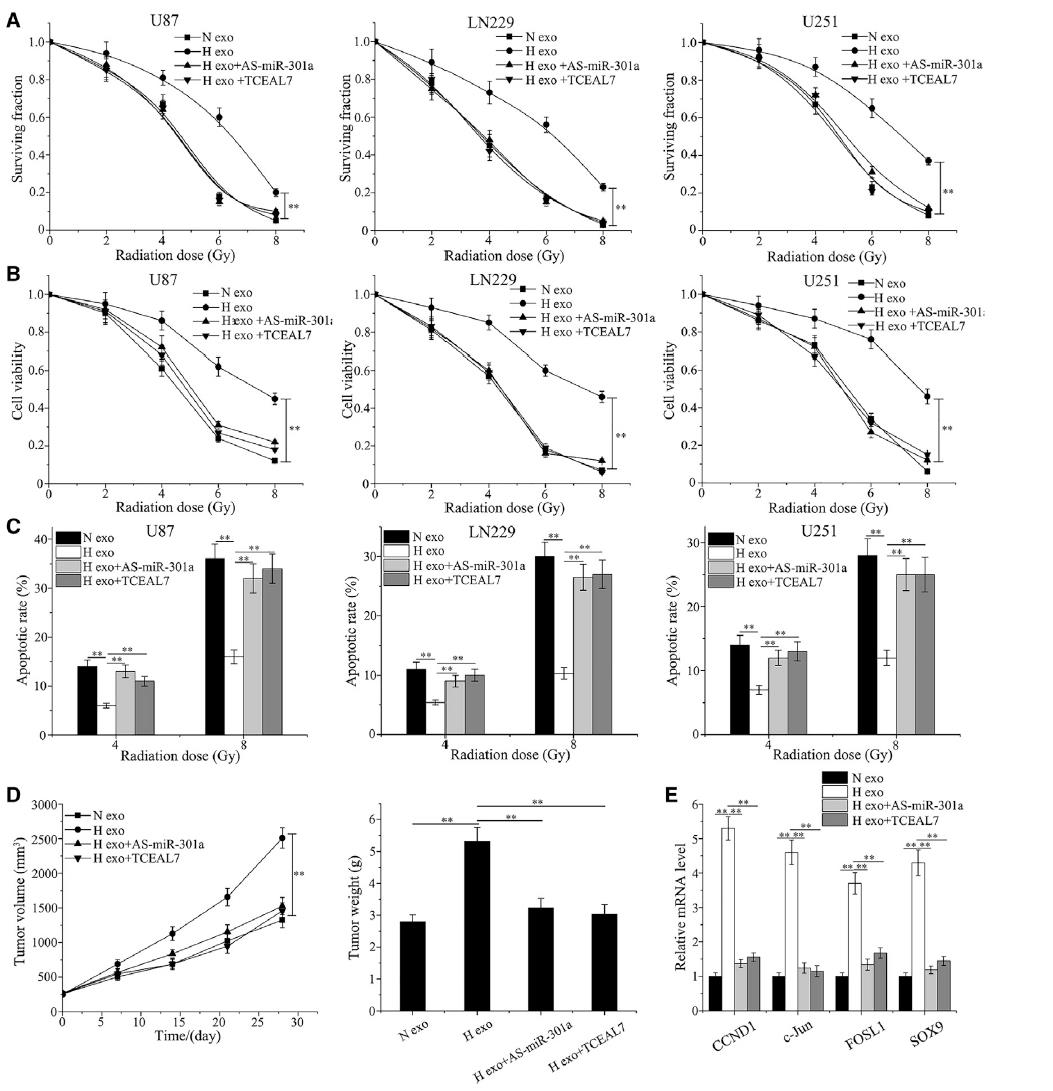
為了探討缺氧的exo-miR-301a水平是否介導膠質瘤細胞的放射敏化,我們檢測了細胞輻照后的生存能力。結果表明,缺氧外泌體組與常氧細胞相比,在輻射誘導的存活率方面無明顯下降,且表現出抗輻射能力。此外,miR-301a下調或TCEAL7升高顯著增加細胞對輻射的敏感性(圖6A)。此外,與常氧外泌體組相比,缺氧外泌體組在細胞活力方面不能被進一步抑制;然而,當轉染As-miR-301a或TCEAL7載體時,情況發生了逆轉(圖6B)。我們進一步研究了miR-301a對輻照后細胞凋亡的影響。結果表明常氧外泌體培養組被4-或8-Gy照射誘導的凋亡細胞比例明顯高于缺氧外泌體組,另外伴有As- miR -301a或TCEAL7載體時,凋亡能力得到恢復(圖6C )。為了便于體外實驗,利用U87膠質瘤細胞系建立皮下腫瘤,進一步評估miR-301a在低氧膠質瘤耐輻射中的作用。在異種移植瘤生長試驗中,與對照組相比,缺氧外泌體組中輻射不能顯著降低腫瘤生長,體外檢測分析顯示,As-miR-301a或TCEAL7載體增強了腫瘤抑制作用(圖6D)。然后進行qPCR檢測受Wnt/β-catenin通路轉錄調控的mRNA水平。Wnt/β-catenin下游基因在缺氧外泌體條件下被激活;然而,As-miR-301a或TCEAL7可以顯著抑制過表達(圖6E)。
總結:
exo-miR-301a是缺氧膠質瘤細胞特征性表達和分泌的,是Wnt/β-catenin的一個強有力的調節劑,然后通過靶向抑癌基因TCEAL7降低放療敏感性。這可能為GBM患者的細胞耐腫瘤治療放療提供一個新的靶點。






