循環外泌體非侵入性地監測移植細胞
研究背景:
目前,研究人員正在探索干細胞和祖細胞用于再生醫學應用;然而,移植后跟蹤細胞并確定治療效果仍然具有挑戰性。來自美國馬里蘭大學和賓夕法尼亞大學的研究人員最近在Science Translational Medicine發表文章“Circulating exosomes derived from transplanted progenitor cells aid the functional recovery of ischemic myocardium”,IF= 17.161。從血液中分離外泌體來監測心臟梗死后移植到大鼠心臟中的人心肌球源細胞(cardiosphere-derived cells, CDCs)和心臟祖細胞(cardiac progenitor cells, CPC)。他們發現,可以根據主要組織相容性復合物錯配純化CDC/CPC衍生的外泌體,并且外泌體含有與心肌修復相關的microRNA。體外培養皿中培養的CPC/CDC產生的外泌體的內容物與移植到體內的細胞產生的外泌體的內容物不同。該研究表明,循環外泌體可用于非侵入性地監測移植細胞。
基于干/祖細胞的療法在臨床前移植和組織損傷模型中發揮不同程度的疾病治療作用。這些療法現在在人體臨床試驗中顯示出有希望的結果。最近,相關研究已經證明與成人衍生的CPC或CDC相比,來自人新生兒心臟組織的心臟祖細胞(CPC; c-kit+/Lin?)和心肌球源細胞(CDCs)可更好地減少心臟瘢痕大小,改善心功能,并減輕不良的心肌重塑。盡管在成人缺血性心臟病中使用CPC或CDC移植進行了1期臨床試驗,但增強其臨床療效的一個主要限制因素是在心肌重塑期間無法無創地監測移植細胞及其治療效果。
此外,移植的心臟干/祖細胞的保留率低。干細胞分泌蛋白組的成分,包括外泌體,通過供體年齡依賴性途徑促進心肌恢復。與心臟修復有關的外泌體研究的指數增加突出了這些含有miRNA的小囊泡(30至150 nm)的治療潛力,這些囊泡來自多泡體與質膜的融合。外泌體攜帶修復受損心臟所需的蛋白質,以及miRNA,它們能夠通過改變靶細胞的轉錄組來促進長期修復。
盡管CPC或CDC的心肌內移植在臨床前研究中挽救了梗死的心肌并改善其功能,但是對于CPC或CDC的有益作用的潛在機制尚不清楚。之前,該研究團隊對CPC分泌組進行了深入分析,證明單次心肌內注射來自新生兒CPC的外泌體可促進心肌恢復,與新生兒CPC注射后觀察到的作用相當。這些結果表明,CPC或CDC至少部分治療功效可能歸因于它們的外泌體。此前,已有研究報道在受體的血漿中觀察到來自移植的實體器官的循環組織特異性外泌體。外泌體含有特異的蛋白質組和RNA特征,反映其來源細胞的狀態。
最近,該研究團隊還證明了循環中移植組織特異性外泌體表征能夠以時間敏感、條件特異性的方式對移植的實體器官進行無創監測。因此,研究人員假設移植的干/祖細胞將外泌體信號釋放到外周循環中,干/祖細胞特異性外泌體的表征將能夠對移植細胞的功能活性和條件狀態進行無創監測。然而,尚不清楚移植的干/祖細胞衍生的外泌體是否具有與其體外培養的祖/干細胞類似的內容物特征,以及是否能夠通過檢測和使用這些循環外泌體用于移植祖細胞駐留和活性的非侵入性監測。
干細胞移植的應用因沒有簡單高效的無創監測靶器官內移植細胞的方法而受到阻礙。該研究假設在受體血漿中定量和表征移植細胞衍生的外泌體將能夠對移植細胞的條件活性進行可靠的、非侵入性的監測。為了驗證這一假設,研究人員使用了一種人-大鼠異種心肌梗死模型,比較了兩種研究較多的祖細胞類型:心肌來源細胞(CDCs)和c-kit+心臟祖細胞(CPC),兩者都來自接受體外循環的成人的右心耳(RAA)。
一、CPCs 和 CDCs 在體外和體內的功能特征
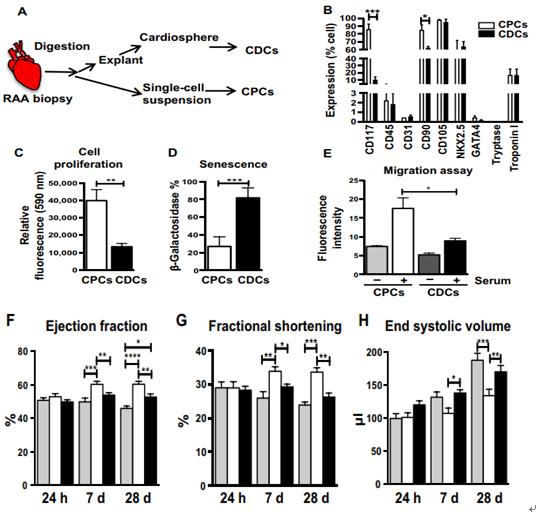

成人 CPC 和 CDC 移植后大鼠 MI 模型的表型特征和心臟功能評估。
A.在心臟手術時接受冠狀動脈旁路移植術治療嚴重動脈粥樣硬化疾病的成年患者(68±10 年)的右心耳(RAA)獲得人體心肌活檢。使用我們先前修改的涉及外植體平板接種,選擇處理和擴增的方案,從相同的 RAA 活組織檢查樣品中分離成人CPC 和 CDC。B.針對干細胞特異性表面標志物( CD117, CD105, CD90, CD45 和CD31),心臟譜系標志物(NKX2.5,肌鈣蛋白 I和 GATA4)和肥大細胞標志物類胰蛋白酶的 CPC和 CDC 的流式細胞術分析(n = 5)。C.alamarBlue 測定CPC 和 CDC 的細胞增殖(n = 8)。D.當兩種祖細胞類型增殖直至 P6 時,與 CPC 相比,通過增加的β -半乳糖苷酶活性證實大多數成體 CDC 發生衰老。E. 祖細胞的另一個關鍵功能特性是它們在移植到梗塞心肌后的內在遷移能力。為了在體外重現這種功能活性,通過 transwell遷移測定法測量兩種祖細胞類型的遷移潛力。與 CDC相比, CPCs 遷移能力高。F-I.為了檢查 CPC 的生長和遷移特性是否與梗塞后恢復心肌功能的能力提高相關,來自相同心臟活組織檢查的 CPC 和 CDC被移植到嚙齒動物 MI 模型中。結扎左前降支(LAD)動脈后,將 100 萬個 CPC, 1 百萬個 CDC 或無細胞 Iscove 改良的Dulbecco's 培養基(IMDM)注射到左心室(LV)的受損心肌中。通過在 MI 后 24 小時進行超聲心動圖檢查每個治療組,其在該時間點在三組中顯示相似的射血分數(EF)。通過超聲心動圖和尸檢組織學評估組的心臟功能和 LV 重塑。與培養基對照相比,移植的 CPC 和 CDC 顯著改善了心臟功能結構表現為增加的 EF,縮短分數(FS),舒張末期容量減少( EDV),收縮末期容積(ESV)。與 CDC 相比,CPC 的 LV 功能改善顯著更大。J.MI 后 1 周,父母在隨訪的 4 周內持續。通過 MI 后 28 天的組織學分析進一步評估 LV 的結構變化,重點是纖維化(Masson三色),小動脈密度(平滑肌肌動蛋白)和總血管密度(異凝集素 IB4)。心肌纖維化的代表性圖像和三種不同治療組的定量。MI 后 4 周,相對于 IMDM 對照,用 CPC或 CDC 治療的心臟中梗塞面積(纖維化面積相對于總染色心肌面積)明顯較小,纖維化顯著(CPCs 對 CDC, P <0.0001)降低。盡管CPC 和 CDC 治療均顯著增加了小動脈(SMA)和總新生血管密度(IB4)與 IMDM 對照,在新生血管密度方面, CPC 的表現優于 CDC。
二、CDC 群體中增加的 c-kit+化學計量提高了治療功效
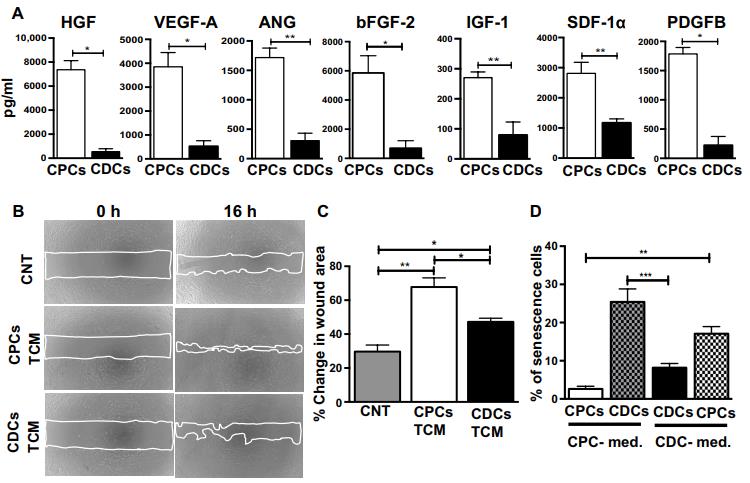
在體外和體內從CPC,CDC和混合細胞群衍生的培養基(TCM)的功能評估。
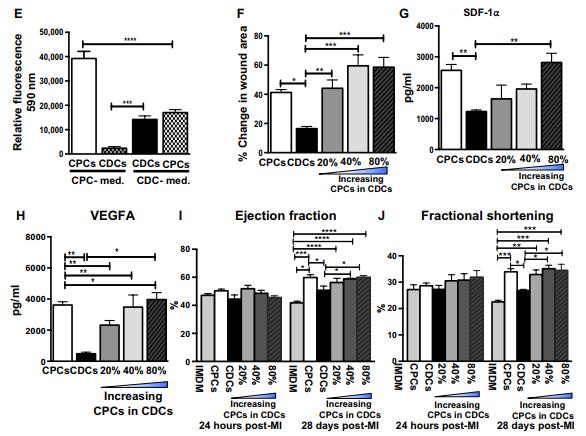
A.基于ELISA的CPCs和CDCs(n = 4至6)體外分泌的7種旁分泌因子的定量分析。B.C. 為了評估源自 CDC 和 CPC 的 TCM 的血管生成潛力,對人乳腺上皮細胞(HMEC)進行傷口愈合測定,保持 TCM 蛋白濃度恒定(蛋白質濃度, 50ng /μl)。與 CDC TCM 相比,在存在源自 CPC 的 TCM 的情況下,傷口面積顯著降低.D. E. 改為非指定生長培養基配方, CDC 和 CPC 導致早期發病衰老,細胞增殖減少和間充質細胞標記物丟失(CD90 和 CD105).F. 們在其處方培養基中培養 CPC 和 CDC,并在體外測定或心肌內注射到大鼠 MI 模型之前調節 CDC群體內的 c-kit+細胞比例。劃痕遷移測定證明,增加 CDC 中 c-kit+細胞比例逐漸增強傷口愈合。G.H. 從具有不同比例的 c-kit+細胞的 CDC 收獲 TCM。通過 ELISA 實驗檢測SDF-1a 和 VEGFA 在以下情況下會增加 c-kit+細胞濃度。I.J測試了這些肌肉的心肌恢復潛力。研究人員建立的嚙齒動物 MI 模型中的結合組,同時保持恒定的移植細胞總數(100 萬)。隨著 c-kit+細胞濃度的增加,EF 和 FS 顯著增加。
三、CPC和CDC將含有祖細胞特異性的人主要組織相容性復合物的外泌體釋放到受體血漿中
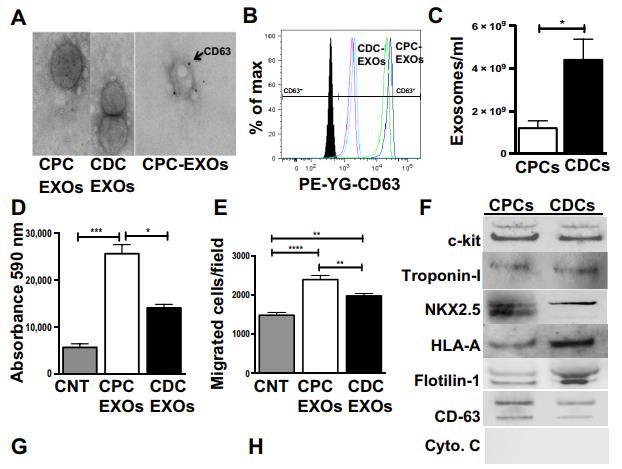
在注射CPC或CDC后體外從大鼠血漿中獲得的CPCs和CDC的外泌體的表征。
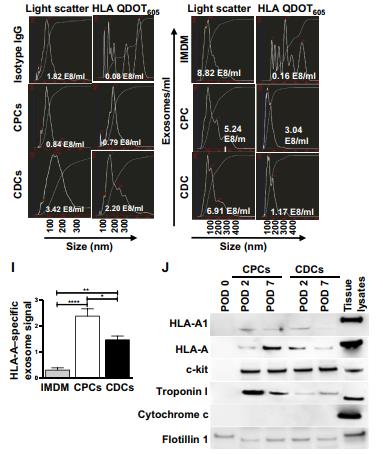
A.透射電子顯微鏡(TEM)示意圖,分離的細胞外囊泡外泌體的大小標記物 CD63。B.與 CPC 衍生的外泌體相比,使用 CD63結合磁珠的流式細胞術證實 CDC 衍生的外泌體上表現出更高的 CD63 表達。C.通過納米粒子追蹤分析(NTA)對這些外泌體的進一步表征顯示, CDC 衍生的外泌體不僅比 CPC 衍生的外泌體更大(平均大小,165nm),濃度也更高。D.E. 在具有相等和恒定數量的外泌體的基礎上,CPC 衍生的外泌體在 HMEC 中誘導更多的增殖,并且與 CDC 衍生的外泌體相比表現出更多的血管生成潛力。我們得出結論,盡管數量較少,CPC 衍生的外泌體可能比 CDC 衍生的外泌體更有效用于心肌修復。F. 從 CDC 和CPC 分離的外泌體中的干細胞標記物和心臟相關蛋白的免疫印跡。G. 在培養物中對來自CDC 或 CPC 的外來體進行體外測試,并在外泌體上檢測 HLA-A特異性信號.H. 在體內,祖細胞特異性外泌體信號在總體內在祖細胞移植后 2 和 7 天,在受體大鼠血漿中定量外泌體。選擇這些時間點是因為我們之前的分析表明,盡管大多數移植的祖細胞丟失,但在移植后 7 天觀察到受損心肌的心臟功能改善. 在第 7 天, IMDM(陰性對照), CDC 和 CPC組中血漿外泌體的總數相似,但僅在 CDC 和 CPC 組中檢測到祖細胞特異性外泌體信號.I. 與 CDC 衍生的外泌體相比,在 CPC 衍生的外泌體中觀察到約兩倍更高的祖細胞特異性 HLA-A 外來體信號.J.我們評估了循環祖細胞外泌體是否共表達 MHC 和其他表面標志物和反映 CDC 和 CPC 細胞成分的蛋白質。術后天(POD)2 和 7 從大鼠血漿中純化的人祖細胞特異性外泌體的免疫印跡分析表明,在兩個選定的時間點,移植的細胞特異性外泌體亞群表達 HLA 分子(HLA-A 和 HLA A1) , flotillin 1(外來體標記物),c-kit(祖細胞標記物)和心肌細胞標記物肌鈣蛋白 I.
四、循環中源自移植細胞的外泌體miRNA的PLSR和功能分析
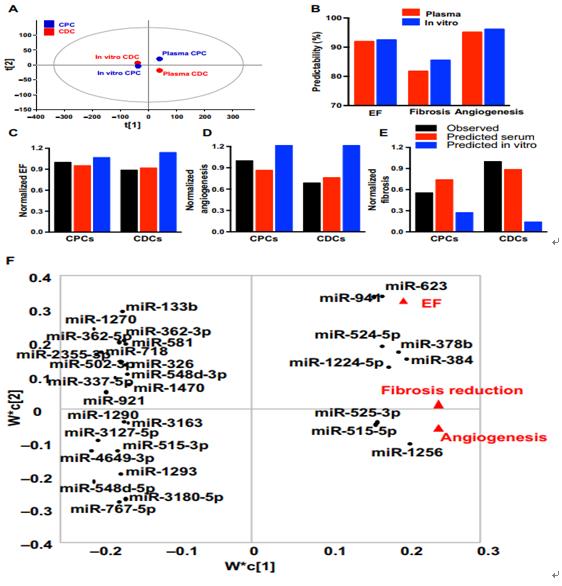
為了在體內非侵入性地監測移植的CDC或CPC的活性,研究人員從受體總血漿外泌體中純化了祖細胞特異性外泌體。移植后7天,與CDC特異性外泌體相比,血漿CPC特異性外泌體的濃度增加約兩倍。生物信息學的通路分析未能將CPC或CDC細胞mRNA與觀察到的心肌修復聯系起來,但與受體血漿中純化的CPC外泌體的miRNA有關。研究進一步確定了與移植的CPC相關的心肌修復的機制。
五、通過計算分析預測 miRNA 功能的實驗驗證
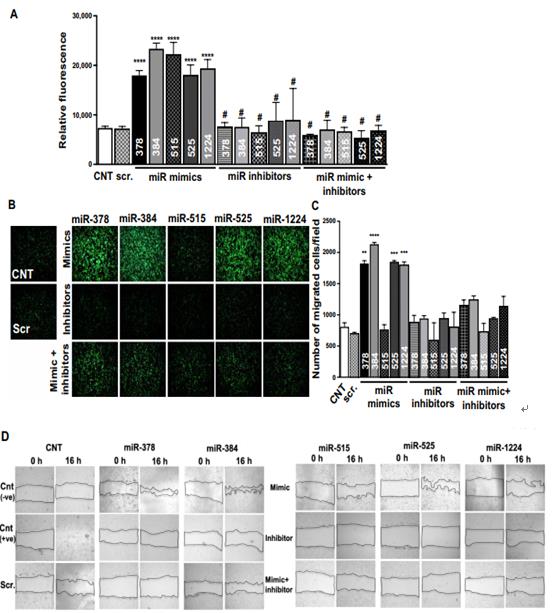
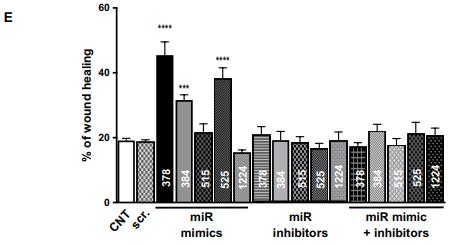
通過計算分析鑒定的 miRNA 的功能作用的驗證。(A)使用 alamarBlue 測定法評估 miRNA 對細胞增殖的影響。如圖所示,用模擬物,抑制劑或模擬物+ miR-378, miR- 384, miR-515, miR-525 和 miR-1224 的抑制劑轉染 HMEC。(B 和 C) Transwell 遷移測定圖像和定量評估用模擬物,抑制劑或模擬物+ miR-378, miR-384, miR-515, miR-525和 miR-1224 的抑制劑轉染的 HMEC 的遷移潛力。(D 和 E)傷口愈合測定圖像和用模擬物處理的 HMEC 的量化抑制劑,或 miR-378, miR-384 的模擬物+抑制劑,miR 模384仿miR 抑384制劑miR 模仿378384515+抑制劑miR-515, miR-525 和 miR-1224。所有數據都有代表作為平均值±SEM。 * P <0.05, ** P <0.01, *** P <0.001, 和****P < 0.0001.使用單向 ANOVA 分析數據,然后進行 Tukey 分析(A,C 和 E) 。
總之,該研究證明祖細胞特異性外泌體存在于受體循環中并且可以非侵入性地監測。在異種嚙齒動物MI模型中進行了head-to-head比較,以研究來自相同人類心臟活檢的兩個充分研究的祖細胞,CDC和CPC的心臟修復潛力。驗證了干/祖細胞特異性外泌體的監測潛力,并證明外泌體miRNA反映了移植干細胞的功能性心肌修復。這些發現證明了循環中祖細胞特異性外泌體作為液體活檢的潛力,其為移植細胞的狀態提供了非侵入性監測的方案。這些數據揭示了細胞特異性外泌體對同種異體細胞療法的監測潛力。






