外泌體在神經系統發育的作用
外泌體被認為是體內所有細胞釋放并參與細胞間通訊的小囊泡,盡管有證據表明神經元和其他類型細胞在大腦中分泌的外泌體具有神經生物學作用,但它們在人類神經回路發育功能上很大程度上尚未開發。近日,綜合性期刊PNAS發表了一篇題名為:Exosomes regulate neurogenesis and circuit assembly的文章。文章結果表明外泌體攜帶調節神經回路發育所需的信號信息。

一、外泌體增加發育神經細胞的細胞數量
為了驗證外泌體在神經元發育中發揮生理作用的假設,外泌體的來自誘導多能干細胞(hiPSC)的神經培養物。WB分析表明,純化的外泌體含有典型外泌體標記。電子顯微鏡顯示的外泌體具有典型的形狀,大小范圍為30-200nm; 約60%的外泌體在40和80nm之間。通過EdU檢測外泌體對人類原代神經培養物中的增殖的影響。外泌體用熒光膜標記物標記,觀察外泌體是否定位受體細胞。與對照組相比,外泌體處理的培養物中細胞數量有統計學意義的顯著增加。
二、外泌體增加小鼠齒狀回的體內增殖
作者測量出生后P4小鼠齒狀回GCL中的神經增殖,測試外泌體是否在體內具有生物活性并且可以在神經回路中影響細胞增殖,其中顆粒細胞增殖在出生后早期持續。收獲嚙齒類DIV9原代神經培養物的外泌體并將其注射到P4小鼠的側腦室,對照組注射蛋白酶K處理的外泌體。然后注射給予EdU(25mg/kg)。24小時后處理小鼠大腦,用DAPI,Nestin和EdU標記。小鼠DIV19外泌體注入EdU+細胞有顯著增多。這些數據表明,外泌體在體內顯示出生物活性,增加神經細胞增殖,類似于它們在神經培養中的作用。
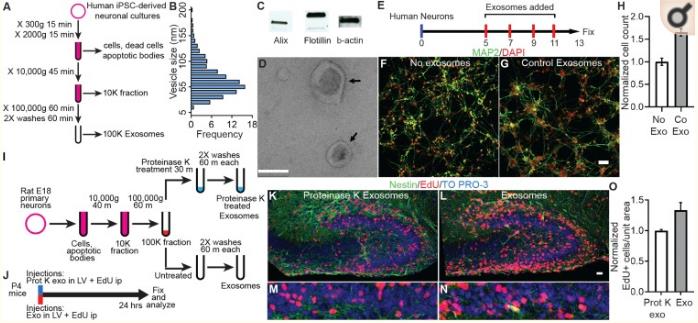
三、蛋白質組學分析表明外泌體含有缺乏MECP2的信號蛋白
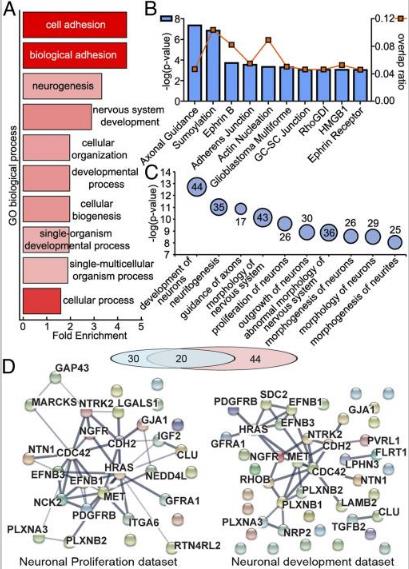
為了探索蛋白質可能參與神經回路發育中的外泌體細胞間信號傳導能力的想法,分析了外泌體的蛋白質組,其中單個蛋白MECP2的功能性損傷對大腦發育具有破壞性影響。比較雄性個體的供體hiPSC衍生神經培養物的外泌體,其中MECP2蛋白完全不存在(MECP2LOF),對照組hiPSC衍生的神經培養物,使用CRISPR / Cas9技術校正MECP2突變(isoCONTROL)。結果表明,hiPSC衍生的神經培養物釋放的外泌體富含影響神經元發育和功能的蛋白質。它們包含對蛋白質翻譯,軸突指導,整聯蛋白信號,肝配蛋白信號傳導和細胞骨架調節信號傳導組分,進而影響下游功能,例如軸突形成,發展,形態發生和神經元的增殖,和突觸發育和功能。在MECP2LOF和isoCONTROL外泌體2,572種蛋白質中,237種在MECP2LOF和isoCONTROL樣品之間具有1.5倍或更大倍數差異。使用GO和KEGG進行數據富集分析,結果表示主要集中在神經系統的發育和神經發生。軸突引導,肝配蛋白信號傳導和肌動蛋白動力學差異最顯著。進一步分析預測參與神經元增殖的30種蛋白質的數據集和預測參與神經元發育的44種蛋白質的數據集。2個數據集之間存在重疊,與注釋的蛋白質一致,在神經元增殖和發育中發揮功能。這些定量蛋白質組學和生物信息學分析表明,外泌體含有在復雜功能信號網絡中相互作用的蛋白質,這些蛋白質被MECP2突變顯著改變。使用WB測試在從供體MECP2LOF培養釋放外泌體特異性蛋白質的改變。MECP2LOF和isoControl外泌體之間的物質差異在很大程度上與其細胞表達無關。盡管HRAS和Alix在isoCONTROL和MECP2LOF細胞裂解物中顯示出相似的水平,但與外泌體中的isoCONTROL相比,MECP2LOF中的Alix降低且HRAS未改變。與isoCONTROL相比,使用MECPLOF的Flotillin,Cadherin 2,Calmodulin 1,GAP43和L1CAM顯示出更高的蛋白質水平。相反,Flotillin和GAP43在MECP2LOF外泌體中減少,而鈣粘著蛋白2和L1CAM沒有變化。這些結果表明,MECP2功能喪失導致外泌體中特定的蛋白質改變,并且外泌體蛋白質不僅僅是細胞改變的復制品。外泌體貨物差異包裝的機制尚未闡明。
四、控制組外泌體增加增殖和神經元分化,而MECP2LOF外泌體沒有作用
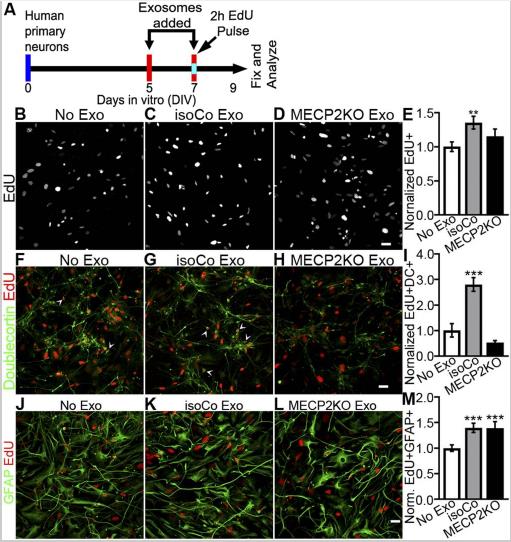
蛋白質組學分析預測MECP2LOF和對照外泌體可能對細胞增殖和神經元分化具有不同的作用。為了驗證這些假設,處理的受體的人原代神經培養物與來自MECP2LOF外泌體或對照供體培養物。在DIV 7上,培養物在添加外泌體之前接受10μMEdU的2小時孵育。與無外泌體處理相比,isoCONTROL外泌體處理使EdU標記的子代顯著增加,而用MECP2LOF外泌體處理與單獨添加培養基相當。這些數據表明,對照外泌體促進了NPC增殖和EdU標記后代的存活,而這些增殖和存活信號在MECP2LOF外泌體中缺乏,與我們的蛋白質組學數據分析一致。
接下來研究響應外泌體處理產生的細胞是否分化成神經元,我們用EdU孵育,然后用雙皮質素(DC)對培養物進行免疫標記,以鑒定星形膠質細胞。與對照組相比,isoCONTROL外泌體處理使EdU+DC+雙標記神經元顯著增加,而MECP2LOF外泌體處理不影響EdU+DC+雙標記的神經元數目。與單獨添加培養基相比,isoCONTROL和MECP2LOF外泌體處理均增加了EdU+GFAP+雙標記的星形膠質細胞數目。這些結果表明,isoCONTROL外泌體可增強神經元的增殖并擴展神經元庫。盡管MECP2LOF和對照組外泌體具有增強星形膠質細胞形成的等效能力,但MECP2LOF外泌體缺乏影響神經元的信號。這些結果與蛋白質組學數據分析一致,可預測外泌體物質的神經源性作用,證明了在Rett綜合征小鼠模型中星形膠質細胞向神經元的非細胞自主信號傳導的有益作用。
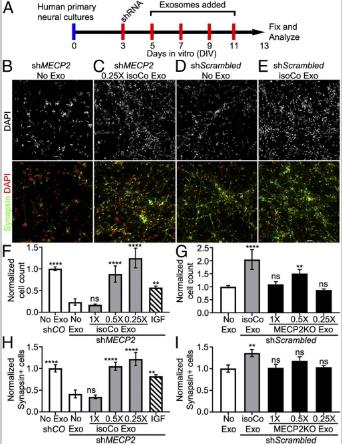
五、isoCONTROL外泌體恢復MECP2敲減神經細胞中的神經元數量。
MECP2 shRNA或對照組慢病毒添加到人原代神經培養物DIV 3, isoCONTROL外泌體孵育。將純化的外泌體連續倍比稀釋至0.5x和0.25x相對濃度測試isoCONTROL外泌體對MECP2敲低培養物的影響,研究劑量與生物活性的關系。將培養物固定在DIV13上并用神經元標記物Synapsin和DAPI進行免疫標記。使用胰島素樣生長因子1(IGF1)作為陽性對照。沒有外泌體,MECP2KD與SH相比,總細胞數和神經元數下降。盡管1×劑量的對照外泌體無效,但與IGF處理的部分恢復相比,0.5×和0.25×劑量產生完全恢復。用對照sc Scrambled病毒處理神經培養物,添加從hiPSC衍生的神經供體培養物中收獲的MECP2LOF外泌體。將1×原液連續稀釋至0.5×和0.25×來測試3劑MECP2LOF外泌體。將培養物固定在DIV13上并用Synapsin和DAPI免疫標記以分別確定神經元和總細胞的數量。與單獨添加培養基相比,用isoCONTROL外泌體處理增加了總細胞數和神經元數量,外泌體MECP2LOF沒有表現出對總細胞數或神經元的數目產生不利的影響。與此相反,在0.5×劑量MECP2LOF外泌體與對照培養物相比,增加了總細胞數。結合蛋白質組學分析,結果表明,isoControl外泌體含有可能根據劑量和受體細胞狀態而具有不同結果的信號通路,MECP2LOF外泌體缺乏增加神經元分化的信號。
六、對照組外泌體處理增加hiPSC衍生的神經元中的突觸密度
與對照組神經元相比,人神經元培養物中的MECP2敲低降低了突觸和活動驅動的鈣變。并驗證同基因對照組外泌體是否具有拯救這些突觸和回路缺陷的能力。將MECP2LOF hiPSC衍生的NPC分化為成熟的6周齡神經培養物,并在8天內用1×或0.25×劑量的對照組外泌體處理培養物。在外泌體處理后,將培養物固定并用MAP2標記神經元和Synapsin1標記突觸前斑點。與沒有外泌體處理的培養物相比,用低劑量對照組外泌體處理的神經培養物具有顯著更高的斑點密度。這表明在可見突觸密度的增加可能是由于低強度斑點的增加引起的。這些數據表明對照外泌體增加了MECP2LOF hiPSC衍生的神經培養物中的突觸發生。
使用多電極陣列(MEA)測量網絡中的神經元活動和連通性。為了測試外泌體處理是否影響電路發育,我們分析了用對照組外泌體處理的神經球中的神經元放電與MECP2LOF外泌體孵育相比,其似乎對神經元分化沒有有害影響。神經球用外泌體處理4次以上,并評估了MEA的活動。結果顯示用MECP2LOF外泌體處理的神經球中的神經元放電是稀疏的并且跨電極的活性不同步。相比之下,用對照組外泌體處理增加了MECP2LOF神經球中的神經元活性。用對照組外泌體處理的神經球比用MECP2LOF外泌體處理的神經球具有更多的通道活性和更多的活性通道。此外,與用MECP2LOF外泌體處理的神經球相比,用對照組外泌體處理的神經球中的多個通道的更多同步活性,表明對照組外泌體處理增加MECP2LOF神經球中的神經元和網絡活性。總之,這些結果表明,對照組外泌體處理能夠增加突觸前的斑點密度并增加神經回路中的活性。

總結
作者的數據證明神經外泌體具有細胞間信號傳導生物活性,其在神經發育疾病模型中具有功能性影響。此外,結果顯示外泌體能夠逆轉MECP2突變體神經元中觀察到的一些病理表型,表明外泌體可能在腦疾病中具有治療應用。






