重磅:Nature揭示H3K36me3介導轉錄過程中RNA m6A修飾
近期,m6A修飾領域大牛在nature上發表了關于RNA上m6A修飾時如何添加到特定部位的研究結果(doi: 10.1038/s41586-019-1016-7)。小編在這分享給大家,一定能對大家的研究有所幫助。
m6A是真核生物mRNA上的一種最常見的修飾,越來越多的研究揭示了m6A在mRNA穩定性、翻譯,以及在細胞分化、胚胎發育、應答等過程中發揮著重要作用。m6A主要集中于含RRACH的motif上,而且主要分布于CDS和3’UTR區域。雖然體外實驗中,METTL3–METTL14甲基轉移酶能識別該motif,但體內只有部分motif上存在m6A,而且分布區域存在特異性。因此作者提出問題:體內特定轉錄本和位點的m6A修飾是如何調控的?
通過比較m6A與各種類型的組蛋白修飾的分布情況,作者發現H3K36me3與m6A的分布存在69.2%的重合(圖一)。同時,在不同組織和細胞系中,SETD2(注:H3K36me3主要甲基轉移酶)和METTL3、METTL14及WTAP的mRNA水平呈現正相關。因此作者猜想二者存在聯系。
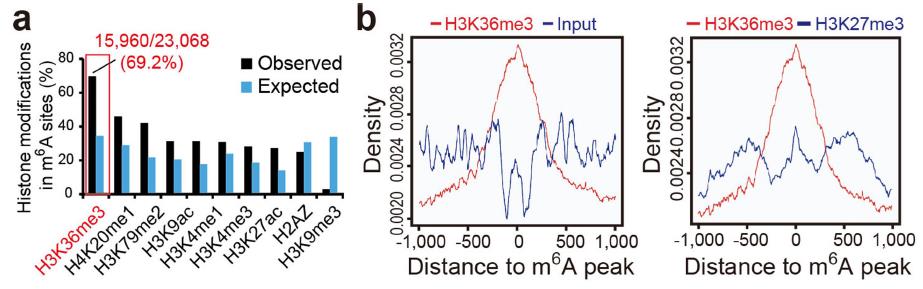
圖1 m6A與常見組蛋白修飾分布重合分析結果
通過敲除SETD2或過表達KDM4A降低細胞內H3K36me3水平后,細胞內總RNA和poly-A RNA上的m6A修飾水平也顯著降低;該降低效果與單獨敲除各m6A甲基轉移酶的作用一致(圖2a)。小鼠模型也得到同樣的結果。在SETD2敲除細胞中回復過表達SETD2可以回復H3K36me3和m6A水平(圖2b)。反過來,敲低m6A甲基轉移酶復合物(the m6A methyltransferase Complex, MTC)成員后對H3K36me3整體水平無顯著影響。
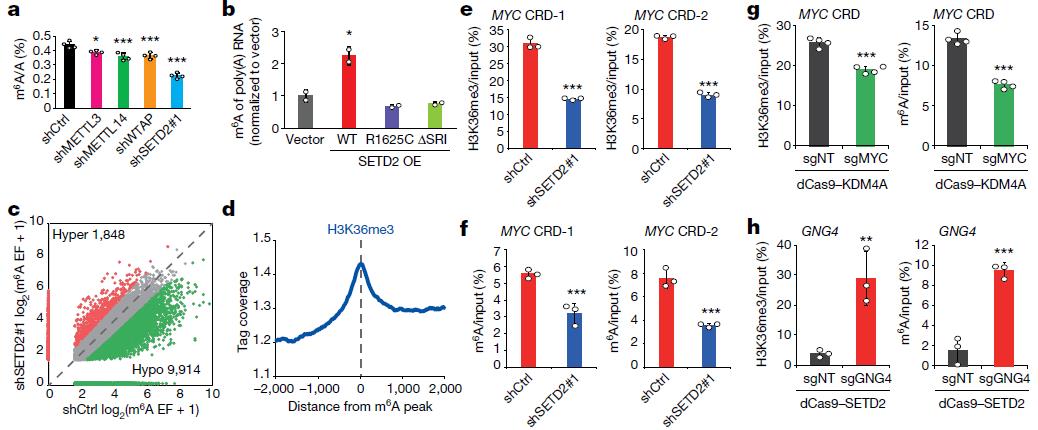
圖2 H3K36me3影響m6A水平
m6A-seq和H3K36me3 ChIP-seq結果顯示了二者分部有顯著的相關性。在SETD2敲除后,H3K36me3下降的區域中約有50%區域的m6A水平也顯著下降。而KDM4A(H3K36me3主要去甲基化酶)過表達后,也是同樣的表型。接下來作者通過核酸酶活性突變的Cas9蛋白融合表達SETD2和KDM4A,然后使用sgRNA導向特異位點實現該位點的H3K36me3改變。在原本無H3K36me3修飾的位點特異性的導入SETD2并上調H3K36me3后,該位點轉錄的mRNA上的m6A修飾也從無法檢測變為顯著上升;而導入KDM4A的結果則相反。這些結果
進一步說明了H3K36me3能上調進該部位轉錄本的m6A水平。
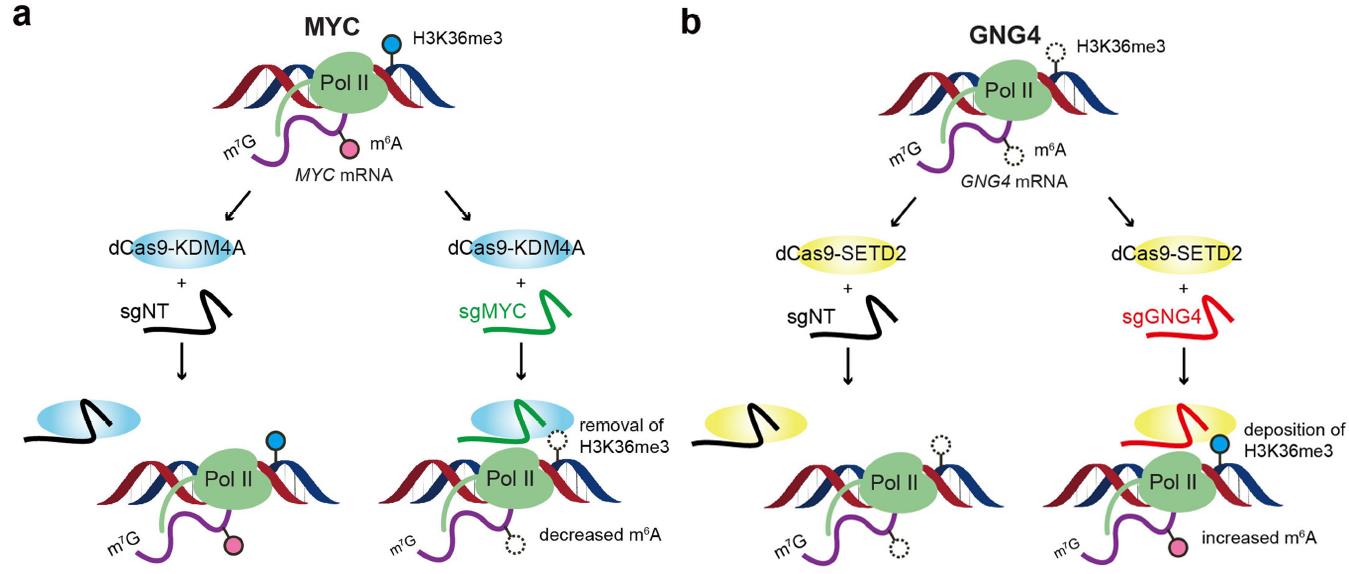
圖3 位點特異修飾H3K36me3能調節對應m6A水平
敲低SETD2后,作者檢測到MTC與其靶向mRNA的結合能力顯著降低;而MTC基因的表達和蛋白間相互作用沒有收到影響。因此作者推測H3K36me3能夠招募MTC至相應部位。作者進一步研究發現H3K36me3能直接與MTC結合,而且不依賴于RNA或DNA。而且MTC只特異性的結合H3K36me3,而不結合H3K36me1和H3K36me2。MTC中,METTL14負責識別H3K36me3。那這種識別是否是直接相互作用呢?作者沒有發現已知的H3K36me3 reader能與METTL14相互作用,但在體外實驗中作者檢測到了H3K36me3和METTL14之間的直接相互作用。截斷實驗也進一步分析了METTL14識別H3K36me的核心區域。如圖4所示。
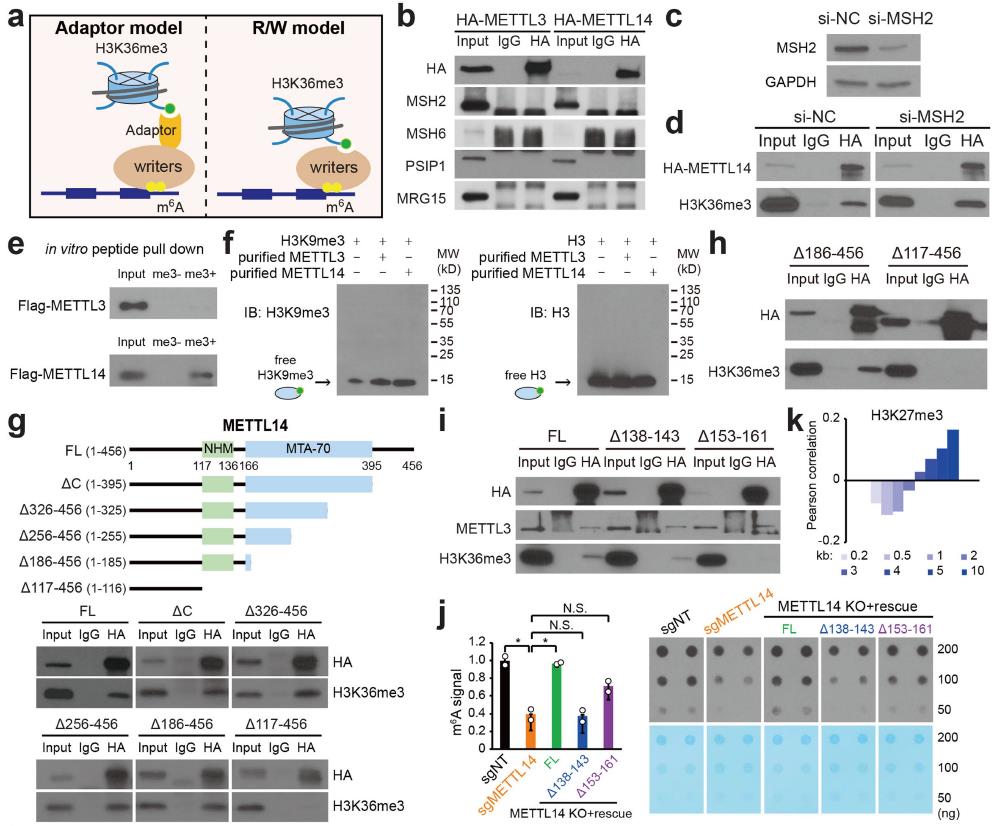
圖4 METTL14與H3K36me3作用機制研究
既然METTL14能結合H3K36me3,那它是否與染色質結合呢?作者使用HA標簽抗體通過ChIP-seq檢測了METTL14在染色質上的定位,而這一分布與H3K36me3有顯著的相關性。而PAR-CLIP檢測METTL14在RAN上的分布也于該結果一致。如圖5所示。
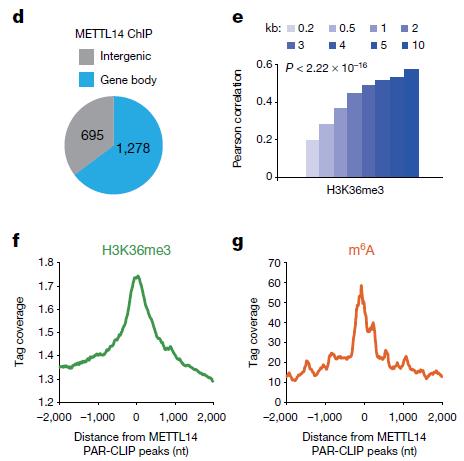
圖5 METTL14和染色質和RNA定位與H3K36me3和m6A相關性分析
文獻報道中,H3K36me3參與的功能較多,其中包括轉錄延伸。作者探討了POII S2P在METTL14調節這一過程中的作用。最后得出結論:METTL14能直接識別和結合H3K36me3而不依賴于POII S2P,進而在POII介導的轉錄延伸過程中直接甲基化新生RNA(圖6)。最終,作者在胚胎干細胞的更新和分化過程中探究了這一分子機制的生物學意義。通過敲低SETD2降低H3K36me3水平后,胚胎干細胞中m6A水平和分化狀態都顯著下降。
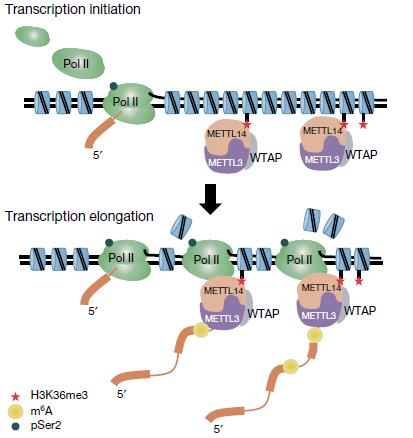
圖6 METTL14在轉錄過程中識別H3K36me3并催化m6A模式圖
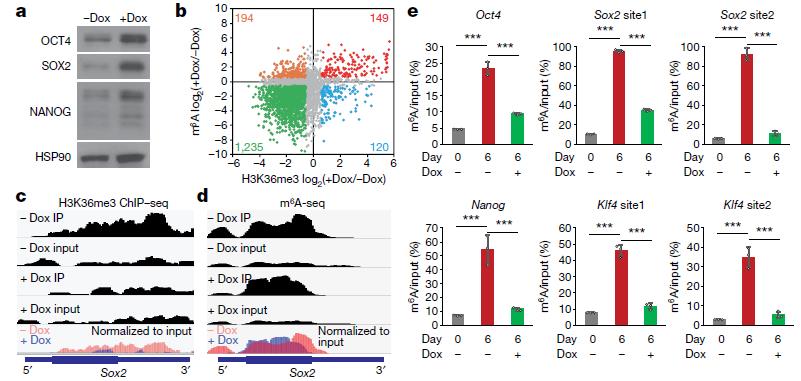
圖7 下調H3K36me3能減少m6A水平和抑制小鼠胚胎干細胞分化
該研究不僅系統地揭示了m6A主要分布于CDS和3’UTR區域的分子機制,更是發現了染色質上的組蛋白修飾與RNA上的修飾存在調節關系。這為我們研究基于表達調控提供了新的思路。






