科研者必帶武器-pull down 技術
作為生命活動的主要承擔者,蛋白質參與各類生命現象,大部分蛋白質在行使功能的時候并不是單打獨斗的,蛋白質們相互聯系一起工作,彼此形成了復雜的生化網絡。因此,研究蛋白質的相互作用成為研究蛋白質功能和作用機制的最為重要的環節之一。蛋白-蛋白互作的各類研究技術方法層出不窮。這里,小編來淺談下蛋白質相互作用技術中一種比較經典的實驗技術- pull down 實驗。
pull down 實驗又叫做蛋白質體外結合實驗(binding assay in vitro),是一個行之有效的驗證酵母雙雜交系統的體外試驗技術。用固相化的、已標記的餌蛋白或標簽蛋白(生物素-、PolyHis-或GST-),從細胞裂解液中釣出與之相互作用的蛋白。帶標簽的誘餌蛋白能被特異結合該標簽的固相親和配基捕獲,形成次級親和支持物”,用于純化與誘餌蛋白相互作用的其他蛋白。純化產物洗脫后,經Western blot驗證或LC-MS/MS,即可證明或鑒定與誘餌蛋白互作的蛋白。
這里,小編重點介紹下應用最廣泛的GST - pull down。其利用了GST(Glutathione S transferase)對GTH(Glutathione)的親和性,將靶蛋白-GST融合蛋白親和固化在GTH親和樹脂上,作為與目的蛋白親和的支撐物,充當一種“誘餌蛋白”,當蛋白溶液通過層析柱或與此固相復合物混合時,可從中捕獲與之相互作用的“捕獲蛋白”,洗脫結合物后可通過SDS-PAGE電泳分析,從而證實兩種蛋白間的相互作用或篩選相應的目的蛋白。“誘餌蛋白”一般采用原核表達獲得,“捕獲蛋白”可通過細胞裂解物、純化的蛋白、表達系統以及體外轉錄翻譯系統等方法獲得。
實驗流程:
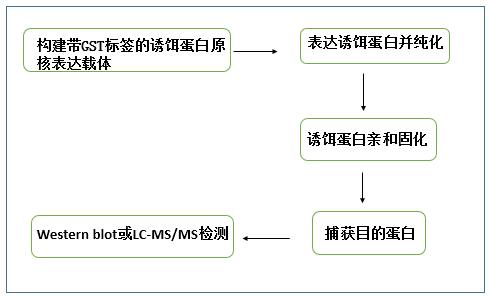
應用:通過GST融合蛋白pull-down技術一是鑒定能與已知融合蛋白相互作用的未知蛋白質;二是鑒定兩個已知蛋白質之間是否存在相互作用。
高準確性,高靈敏度。適合中度復雜的蛋白質樣品,如相互作用的蛋白質條帶和洗脫液;
Tips:
1.若要驗證某蛋白X與誘餌蛋白的相互作用,可將蛋白復合物與X蛋白的抗體孵育,做Western blot驗證即可;如要尋找誘餌蛋白可能的互作蛋白,則需將蛋白復合物做LC-MS/MS鑒定。
2.高純度的GST融合蛋白能夠減少實驗的假陽性。為了能夠最大程度的保證融合蛋白原有的生物學活性,一般在獲取融合蛋白時傾向于獲取可溶性融合蛋白。(獲得條件主要有:載體的選擇、可溶性蛋白表達條件的選擇、誘導溫度、誘導時間、誘導物的濃度)
3.內源性蛋白的干擾使得實驗出現的假陽性結果較多。關于實驗設計,需要嚴謹,對照的設計,實驗重現性,bait-prey 的互換等等都需要在做實驗之前認真探討和考慮。
4. 實驗一般用于體外轉錄或翻譯體系,如酵母雙雜交系統中檢測蛋白質之間的相互作用。但并不一定能真實的反應蛋白質之間的相互作用,因為在體內它們不一定空間上有碰到,所以并不意味著在生理條件下一定結合。
Pull down技術研究蛋白互作的方法不僅強大,而且高效快速,操作簡便,可直接檢測是否具有相互作用。這項實驗技術有利有弊,但不可否認的是,它一定是科研者必帶武器,權衡使用一定能幫助大家的科研之路越來越順利。






