circTRIM33-12與肝細胞癌之間的聯系大揭秘
近年來,環狀RNA(circRNA)在包括肝癌在內的癌癥的發生過程中發揮著重要的調控作用。然而,大多數環狀RNA在肝細胞癌(HCC)中的作用仍不清楚。
今天小編帶大家了解近期發表于Molecular Cancer上的一篇關于環狀RNA circTRIM33-12通過海綿化MiR-191抑制肝癌的發展的文章Circular RNA circTRIM33-12 acts as the sponge of MicroRNA-191 to suppress hepatocellular carcinoma progression。

肝細胞癌是全球癌癥相關死亡的第三大原因。HCC的臨床特點是侵襲性強,預后差,治療機會有限。目前肝細胞癌最常見的治療方式是手術治療,但多焦點發展和遠處轉移的特點使大多數肝細胞癌不能手術治療;因此,進一步了解HCC發展的分子機制至關重要。本文通過一系列實驗評估了circTRIM33-12在HCC發展中的作用,進而證明環狀RNA circTRIM33-12通過海綿化MiR-191抑制肝癌的發展。
技術路線:
研究者的實驗思路如下:

結果:
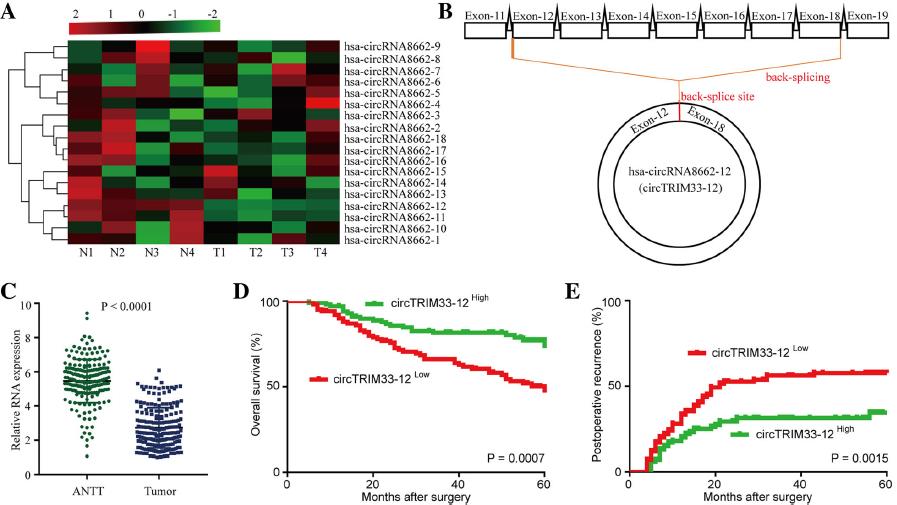
1.TRIM33來源的circTRIM33-12在HCC中的調節
TRIM33是一種腫瘤抑制因子,可以通過不同的機制抑制包括HCC在內的多種癌癥的腫瘤細胞進展和腫瘤發生。先前研究報道TRIM33在HCC中的下調是由TRIM33啟動子CpG的高甲基化引起的,表明circRNA來源的TRIM33在HCC細胞中表達可能下調。因此,我們推測來源circRNA的TRIM33有可能在HCC細胞中發揮抑癌作用。為了研究TRIM33來源的circRNA在HCC組織中的表達,我們使用qRT-PCR分析了四對HCC組織樣本。我們發現,在18個circRNAs中,有4個HCC腫瘤組織中circTRIM33-12的表達顯著且持續下降(圖1a)。因此,我們將重點放在circTRIM33-12(circRNA源自TRIM33的12和18外顯子)的表達和作用上(圖1b)。為了進一步探討circTRIM33-12在HCC患者中的表達對預后的影響,我們使用qRT-PCR對200例HCC及鄰近組織中circTRIM33-12的表達水平進行了定量分析(圖1c)。結果顯示,與來自同一患者的鄰近組織的circTRIM33-12表達水平相比,58%(116/200)的HCC組織的circTRIM33-12表達水平顯著降低。選取200例HCC組織中circTRIM33-12的中間相對表達量作為腫瘤分離的分界點。Kaplan-Meier生存分析顯示,circTRIM33-12表達水平低的患者臨床預后較差(圖1d和e)。這些數據提示HCC細胞中circTRIM33-12表達的減少與患者預后不良有關,提示circTRIM33-12表達的減少可能參與了HCC的進展。
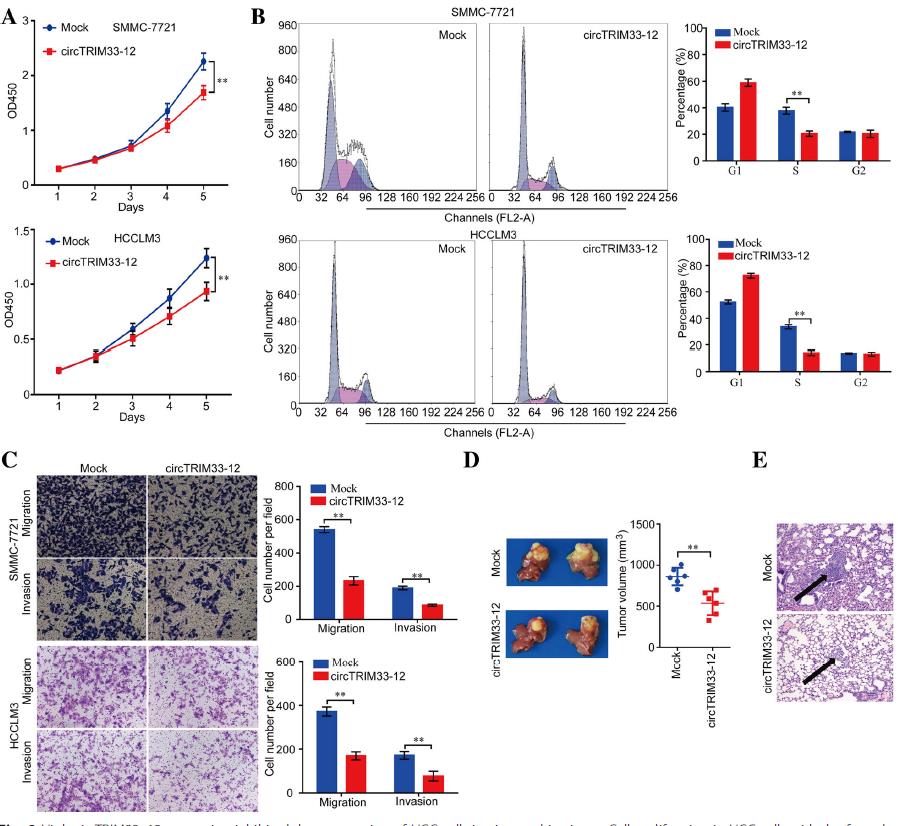
2.circTRIM33 12抑制肝癌細胞的增殖和侵襲
接下來,研究circTRIM33-12在HCC進展中的生物學功能。CCK-8測定、細胞周期實驗、遷移和侵襲實驗顯示,過表達circTRIM33-12后,SMMC-7721和HCCLM3細胞的生長和轉移受到顯著抑制(圖2a-c)。為了進一步探討circTRIM33-12在體內的作用,我們應用過表達circTRIM33-12 的SMMC-7721細胞和模擬對照細胞建立原位植入肝內HCC模型。circtrim33-12過表達組與模擬對照組相比,SMMC-7721異種移植原位生長4周后,腫瘤的規格更小(圖2d)。與這些預期一致,與SMMC-7721異種移植的模擬對照組相比,circtrim33-12過表達組的肺組織轉移結節減少(圖2e)。
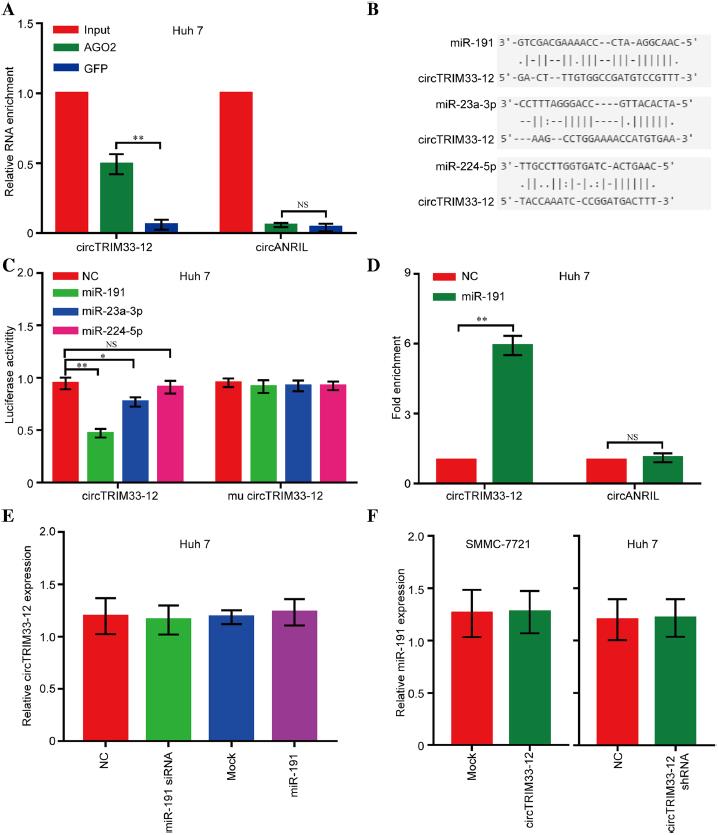
3.circTRIM33-12可以通過海綿化miR-191發揮作用
鑒于環狀RNA已被證明在癌細胞中充當miRNA海綿的作用,我們探討了circTRIM33-12是否能在HCC進展中與某些miRNA結合。
首先,我們用抗AGO2抗體在Huh 7細胞中進行RIP。結果顯示,環狀RNA circTRIM33-12被AGO2抗體顯著富集(圖3a),表明circTRIM33-12可能是AGO2與miRNAs結合的平臺。接下來,我們使用StarBase v2.0目標預測工具找到11個可能與circTRIM33-12結合的miRNAs。根據最近的研究,這些miRNAs中有3個作為致癌基因,包括miR-23a-3p、miR-191和miR-224-5p。為了進一步鑒定與circTRIM33-12結合的miR-23a-3p、miR-191和miR-224-5p,我們構建了含有熒光素酶基因的circTRIM33-12表達質粒載體,并將質粒載體轉染到Huh 7細胞中。轉染后,我們觀察到3個miRNAs,尤其是miR-191,熒光素酶活性水平降低(圖3b和c)。此外,使用生物素標記的miR-191模擬物進行的pull-down實驗結果顯示,與陰性對照相比,circTRIM33-12顯著富集(圖3d)。然而,在HCC Huh 7細胞中miR-191模擬表達增加或減少后,circTRIM33-12并沒有顯示出明顯的變化(圖3e),而在HCC SMMC-7721或Huh 7細胞中,當circTRIM33-12表達被強制表達或敲除后,miR-191均未表現出顯著變化(圖3f)。這些結果表明,circTRIM33-12和miR-191可能不會相互降解。這些實驗表明circTRIM33-12可能通過海綿化miR-191發揮作用。
4.circTRIM33 12通過海綿化miR-191上調TET1表達
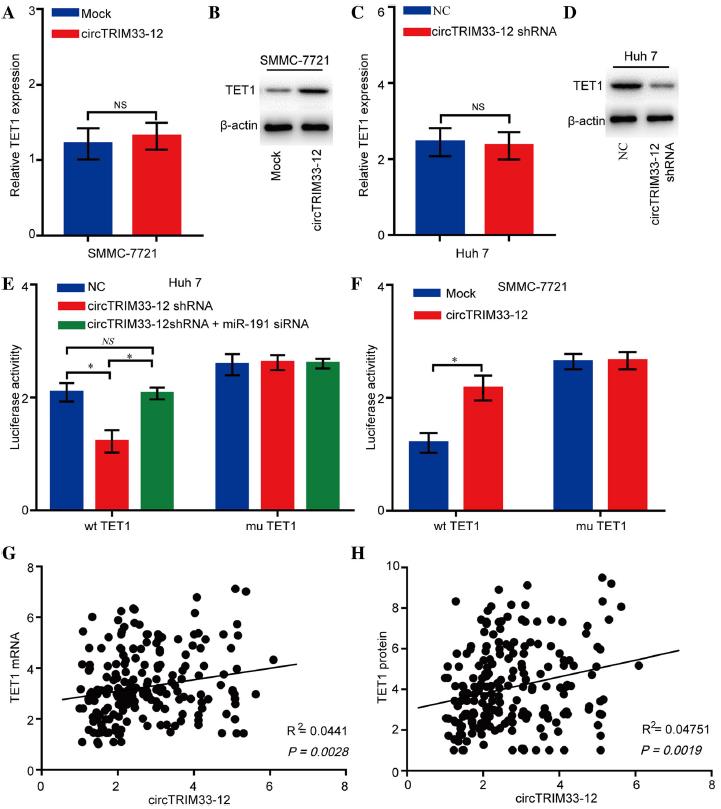
已有研究報道miR-191在人類癌癥中直接靶向多種基因,包括TET1、TIMP3、SATB1和DIECR1。然而,我們沒有檢測到這些mRNAs在轉染miR-191模擬物的Huh 7細胞或轉染miR-191 siRNA的SMMC-7721細胞中顯著表達。有趣的是,除了TET1蛋白的表達外,我們也沒有檢測到在miR-191過表達/敲減細胞中這些蛋白顯著表達。為了進一步證實circTRIM33-12對TET1表達的影響,我們用circTRIM33-12質粒轉染SMMC-7721細胞,用qRT-PCR和western blotting檢測TET1 mRNA和蛋白水平。結果表明,circTRIM33-12的異位表達顯著增加TET1蛋白表達(圖4a和圖4b)。相反,circTRIM33-12的擊倒的顯著降低TET1蛋白質表達(圖4c和圖4d)。熒光素酶活性測定表明,circTRIM33-12的擊倒可以有效降低wt的熒光素酶活性,而miR-191對Huh 7細胞中circTRIM33-12敲除引起的熒光素酶活性的抑制作用可以通過抑制miR-191恢復(圖4e和f)。此外,強迫表達circTRIM33-12可以有效提高wt細胞的熒光素酶活性(圖4f)。最后,我們使用qRT-PCR和IHC檢測了200例HCC患者組織中TET1的表達。在HCC患者中,circTRIM33-12與TET1呈顯著正相關(圖4g和圖h)。
5.circTRIM33 12和TET1負責調控5hmC的表達
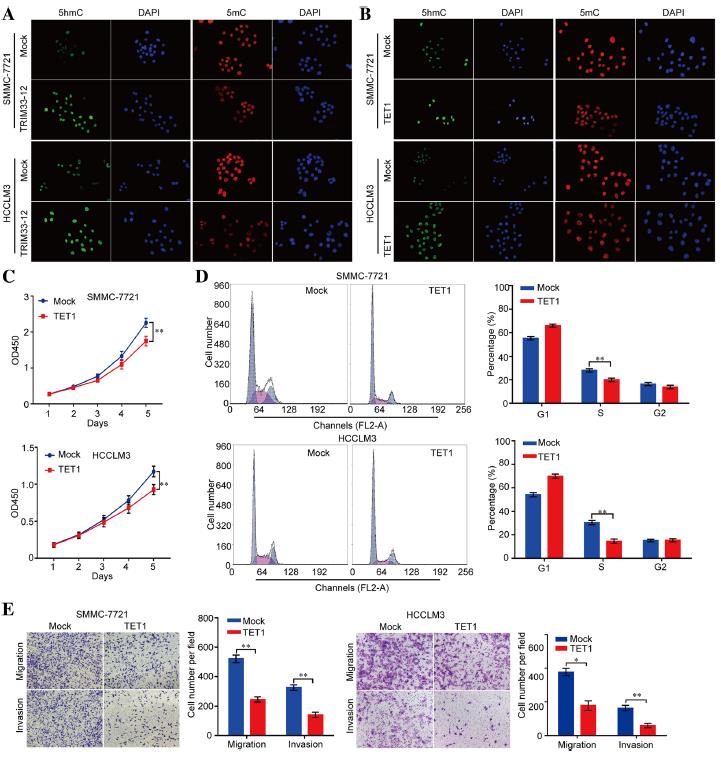
為了檢測改變的circTRIM33-12或TET1表達是否可以在HCC細胞中調控DNA甲基化水平,我們首先比較了mock、circTRIM33-12 或TET1過表達的SMMC-7721和HCCLM3細胞的中的5mC和5hmC表達情況。我們發現在circTRIM33-12和TET1過表達的細胞中5 hmc的表達水平顯著增加(圖5a和圖5b)。生長曲線顯示,與模擬組相比,TET1顯著抑制細胞增殖(圖5c)。此外,在細胞周期實驗中,與模擬組相比,TET1減少了S期的細胞數量(圖5d)。通過體外遷移和侵襲實驗,探討TET1是否抑制腫瘤細胞的遷移和侵襲能力。發現除circTRIM33-12外,與模擬組相比,TET1顯著抑制SMMC-7721細胞的遷移和侵襲(圖5e)。這些數據證明circTRIM33-12可以通過海綿化miR-191抑制HCC進展,從而通過circTRIM33-12 /miR-191/TET1軸抑制miR-191致癌效應。
6.TET1負調控癌基因表達,與免疫逃避有關
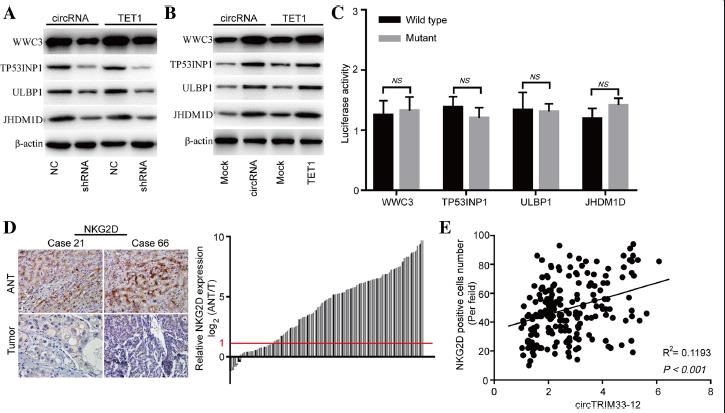
為了研究circTRIM33-12是否通過miR-191/TET1軸發揮其生物學功能,我們檢測了在circTRIM33-12或TET1敲減和過表達的HCC細胞中WWC3、TP53INP1、ULBP1和JHDM1D的表達。結果顯示circTRIM33-12或TET1的沉默均顯著降低了HCC Huh 7細胞中WWC3、TP53INP1、ULBP1和JHDM1D的mRNA和蛋白表達水平(圖6a)。此外,過表達circTRIM33-12或TET1可提高HCC SMMC-7721細胞中WWC3、TP53INP1、ULBP1和JHDM1D的mRNA和蛋白表達水平(圖6b)。為了驗證WWC3、TP53INP1、ULBP1和JHDM1D mRNAs的3 ' UTR是否為miR-191在HCC細胞中的靶基因,我們采用熒光素酶報告基因檢測。將WWC3、TP53INP1、ULBP1和JHDM1D的3 ' UTR序列克隆到熒光素酶報告載體中。miR-191模擬物在3 ' UTR序列轉染的Huh 7細胞中不抑制熒光素酶活性(圖6c)。這些結果表明,在HCC細胞中,WWC3、TP53INP1、ULBP1和JHDM1D mrna并不是miR-191的靶點。
激活受體自然殺傷組2D(NKG2D)及其配體成員在介導癌癥的免疫反應的NK細胞、γδ+ T細胞和CD8+T細胞中發揮重要作用。NKG2D可以識別人類體內八種不同的配體,包括ULBP1。阻止癌癥進展的重要機制之一是對癌細胞的免疫監測,其中NK細胞和CD8+ T細胞起著至關重要的作用。為了進一步探討circTRIM33-12與免疫逃避的關系,我們檢測了200例HCC組織和匹配的非腫瘤組織中NKG2D的表達。與鄰近非腫瘤組織相比,HCC組織中NKG2D陽性細胞數量顯著減少(156/200;2倍)(圖6d)。散點分析顯示circTRIM33-12表達與HCC組織中NKG2D陽性細胞數量呈正相關(R2 = 0.1193;P < 0.001;圖6 e)。這些結果表明circTRIM33-12可能通過海綿化miR-191保護TET1發揮其抗腫瘤作用。
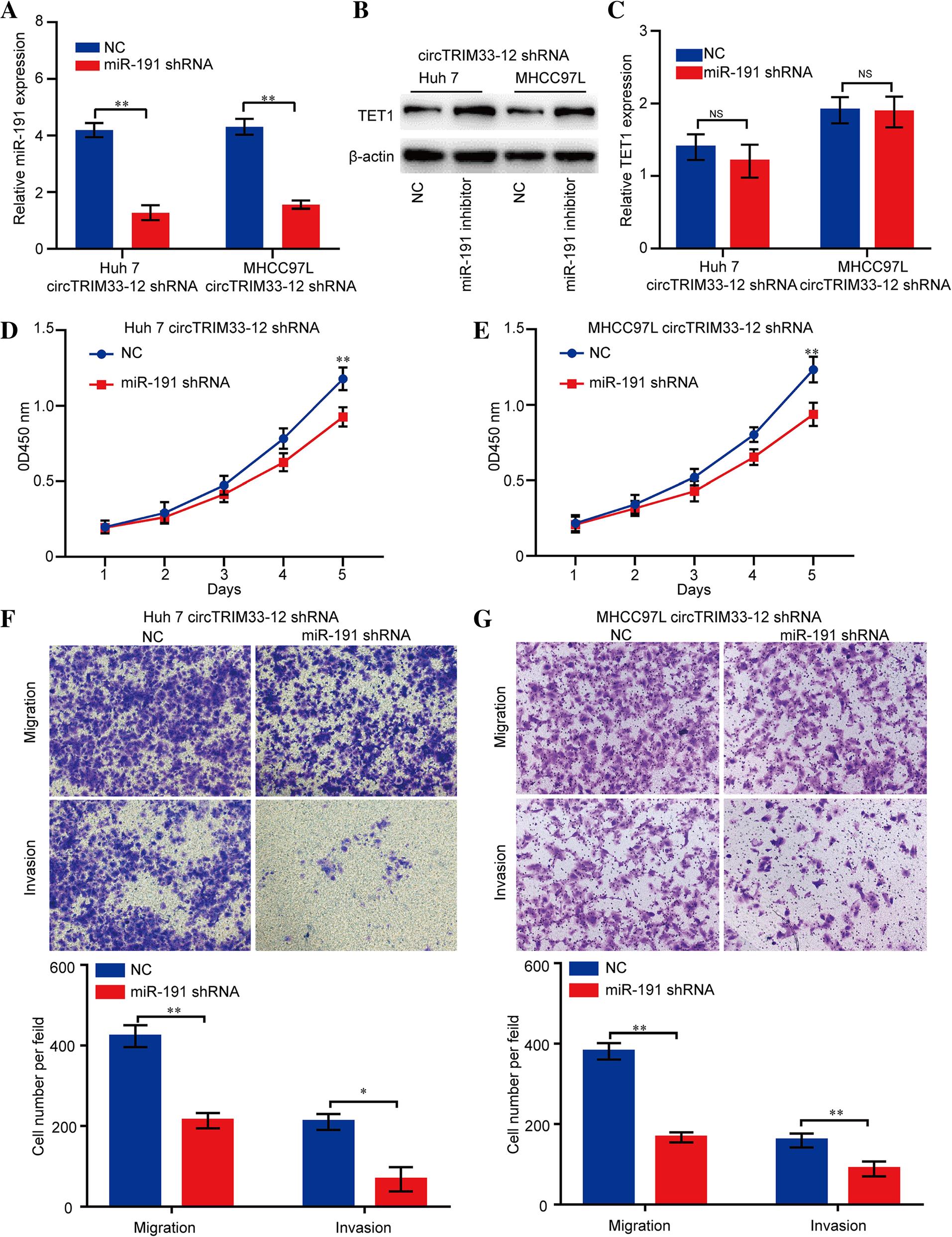
7.miR-191的沉默逆轉了circTRIM33-12的下調,并誘導了HCC細胞的進展
接下來我們探討miR-191的沉默是否影響circTRIM33-12敲減的HCC細胞的增殖、遷移和侵襲。通過qRT-PCR檢測沉默效率(圖7a)。正如預測,miR-191的沉默上調TET1蛋白的表達,但不上調circTRIM33-12敲減的Huh 7 MHCC97L細胞系中mRNA的表達(圖7b和圖7c)。此外,在CCK-8和遷移實驗中,miR-191的沉默顯著抑制Huh和MHCC97L細胞系的增殖、遷移和入侵的能力(圖7d)。總之,這些結果表明,circTRIM33-12通過circTRIM33-12 /miR-191/TET1軸抑制HCC細胞的進展。