外泌體來源的miR-130a通過靶向在血管內皮細胞中的C-MYB激活胃癌的血管生成
遷移是胃癌預后不良的重要原因。血管生成與腫瘤侵襲和遷移密切相關。癌癥來源的外泌體在腫瘤微環境的建立中起重要作用。來自天津醫科大學腫瘤醫院的巴一、應國光團隊在MOL THER(IF=7.008)在線發表了題為“Exosome-Derived miR-130a Activates Angiogenesis in Gastric Cancer by Targeting C-MYB in Vascular Endothelial Cells”。他們通過連續差速離心分離外泌體,并通過透射電子顯微鏡驗證它們。用下游細胞功能實驗評估人類靜脈內皮細胞的生物學行為的變化。通過實時qPCR和蛋白質印跡確定miRNA靶基因的RNA和蛋白質水平。采用小鼠異種移植模型評估外來體衍生的miR-130a與體內腫瘤生長之間的相關性。我們證明外泌體通過在體內和體內靶向c-MYB將miR-130a從胃癌細胞遞送到血管細胞中以促進血管生成和腫瘤生長。包裝在癌細胞分泌的外泌體中的miR-130a可作為血管生成的驅動因子。因此,miR-130a可能是監測胃癌活性的潛在生物標志物。此外,抑制這些外泌體的表達或阻斷其傳播可能是一種新的胃癌抗血管生成治療策略。
技術路線:
主要結果:
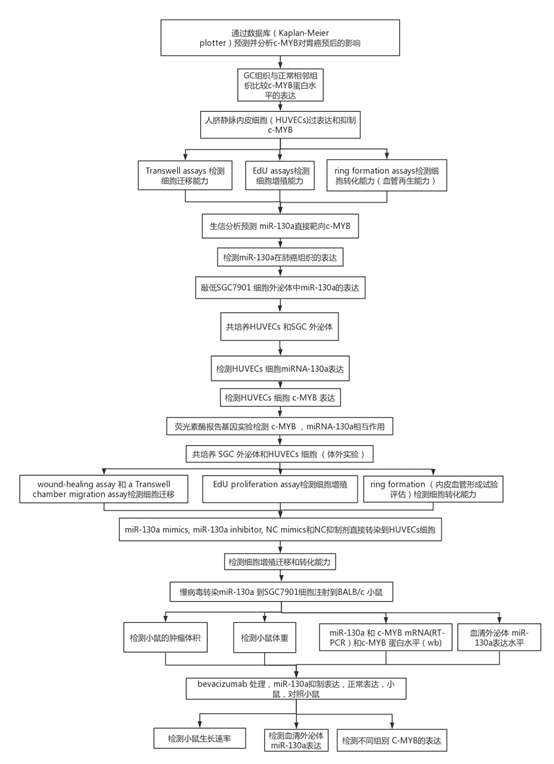
1 C-MYB表達水平與胃癌預后呈正相關,與正常的癌旁組織相比,C-MYB蛋白在胃癌組織中下調,與對照組相比,過表達c-MYB的HUVEC表現出降低的遷移,增殖和血管再生能力。 然而,MYB siRNA轉染組中增強了HUVEC的生物學能力。c-MYB是作為miR-130a的預測的直接靶標,并且miR-130a在GC組織中上調。
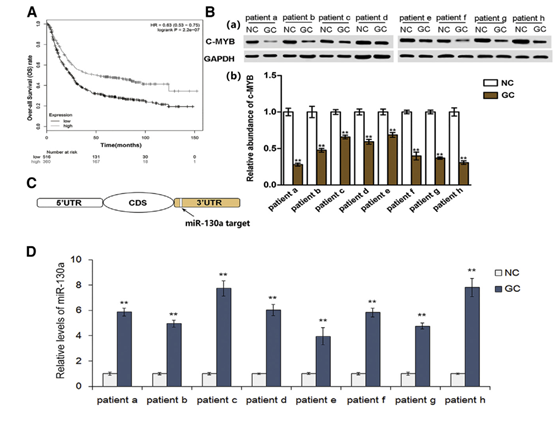
圖1
(A)與c-MYB表達相關的GC的存活曲線。 p <0.001。 (B)蛋白質印跡分析(a)GC組織中c-MYB表達(n = 8)和相應的定量分析(b)。 (C)預測c-MYB mRNA的30UTR內miR-130a的結合位點。 (D)GC組織中miR-130a水平的qRT-PCR分析(n = 2)。 ** p <0.01。
2 外泌體將miR-130a轉運到HUVECs并抑制c-MYB表達。
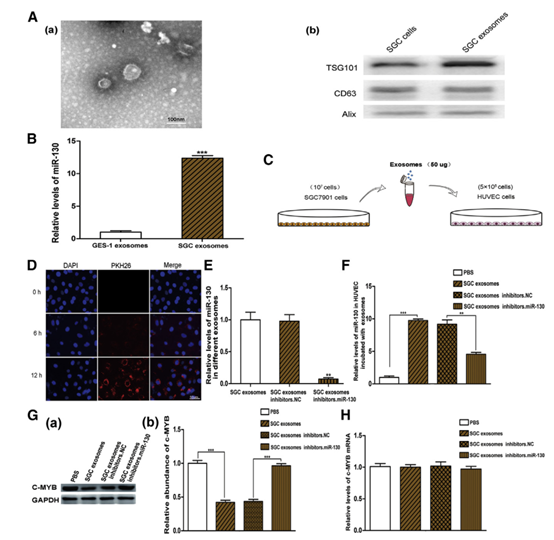
圖2
(A)電子顯微鏡掃描(a)外泌體分離的7901細胞和蛋白質印跡分析(b)外泌體富集蛋白CD63和miRNA功能的關鍵蛋白,TSG101和Alix(n = 3)。 (B)通過qRT-PCR分析(n = 3)測定從GES-1細胞和SGC 7901細胞分離的外來體中miR-130a的水平。 (C)實驗設計的示意圖。 (D)HUVEC中熒光標記的外泌體內化的共聚焦顯微鏡圖像。(E)分別在SGC外泌體,miR-130a敲除外泌體和NC外泌體中的miR-130a的qRT-PCR測定(n = 3)。 (F)通過qRT-PCR檢測用不同外泌體預處理的HUVEC中的miR-130a水平(n = 3)。 (G)分別用SGC外泌體,miR-130a敲除外泌體和NC外泌體處理的HUVEC中的C-MYB表達(a),以及相應的定量分析(b)。 (H)用不同外泌體(n = 3)處理的HUVEC中c-MYB mRNA的相對水平。
3 c-MYB是miR-130a的直接靶標。
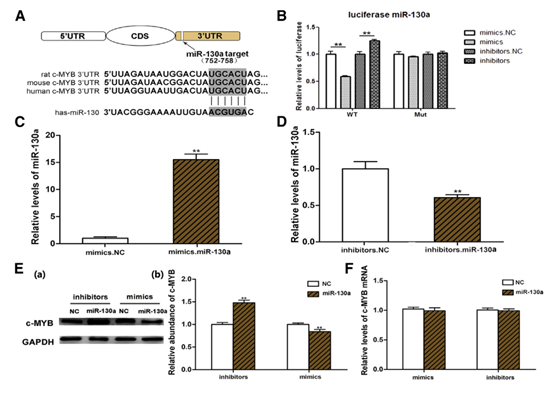
圖3
(A)在c-MYB mRNA的3’UTR內預測的miR-130a的結合位點。 (B)miR-130a直接識別c-MYB 3 ’UTR。 (C和D)qRT-PCR分析用miR-130a類似物(C)(n = 3)和抑制劑(D)(n = 3)轉染的HUVEC的相對miR-130a水平。(E)Western印跡分析( a)用miR-130a類似物和抑制劑(n = 3)處理的HUVEC中的c-MYB表達和相應的定量分析(b)。(F)qRT-PCR分析用miR-130a類似物和抑制劑處理的HUVEC中c-MYB mRNA水平的(n = 3)。 ** p <0.01。
4 體外證明SGC外泌體來源miR-130a具有促進血管生成的作用。
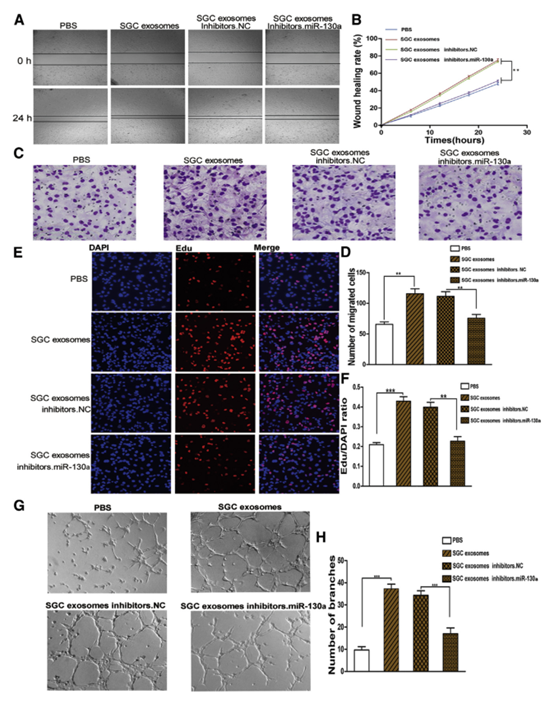
圖4
(A)劃痕試驗測定證明SGC外源富集的miR-130a增加HUVEC遷移(n = 3)。 (B)(A)的定量分析。 (C)驗證SGC外泌體衍生的miR-130a通過transwell測定增強HUVEC的遷移能力(n = 3)。 (D)(B)(n = 3)的定量分析。 (E)EdU分析顯示SGC外泌體促進HUVEC的增殖(n = 3)。 (F)(E)的定量(n = 3)。 (G)通過與SGC外泌體共孵育(n = 3)增強HUVEC中環形成的能力。 (H)(G)的定量(n = 3)。 ** p <0.01和*** p <0.001。
5 miR-130a可以直接促進HUVECs的生物學功能。

圖5
(A)劃痕試驗顯示miR-130a促進HUVEC的遷移(n = 3)。 (B)(A)(n = 3)的定量分析。(C)通過transwell測定驗證miR-130a介導的細胞遷移(n = 3)。 (D)(C)的定量分析(n = 3)。 (E)EdU測定證明miR-130a增強HUVEC的增殖(n = 3)。 (F)(E)的定量分析(n = 3)。 (G)miR-130a增加HUVEC中環形成的能力(n = 3)。 (H)定量分析(G(n = 3)。
6 體內驗證外泌體來源的miR-130a在血管生成和腫瘤生長中的作用。
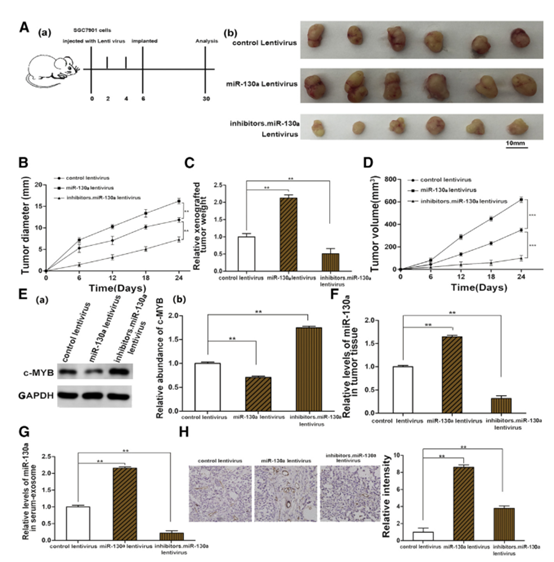
圖6
(A)流程圖(a)描繪了從腫瘤植入小鼠切除的腫瘤組織的體內實驗設計和形態(b)( n = 6)。 (B-D)異種移植腫瘤直徑(B),重量(C)和體積(D)(n = 6)的定量分析。(E)C-MYB表達(a)在植入的腫瘤中(n = 6)和相應的定量(b)。 (F)植入腫瘤中miR-130a的qRT-PCR分析(n = 6)。 (G)從腫瘤植入小鼠的血清中分離的外來體中的miR-130a的水平(n = 6)。 (H)使用CD31抗體(n = 6; CD31廣泛用于證明內皮組織的存在和評估腫瘤血管生成)和相應的定量(b)的石蠟包埋的腫瘤組織的免疫組織化學分析(a)。






