可溶性E-鈣粘蛋白通過外泌體釋放并促進腫瘤血管生成
腫瘤脈管系統是一個有吸引力的治療靶標。卵巢癌的逐漸增長和惡性腹水的形成嚴重依賴于血管生成的這一事實表明,抗血管生成治療策略可能對卵巢癌治療具有功效。尤其是,腹水作為惡性腫瘤并發癥的負擔仍然非常重要,因為其程度是侵襲性和轉移潛能的特征,并且是預后不良的重要指標目前的抗血管生成療法的局限性在于需要一些輔助治療手段。2018年6月以香港大學生物科學學院黃思齊教授為通訊作者在《Nature Communication》(IF=12.353)發表了題為“Soluble E-cadherin promotes tumor angiogenesis and localizes to exosome surface.”文章,他帶領的團隊第一次在體外和體內證明了sE-cad是血管生成的關鍵調節劑。還提供證據證明外泌體是在此過程中切割和釋放sE-cad的新型主要平臺。本文第一次展示了在卵巢癌患者的惡性腹水中高表達的可溶性E-鈣粘蛋白(sE-cad)(80-kDa可溶形式)是血管生成的有效誘導劑。除了胞外域脫落之外,本文還提供了進一步的證據表明sE-cad以外泌體形式大量釋放。從機制上,sE-cad陽性的外泌體與內皮細胞上的VE-鈣粘著蛋白異源二聚化并轉導β-連環蛋白和NFκB信號傳導的順序激活。體內和臨床數據證明了sE-cad陽性外泌體與惡性腹水形成和廣泛的腹膜擴散具有相關性。這些數據將推動我們對卵巢癌血管生成的分子調控的理解,并暗示了靶向sE-cad的治療潛力。sE-cad陽性外泌體的釋放可能是診斷和預后的生物標志物。
技術路線
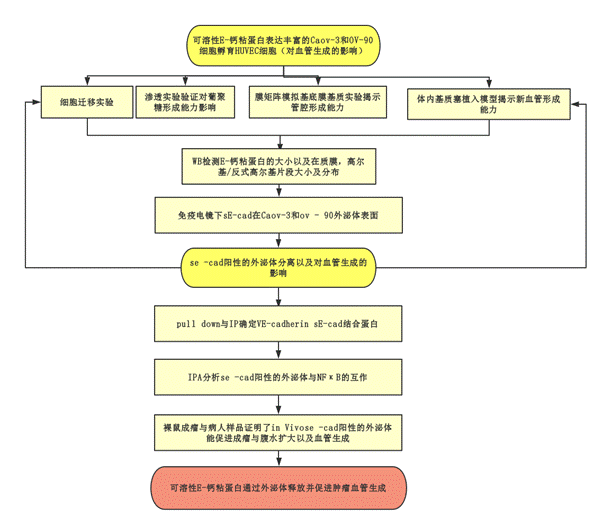
研究結果
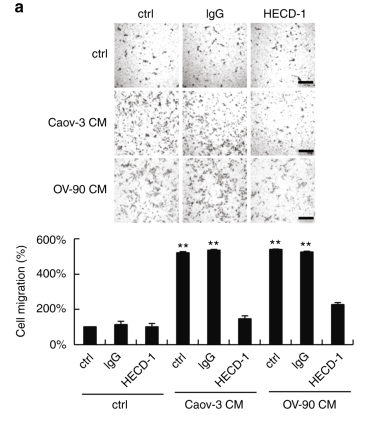
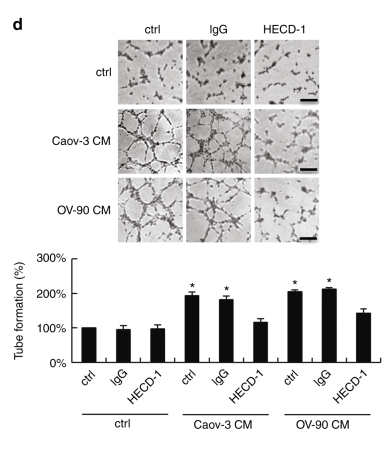
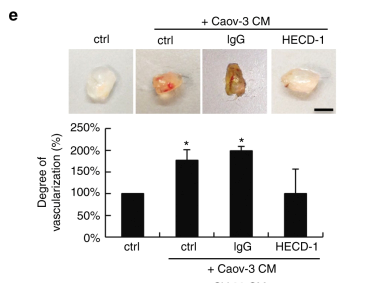
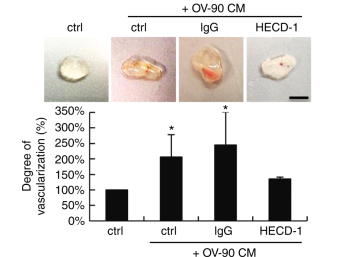
圖1 sE-cad在體內和體外促進血管生成。
a.用Caov-3和OV-90處理促進了HUVEC細胞遷移,HECD-1能抑制細胞遷移。d. 膜矩陣模擬基底膜基質實驗表明Caov-3和OV-90處理的HUVEC三維血管形成能力增強,HECD-1能抑制血管生成。e. 基底膜基質植入小鼠模型證明Caov-3和OV-90處理的HUVEC新血管生成能力增強,HECD-1能抑制新生血管生成。
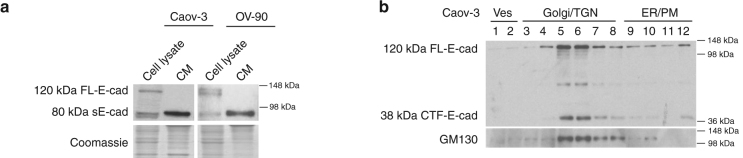
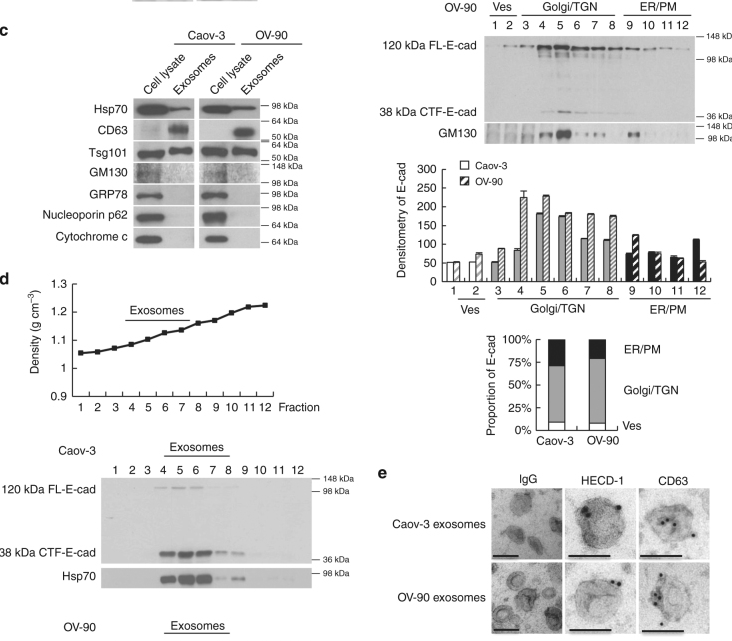
圖2 可溶性E-cadherin促進腫瘤血管生成并定位于外泌體表面。
a. Caov-3和OV-90細胞裂解液和條件培養基(CM)中E-cadherin均有80KD條帶。b. E-cadherin胞外域分裂不僅發生在質膜上,也發生在高爾基/反式高爾基網絡中。c. Western blot檢測Caov-3和OV-90分離的外泌體蛋白組成。d. 蔗糖密度離心sE-cad密度為1.1036–1.1612 g cm-3,微泡大小為100nm,與外泌體一致。 e.免疫電鏡的sE-cad在Caov-3和ov - 90細胞外泌體表面
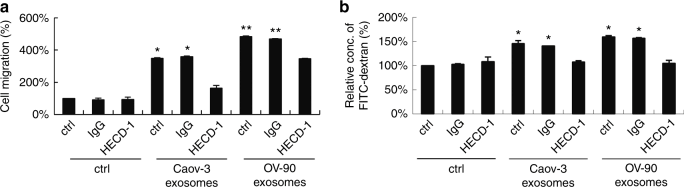
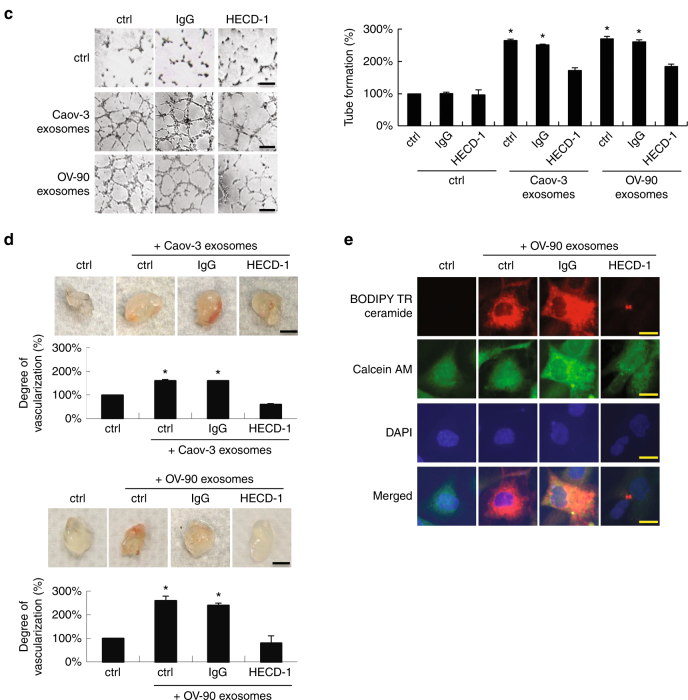
圖3 se -cad陽性的外泌體促進體內和體外的血管生成。
a. 用Caov-3和OV-90外泌體處理HUVEC能促進細胞遷移。b. 滲透實驗表明Caov-3和OV-90外泌體處理的HUVEC綠色熒光素標記的葡聚糖形成能力增強。c.管腔形成實驗表明Caov-3和OV-90外泌體處理的HUVEC血管形成能力增強。d.體內基質塞植入模型證明Caov-3和OV-90外泌體處理的HUVEC新血管生成能力增強。e. se -cad的BODIPY-TR熒光染色
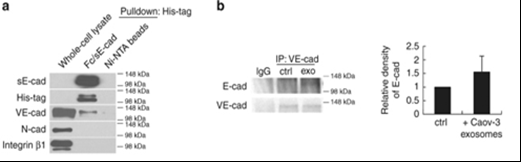
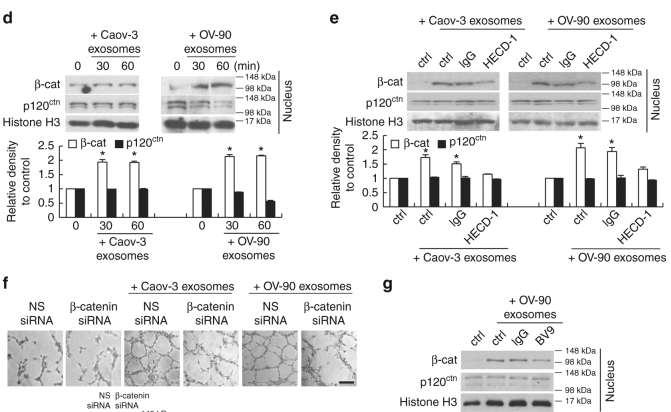
圖4可溶性E-cadherin促進腫瘤血管生成并定位于外泌體表面。
a.His-Tag pull down確定VE-cadherin 是sE-cad結合蛋白。b.免疫沉淀反應試驗中sE-cad與VE-cadherin結合。d. HUVEC在外泌體處理后β-catenin(β-cat)表達上調。e. HECD-1能逆轉β-catenin(β-cat)的表達上調。F 轉染β-catenin siRNAHUVEC的血管形成能力減弱。
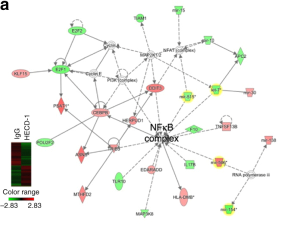
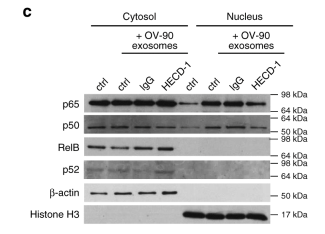
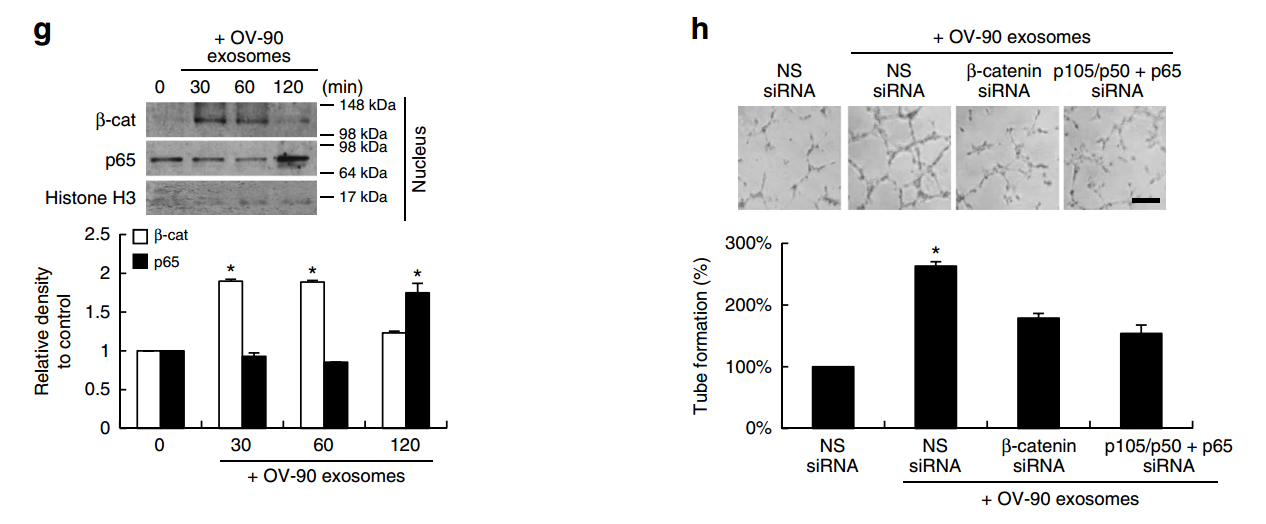
圖5 sE-cad陽性的外泌體通過β-catenin調節血管生成。
a.IPA分析sE-cad陽性的外泌體差異表達基因,NFκB位于網絡的中心位置。c.p65/p50與sE-cad-陽性外泌體互作。g. β-連環蛋白被激活,并在30分鐘內達到其最大值。h. β-catenin 或者NFκB敲低后能廢除sE-cad陽性的外泌體所引起的血管生成。
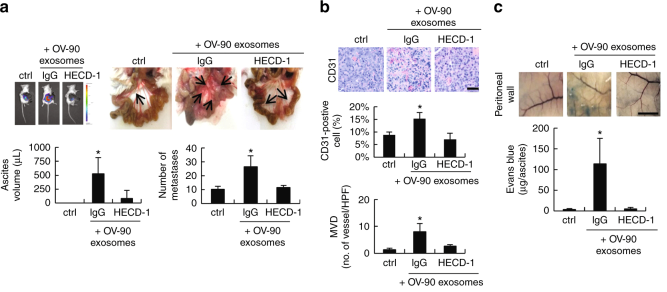
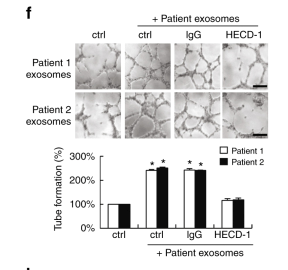
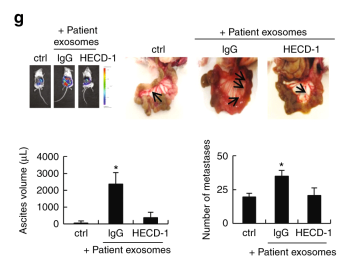
圖6 se -cad陽性的外泌體在體內誘發血管生成。
a. sE-cad陽性的外泌體注射小鼠能誘導成瘤,HECD-1則抑制這一效果。b. CD31 染色sE-cad陽性的外泌體誘導血管生成,HECD-1則抑制這一效果。c .sE-cad陽性的外泌體可以導致埃文斯藍滲出,表明白蛋白和血漿蛋白滲入間質組織 。f. 病人來源的E-cad陽性的外泌體能誘導血管生成。 g. sE-cad陽性的外泌體促進腹水擴大,腫瘤擴散和新血管形成,HECD-1則逆轉這一效果。






