抑癌基因PTEN與可變剪接相關性研究的重大發現
前體mRNA的可變剪切與腫瘤密切相關,然而可變剪切與致癌基因以及抑癌因子之間的關系還仍不明確。2018年6月,上海交通大學細胞分化和凋亡教育部重點實驗室沈少明博士和上海生命科學研究院健康科學研究所冀顏博士為論文第一作者在《Nature Communication》(IF=12.353)發表了題為“Nuclear PTEN safeguards pre-mRNA splicing to link Golgi apparatus for its tumor suppressive role.”的文章,報道了存在于細胞核內PTEN蛋白通過與mRNA剪接體相互作用,調控pre-mRNA的可變剪接,進而干預高爾基體的伸展和分泌,從而發揮其腫瘤抑制作用。
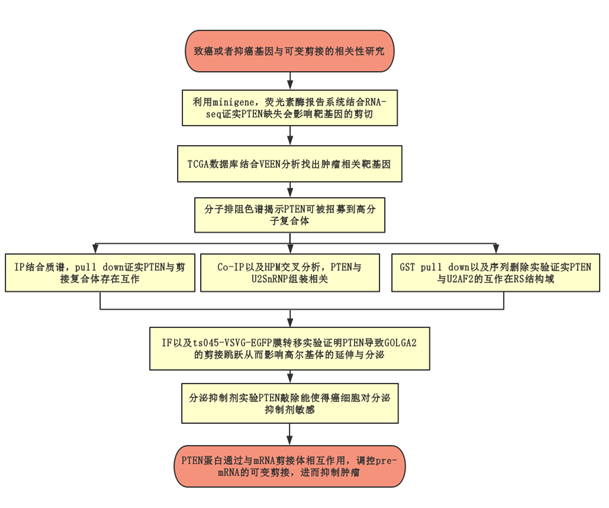
技術路線
結果
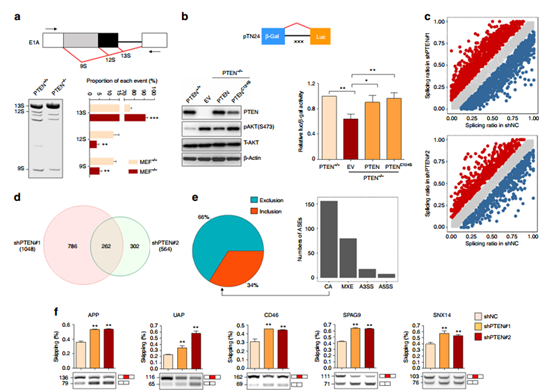
圖1 PTEN調節整體的可變剪切。
構建pMTE1A minigene或者 pTN24熒光素酶報告基因,并將其轉入到PTEN+/+ 以及PTEN-/-小鼠胚胎成纖維(MEF) 細胞中,均證明PTEN的缺失會影響剪切事件(a, b);利用shRNA干擾PTEN的表達后通過RNA-seq檢測與對照組相比檢測下游靶基因的變化,262 可變剪接事件(ASEs) 代表 208 人類基因被檢測出來,并且通過RT-PCR得以驗證。
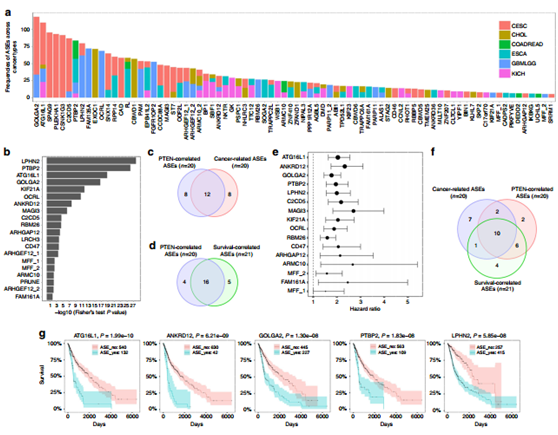
圖2 PTEN調節的 ASEs在腫瘤中得以證實。
利用TCGA數據庫分析,發現上述的262個基因絕大多數與腫瘤有關,其中我們挑出與膠質母細胞瘤 (GBMLGG)相關的20個基因(a, b);12個基因與腫瘤以及ASEs均相關,16個與病人的生存具有相關性(c, d),三者交叉共有10個基因被挑選出來做進一步研究(e,f);在PTEN缺失與野生型的膠質母細胞瘤細胞中證實了GOLGA2, KIF21A ,C2CD5的表達。

圖3 核PTEN 與剪接復合體蛋白相互作用。
293T細胞的核提取物進行尺寸排阻色譜分析得到了PTEN可能被招募到高分子的復合體(a)免疫沉淀結合LC-MS/MS鑒定到136個與核PTEN相互作用的蛋白質(b),KEGG 分析得到38個屬于剪接體的組成成分(c)。通過細胞核質分離并結合co-IP以及pull-down實驗證實了核PTEN與剪接體蛋白緊密結合并且調控剪接體組裝(e,d,f)。
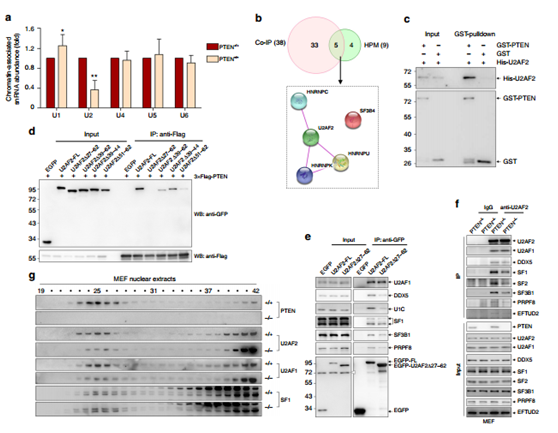
圖4 PTEN能夠與剪接體蛋白U2AF2的RS結構域直接相互作用。
利用qRT-PCR檢測到 U2 與MEF細胞中PTEN的缺失有關(a)揭示了PTEN可能與U2 snRNP復合物的組裝有關;co-IP 以及HPM 的交叉分析,并通過String database得到剪接復合體的互作網絡GST-標簽的 PTEN 蛋白與His-標簽的U2AF2共孵育進行GST pulldown實驗證實兩者的互作(c)刪除aa27–62, 精氨酸U2AF2絲氨酸富富集的區域(RS) 能調節U2AF2–PTEN 相互作用(d) 并且在PTEN+/+ 以及PTEN-/- MEF細胞在體內水平進行了驗證(e,f,g)
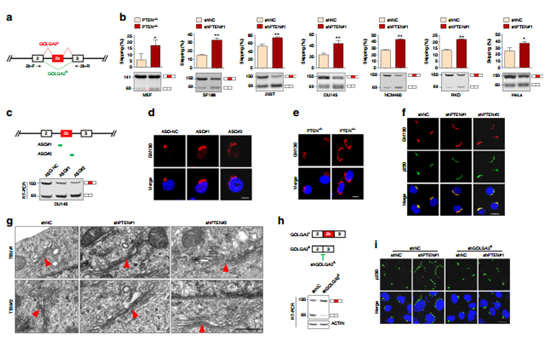
圖5 PTEN的敲除誘導了GOLGA2 的可變剪切,促進了高爾基體伸展與分泌功能。
高爾基體相關功能基因GOLGA2的可變剪接是核PTEN所調控的可變剪接事件之一。PTEN缺失使得其在新定義的外顯子2b處發生剪接跳躍,產生了更多不含有外顯子2b的變體(a,b);利用ASO引起的外顯子2b處發生剪接跳躍,IF免疫熒光證實了高爾基體變得更加的伸展(d)同樣的在PTEN-/- MEF 細胞以及PTEN 敲減的DU145細胞內也如此。TEM電鏡也觀察到PTEN表達缺失后導致的高爾基體的分泌功能減弱(g)。外顯子2b的變體這一可變剪接事件的發生使得高爾基體變得更為伸展,分泌功能大幅增強(h,i)。
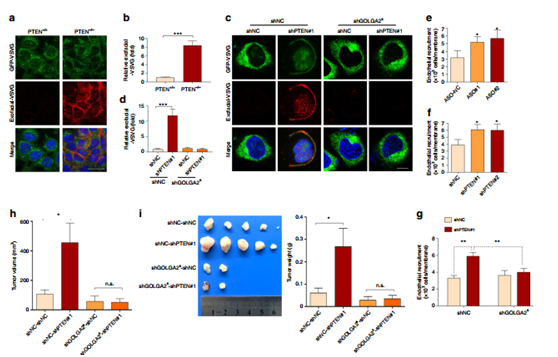
圖6 通過GOLGA2 的剪接跳躍導致了PTEN缺失腫瘤的生長優勢。
利用ts045-VSVG-EGFP(具有從ER移出到高爾基復合體中的能力,并且在溫度降低到32℃時最終到達質膜,因此已被廣泛用于研究膜轉運)研究高爾基體分泌,結果顯示PTEN缺失促進高爾基體分泌(a,b,c,d)ASO電穿孔轉化以及PTEN的干擾實驗也證明了這一點(e,f,g)進一步研究了GOLGA2S對腫瘤生長的影響。發現PTEN缺失促進腫瘤生長,敲低GOLGA2S也會抑制這種生長現象(h,i,j),因此GOLGA2剪接有助于PTEN缺失誘導的分泌和腫瘤生長
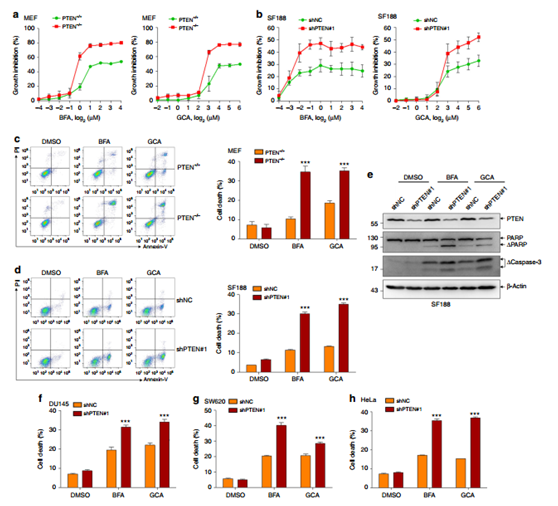
圖7 PTEN敲除能使得癌細胞對分泌抑制劑敏感。
接著研究人員用兩種分泌抑制劑BFA和GCA處理PTEN+/+和PTEN-/- MEF細胞。結果顯示,一旦達到一定的濃度(BFA為1μg/ ml,GCA為8μg/ ml),BFA和GCA對PTEN-/- 細胞抑制作用更明顯,表明分泌抑制劑BFA和GCA能夠選擇性地殺死PTEN缺失的腫瘤細胞。






