早期人肺免疫細胞的發育及其在上皮細胞命運中的作用
對人類肺部發育的研究主要集中在上皮細胞和間質細胞的類型和功能上,但對發育中的肺部免疫細胞知之甚少,盡管氣道是出生后粘膜免疫的主要部位。一個懸而未決的問題是,組織駐留免疫細胞是否在組織在子宮內發育過程中,在塑造組織方面發揮著重要作用。在這里,我們使用 scRNA-seq、smFISH 和免疫組織化學對人類胚胎和胎兒肺中免疫細胞進行了分析。在胚胎階段,我們觀察到了早期的先天免疫細胞波動,包括先天淋巴細胞、自然殺傷細胞、髓系細胞和譜系祖細胞。在管狀階段,我們檢測到表達高水平細胞毒性基因的初始 T 淋巴細胞和成熟 B 淋巴細胞(包括 B-1 細胞)的存在。我們的分析表明,胎兒肺提供了B細胞完全成熟的環境。鑒于發育過程中免疫細胞的存在和多樣性,我們還研究了它們對上皮成熟的可能影響。我們發現IL-1β在體外驅動上皮祖細胞自我更新并分化為基底細胞。在體內,在整個肺和上皮尖端附近發現了產生 IL-1β 的髓系細胞,這表明免疫細胞可能指導人肺上皮的發育。
該研究于2023年12月發表在《Science immunology》,IF:24.8。
技術路線:
結果:
1、人類胎兒肺部的免疫細胞隨著發育時間變化
在這項研究中,我們檢查了正在發育的胎兒期的人類肺部,在細胞和分子水平上分析免疫細胞,并研究免疫細胞信號對上皮分化的影響(圖 1A)。我們的單細胞測序數據最初被描述為廣泛定義的免疫細胞類型(圖 1B)。先天細胞和祖細胞類型在發育早期更為普遍,包括先天淋巴細胞 (ILC)、自然殺傷細胞 (NK) 和髓系細胞。隨著發育時間的推移,B和T淋巴細胞的比例逐漸增加。 IHC 顯示,CD45+ 免疫細胞在整個早期發育過程中都存在于人胎兒肺部中(圖 1C),并且位于所有肺部區域,包括內皮、上皮和間質。全肺組織切片的定量(圖 1,C 至 E)顯示,免疫細胞比例在 8 pcw 時最高,隨后下降,然后在 20 pcw 時上升至小管階段的 9% 左右。我們得出的結論是,胎兒肺中存在一個復雜且動態變化的免疫區室。
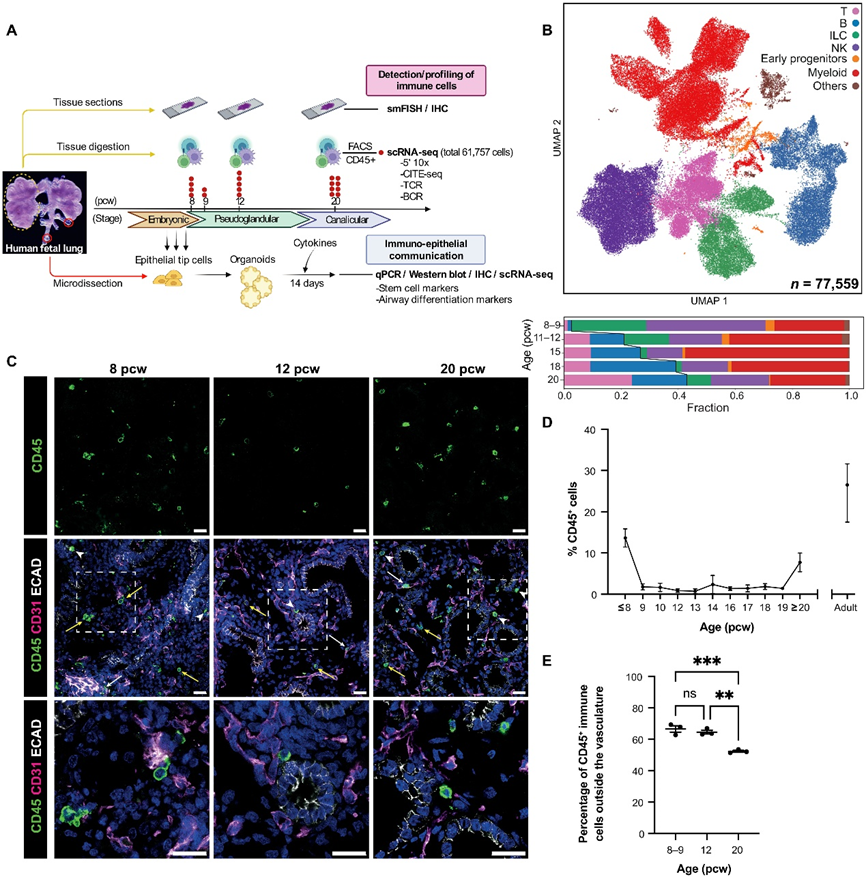
2、使用 scRNA-seq 對免疫細胞進行分子表征
為了全面表征胎兒肺免疫細胞的亞群,我們提取了妊娠8、9、12和20周的整個胎兒肺(n = 19),并在進行單細胞RNA測序(scRNA-seq)之前通過熒光激活細胞分選(FACS)富集CD45+免疫細胞(圖1A)。使用10X Chromium 5′ scRNA-seq對胎兒肺免疫細胞進行了分析,其中一部分樣本還用于進行CITE-seq蛋白質測量,其質量控制度量見圖S2(A和B)。我們對所有樣本進行了α/β TCR-seq,并對一部分樣本進行了γ/δ TCR和BCR測序。為了最大程度地發現細胞類型和狀態,我們將這些數據與我們先前的整個胎兒肺scRNA-seq數據的免疫組分結合起來。經過質量控制和整理,我們獲得了總計77,559個高質量的轉錄組文件,涵蓋了所有已知的白細胞系譜,包括B和T淋巴細胞、ILC、NK細胞、髓樣細胞以及上述系譜的早期祖細胞(圖2A)。還鑒定了非免疫細胞,如上皮細胞、紅細胞和基質細胞,這些細胞可能是CD45抗體非特異性結合的細胞,我們將其包含在我們的數據對象中。
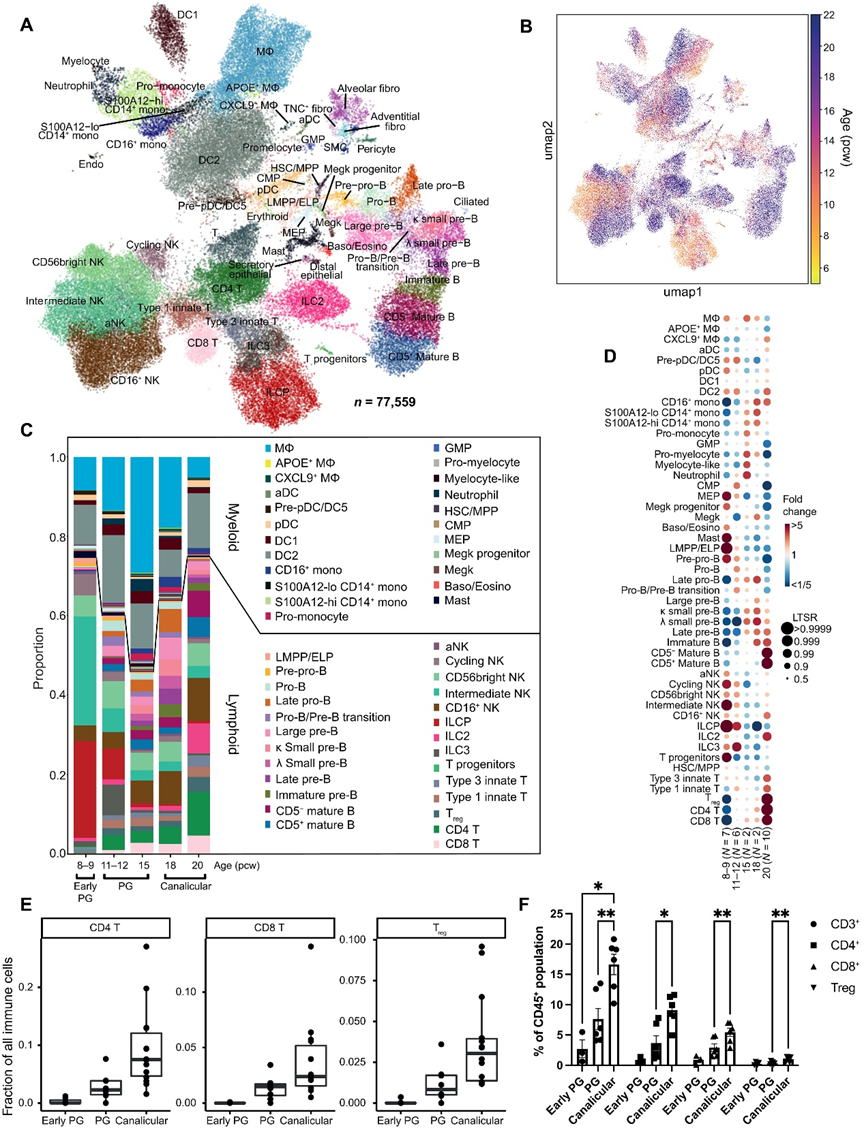
我們對所有階段的單細胞轉錄組學數據進行了注釋和整理,根據標記基因表達(圖2A)注釋了59個細胞類型/狀態的簇。早期祖細胞,包括前前體B細胞、淋巴-多能祖細胞(LMPPs)、ILC祖細胞(ILCPs)、巨核紅細胞祖細胞(MEPs)、共同髓系祖細胞(CMPs)、巨核細胞祖細胞和T細胞祖細胞主要存在于較早的階段(圖2,B到D)。
我們的單細胞RNA測序結果以及后續的流式細胞術驗證顯示,隨著發育的進行,總T細胞(CD3+)、CD4+、CD8+和調節性T細胞的豐度顯著增加(圖2,E和F)。我們還通過IHC在12和20周胚胎時在組織切片中驗證了T、NK和B細胞類型的存在。
總體而言,免疫細胞的比例呈雙相模式,8周胚胎時較高,20周胚胎時再次升高(圖1D)。第二個峰值可能部分歸因于血管成熟。因此,我們使用PECAM1作為評估發育中肺血管比例的替代讀數。定量PCR(qPCR)顯示PECAM1表達在胚胎期、假腺期和管狀期都有顯著增加。考慮到從12周胚胎后其相對恒定的每細胞表達,該分析表明在管狀期,血管細胞的比例確實增加。因此,免疫細胞數量的動態增加與血管組織的增加相一致。
這促使我們檢查了來自肺血管與組織駐留的免疫細胞比例。我們使用了整個樣本染色和定量免疫組化以及10X Visium數據的組合,以確定血管內與組織駐留免疫細胞的比例(圖1E)。我們發現在研究的所有階段,大多數免疫細胞都是組織駐留的。
3、人類胎兒肺中的B細胞發育環境
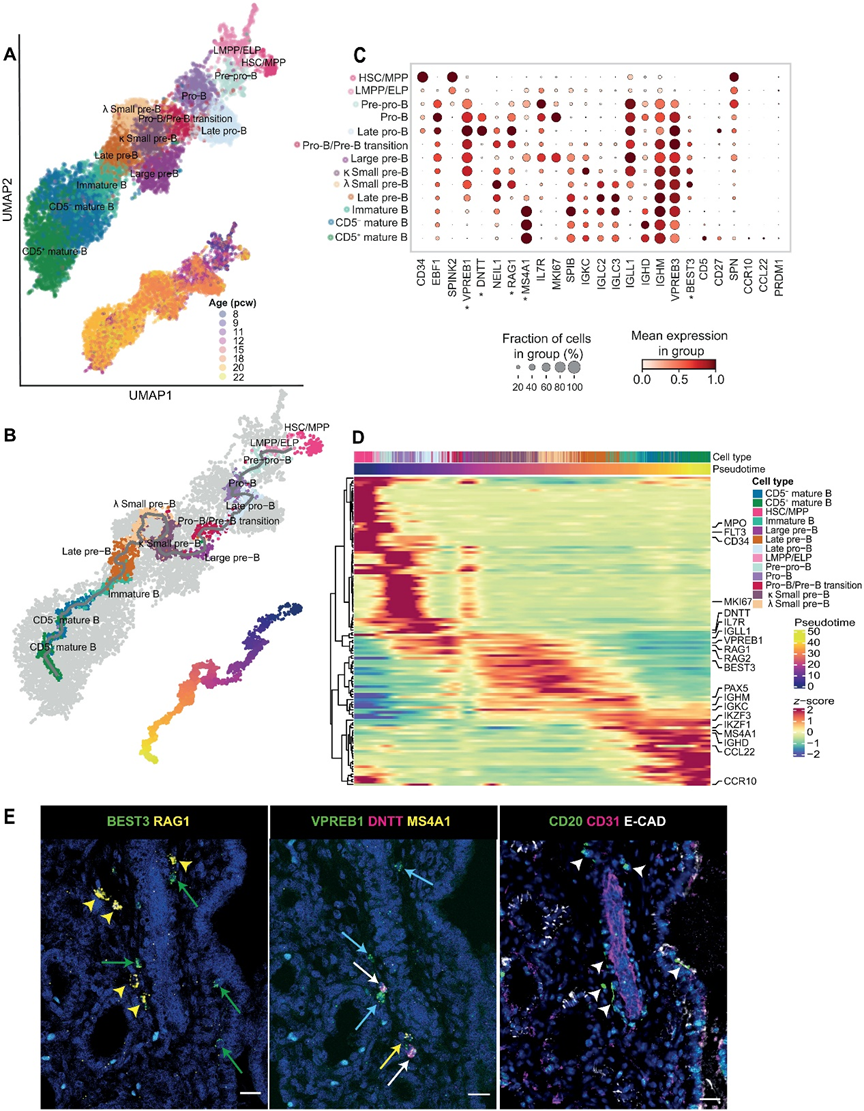
在研究B細胞組分時,我們能夠檢測到胎兒肺中B細胞的所有發育階段,包括LMPP/ELP(CD34+EBF1?),前前B細胞(EBF1+SPINK2+VPREB1+),原始B細胞(DNTT+),大前B細胞(IL7R+MS4A1+MKI67+),小前B細胞(IL7R+SPIB+MKI67?),未成熟B細胞(MS4A1+IGHDloIGHMhiVPREB3hi)和成熟B細胞(MS4A1+IGHDhiIGHMhiVPREB3lo)(圖3,A到C)。我們根據簇特異性基因定義了更精確的細胞亞型:NEIL1+MKI67?晚期原始B細胞;RAG1+MS4A1+ 原始B細胞/前B細胞轉化細胞;表達免疫球蛋白κ(IGKC+)或λ(IGLC2+IGLC3+)輕鏈基因的小前B細胞簇;表達代用輕鏈標記IGLL1的MS4A1+晚期前B細胞,IGLL1是前BCR的組成部分;以及CD5?與CD5+成熟B細胞。軌跡分析(圖3B)顯示了與已知B細胞成熟生物學一致的線性趨勢,從前前B細胞到原始B細胞,前B細胞,未成熟B細胞和成熟B細胞階段的發展(圖3C中的細胞標記),關鍵基因動態變化(圖3D)。正如預期的那樣,B細胞成熟的后期與MS4A1(CD20)和IgD的出現相一致(圖3,C和D)。
最初認為B細胞的成熟主要發生在胎兒骨髓,但最近的研究表明B細胞中間體也可在胎兒皮膚、腎臟和腸道中檢測到。在這里,我們展示了代表B細胞發育軌跡的所有群體也可以在胎兒肺中找到。為了了解它們是來自循環系統,可能是從骨髓“滲漏”出來的,還是在現場發育的,我們進行了smFISH和IHC,并觀察到不同階段的發育中的B細胞聚集在一起(圖3E)。RNAscope顯示VPREB1+DNTT+細胞代表pro-B細胞階段,RAG1+BEST3+小前B細胞以及MS4A1+成熟B細胞,而CD31、EpCAM和CD20在連續的組織切片上的染色表明這些B細胞系列細胞映射到血管外的空間。綜合起來,我們的研究結果強烈證明B細胞在胎兒肺中局部發育,支持最近的觀點,即B淋巴細胞的發育可以發生在外周,而不僅限于胎兒骨髓等主要造血器官。
為了進一步表征胎兒肺中的成熟B細胞群體,我們檢查了Ig同種型的表達和克隆擴張。PRDM1的轉錄因子的表達缺失(圖3C)證實我們的數據集不包含任何漿細胞,表明在人類胎兒肺中不發生T細胞依賴的B細胞激活和分化。成熟的CD5+細胞的最終階段以CD5、CD27、SPN(CD43)、CCR10和CCL22標記(圖3C)。
4、胎兒肺部的 T、NK 和 ILC 細胞
在進一步研究淋巴細胞系譜的過程中,我們確定了傳統和非傳統T細胞、ILCs和NK細胞(圖4A)。CD4、CD8和調節性T(Treg)細胞表達了既有天然T細胞又有記憶T細胞的特征(圖4B)。我們確定了胎兒的“天然”T細胞,它們與成年人中相應的天然T細胞存在差異。胎兒特異的天然T細胞基因一直表達到新生兒結束的時候,表明即使在出生后,天然T細胞仍在不斷成熟。
通過表達標記基因(HPN和SCN1B)確定了ILCPs的聚類。一個重要的問題是這些ILCPs是否代表了所有ILC亞型或特定亞型的局部前體。通過主成分分析(PCA)將樣本進行了分組(圖4C)。在PC1與PC2的圖中,ILCPs與ILC3s共定位,而ILC2s主要與NK亞型共定位;沒有識別到ILC1群。這表明,在肺部,ILCPs可能只能產生ILC3s而不能產生ILC2s。
為了進一步探索我們的數據,我們將我們的胎兒肺免疫群體與其他發育器官的免疫細胞整合在一起(圖4D),從而使我們能夠搜索在發育肺中富集的細胞鄰域(圖4E)。與其他相似發育階段的胎兒組織相比,ILCs和NK細胞在胎兒肺中顯著富集。與其他胎兒器官相比,肺ILCPs和中間NK細胞差異表達與細胞周期正調控相關的基因(圖4F),表明這些前體/分化中間體處于增殖狀態,并且胎兒肺可能為擴展這些細胞系提供了一個生長環境,與近期在小鼠發育中的發現一致。
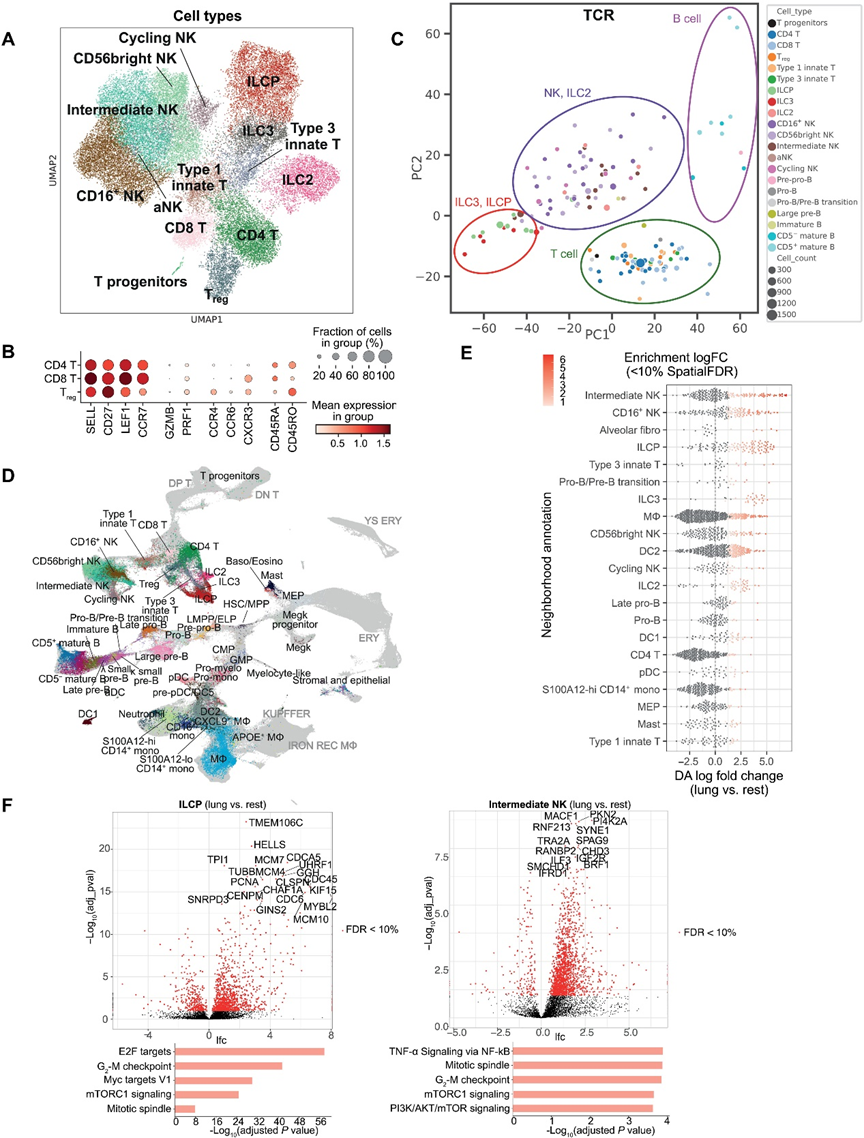
5、胎兒肺部髓系部分的發育
在我們的數據集中,我們分別檢查了巨噬細胞(圖5,A和B)和樹突狀細胞發育的軌跡。所有胎齡的細胞都存在于所示的所有粒細胞種群中,反映了持續的粒細胞成熟。基于分區圖的圖形抽象(PAGA)和RNA速度分析表明,從HSC/MPP到CMPs的分化逐漸進行,經過前單核細胞和單核細胞種群(S100A12hi CD14+、S100A12lo CD14+和CD16+),然后是不斷成熟的巨噬細胞(MΦ)細胞類型(CXCL2+巨噬細胞、APOE+巨噬細胞和巨噬細胞)(圖5,C和D)。沿發育軌跡的前100個差異表達基因的綜合分析揭示了造血和/或分化過程中調節的關鍵調控基因和標記基因的時間表達模式(圖5F)。
在我們的數據集中,我們檢測到許多我們使用RNAscope在空間上驗證的早期前體細胞。這包括罕見的SMIM24+SPINK2+細胞,可能是HSCs,以及基于它們的典型標記基因表達確定的GMPs、CMPs、前單核細胞、髓細胞、MEPs、巨核細胞前體和巨核細胞等髓系前體細胞(圖5,G和H)。根據對IHC圖像的手動定量,大多數髓細胞,由其CD68的表達定義,是組織駐留的(圖5,I和J)。綜合的軌跡分析和成像數據表明,隨著發育的推移,髓系細胞繼續進入胎兒肺,在那里進一步分化。特別是巨噬細胞相比其他胎兒器官表達更高水平的與細胞周期相關的基因,這表明胎兒肺可能提供了一個增殖的生長環境(圖5K)。
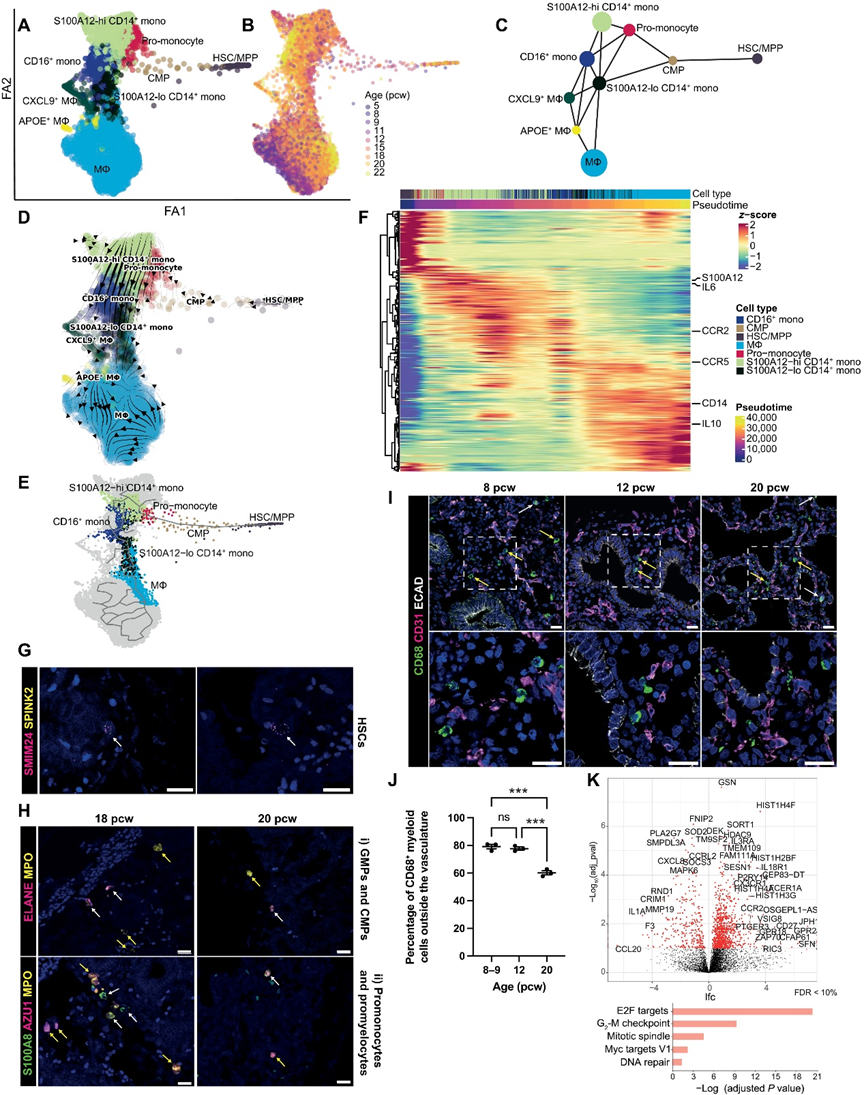
6、IL-1β導致尖端干細胞退出自我更新狀態并分化為胎兒肺類器官中的基底細胞
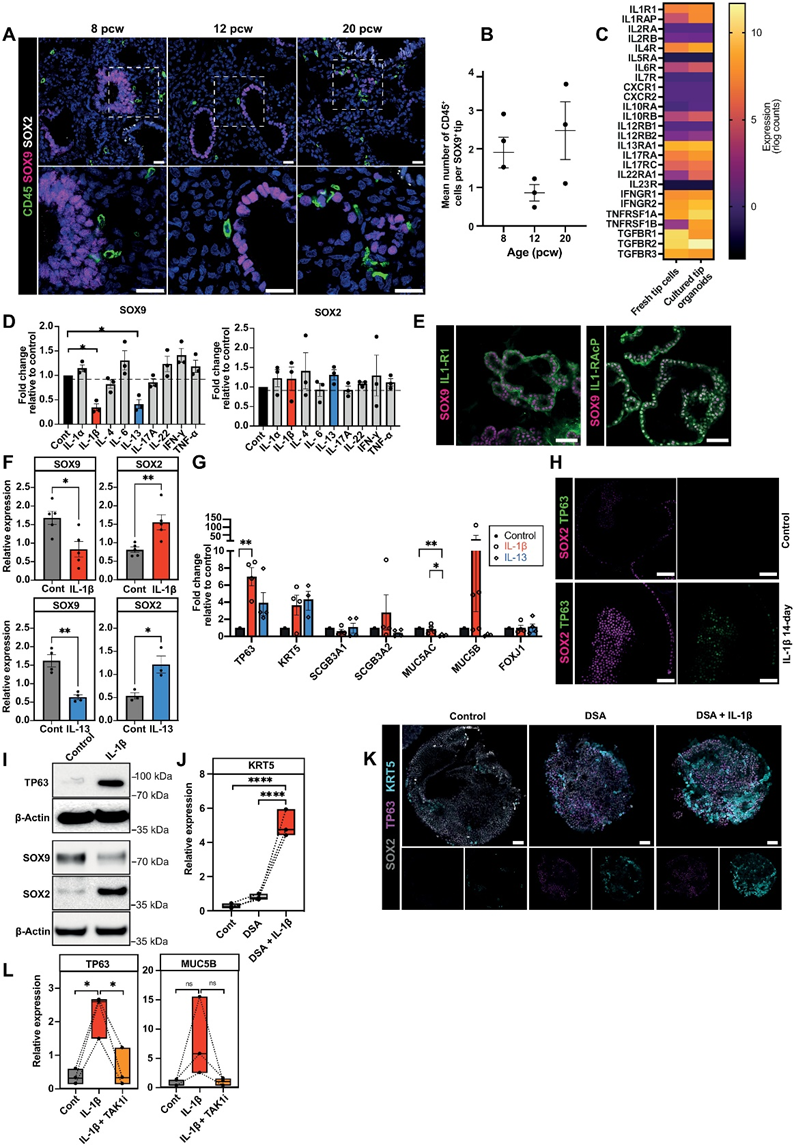
在人類發育中的肺中,遠離的上皮尖端由SOX9+的前體細胞組成,它們產生所有肺泡和氣道系列細胞。在確定了免疫細胞存在于發育中的整個肺部后,我們探究了哪些免疫細胞位于上皮尖端周圍,以及它們可能對上皮成熟,特別是對尖端前體的影響。免疫組織化學(IHC)顯示CD45+免疫細胞分布在整個胎兒肺和SOX9+上皮尖端附近(圖6A),在8-9和20周孕時,與12周孕時相比,更多的免疫細胞聚集在尖端周圍(圖6B),這可能反映了我們先前在這些時間點觀察到的雙峰高峰(圖1,C和D)。為了研究免疫-上皮的相互作用,我們使用已發表的大規模RNA測序數據將5-9周孕的肺上皮尖端來源的器官樣體與新鮮切取的6-7周孕的尖端進行比較。上皮尖端前體表達了幾種細胞因子受體,包括IL-1、IL-4、IL-6、IL-13、IL-17、IL-22、干擾素-γ(IFN-γ)、腫瘤壞死因子(TNF)和轉化生長因子-β(TGF-β)的受體(圖6C)。我們在新鮮的上皮尖端和器官樣體中發現了類似的表達模式。基于表達的受體,我們篩選了相應細胞因子在培養的器官樣體中的效應。
遠離的上皮尖端細胞在擬腺期(約5到16周孕)始終共表達SOX2和SOX9。我們使用SOX2和SOX9作為標記物來研究我們的細胞因子組對器官樣體的影響。最初,器官樣體用細胞因子(10 ng/ml)處理7天,之后我們觀察到IL-1β和IL-13導致SOX9表達顯著下降,而SOX2沒有受到顯著影響(圖6D)。為了更詳細地研究免疫-上皮的相互作用,我們主要關注了研究IL-1β信號對器官樣體的影響。
首先,我們評估了器官樣體表面的IL-1受體1(IL-1R1)的存在。對于IL-1β信號傳導,需要IL-1R1和一個輔助蛋白(IL-1RAcP)。整個染色顯示器官樣體和體內胎兒肺上皮中均表達IL-1R1和IL-1RAcP(圖6E),證實了IL-1β信號傳導的可能性。鑒于兩個受體組分都存在,我們在存在IL-1β的條件下培養器官樣體更長的時間。經過14天的IL-1β處理后,我們觀察到SOX9顯著減少,SOX2增加(圖6F),表明IL-1β導致尖端前體從自我更新狀態向分化狀態撤離。在檢查氣道分化標記物時,我們發現TP63的表達顯著增加,KRT5的增加無顯著性差異(兩者都是基底細胞的標記物),但在SCGB3A1、SCGB3A2、MUC5AC或纖毛細胞標記物FOXJ1的表達上沒有影響(圖6G)。
基于我們對IL-13效應的觀察(圖6D),以及先前的研究表明ILC可以分泌IL-13,以及ILC在胎兒肺中富集(圖4E),我們將器官樣體用IL-13處理了14天,以比較其對尖端細胞的影響與IL-1β的影響。IL-13處理導致SOX9和SOX2顯著減少,TP63和KRT5無顯著性增加(圖6F和G),表明對氣道分化有類似的影響。然而,IL-13和IL-1β對分泌細胞系標記物表達的影響是不同的:IL-13處理導致MUC5AC和MUC5B減少,而IL-1β處理在大多數重復中顯著增加了MUC5B(圖6G)。IL-1β處理器官樣體的效應在蛋白水平上也通過整體染色(圖6H)和Western blotting(圖6I)得到確認。這些結果表明IL-1β促使尖端前體細胞從自我更新狀態中退出,通過下調SOX9和增加SOX2的表達,然后導致腫瘤蛋白P63(TP63)的增加,從而支持向基底細胞的分化。
IL-1β的補充與DSA結合可導致肺器官樣體中成熟基底細胞標記物keratin 5(KRT5)顯著增加(圖6J和K),表明分泌IL-1β的免疫細胞促進成熟基底細胞分化,并可能與分泌TGF-β/BMP-4的間充質細胞共同起作用。為了進一步確認IL-1信號在分化中的作用,我們還測試了IL-1β抑制的效果。通過IL-1受體攔截劑(IL-1Ra)阻斷IL-1受體增加了增殖(Ki67+細胞)和器官樣體的大小,而IL-1β減小了器官樣體的大小和增殖,這表明IL-1信號在決定前體細胞命運中起著重要作用。無論是在干性還是分化中。MAPKKK蛋白激酶TGF-β激活激酶1(TAK1)介導IL-1激活信號通路中c-Jun N-末端激酶和核因子κB的激活。(5Z)-7-Oxozeaenol是TAK1的強效抑制劑,也顯著減弱了IL-1β誘導的基底細胞標記物誘導,進一步證實了IL-1信號的關鍵作用(圖6L)。
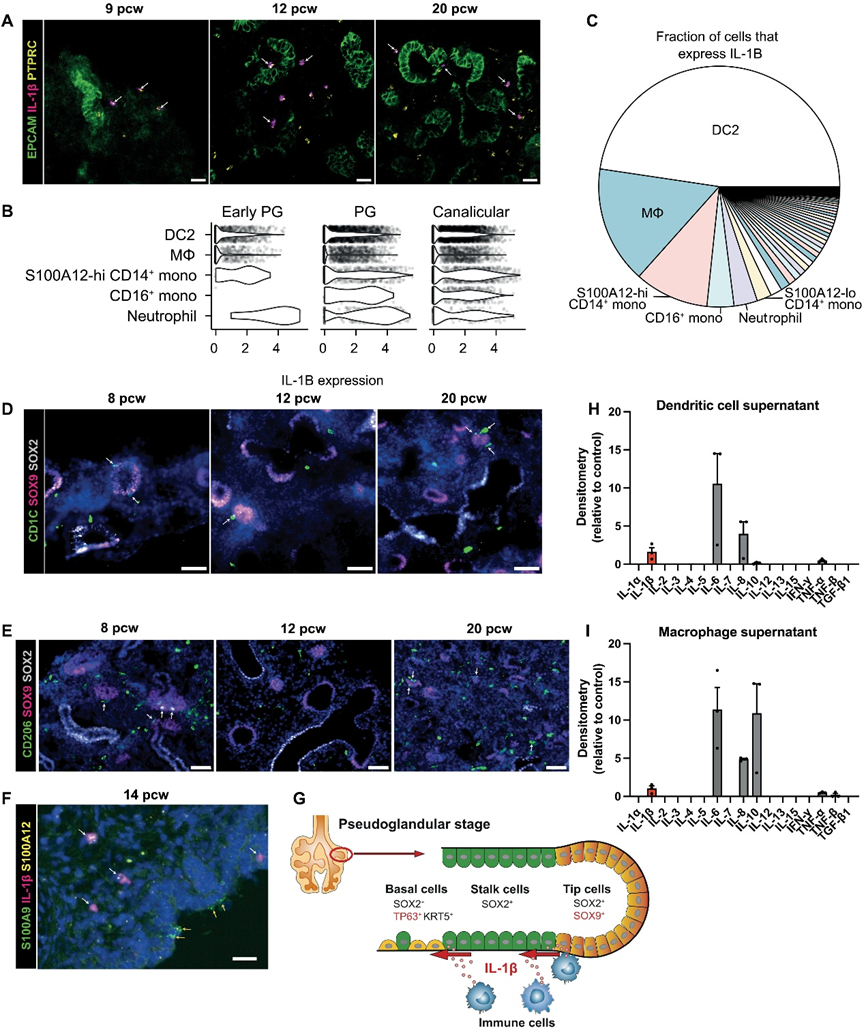
7、胎兒肺部的髓系細胞分泌 IL-1β
在確立了IL-1β信號具有改變發育中肺上皮細胞命運的能力后,我們試圖在體內確定可能是IL-1β來源的免疫細胞。成年人體內IL-1β的主要來源是血液單核細胞、組織巨噬細胞和樹突狀細胞。我們首先使用RNAscope在體內胎兒肺中確認了IL1B+免疫細胞的存在(圖7A)。在我們的單細胞數據集中,前五個表達最高的細胞類型占所有IL1B的75%以上(圖7B和C)。胎兒DC2細胞、巨噬細胞、單核細胞和中性粒細胞顯示出IL1B最高的表達(圖7B和C)。我們更仔細地研究了發育中肺中DC和巨噬細胞的空間和時間分布,使用CD1C作為DC2細胞的標記物,使用巨噬細胞甘露糖受體CD206作為巨噬細胞的標記物(圖7D和E)。我們在整個發育過程中在胎兒肺組織中識別了CD1C+ DC2細胞和CD206+巨噬細胞,并發現DC和巨噬細胞直接接觸SOX9+上皮尖端前體。此外,我們還觀察到單核細胞和/或中性粒細胞靠近發育中的上皮(圖7F)。通過體外培養每種細胞類型7天,使用優化條件分析了培養上清液,我們從19到21周胎兒肺中分離了DC和巨噬細胞,并研究了它們的細胞因子分泌,使用Human Cytokine Antibody Array (Abcam)(圖7H和I)。兩種細胞類型都分泌了幾種細胞因子,特別是IL-1β、IL-8、IL-6、IL-10、TNF-α和TNF-β。
這些數據證實了發育中的胎兒肺中存在能夠分泌IL-1β的DC和巨噬細胞。IL-6和TNF-α最初通過器官樣體處理7天進行了測試(圖6D),對SOX9或SOX2的表達沒有影響。IL-8通過CXCR1和CXCR2受體信號傳導,而這兩者在上皮尖端均不表達(圖6C),因此IL-8信號傳導可能不會直接影響發育中的上皮。IL-10信號需要IL-10受體的兩個組分(α和β),但在上皮前體和器官樣體中只表達IL-10Rβ(圖6C),這表明IL-10也不能直接影響上皮尖端。盡管IL-8和IL-10不能直接對上皮發揮信號作用,但它們可能影響招募和激活發育中胎兒肺中存在的其他免疫細胞,因此可能間接影響上皮。總的來說,我們已經證明了能夠分泌IL-1β的免疫細胞駐留在上皮尖端附近,這表明免疫細胞具有引導發育中肺上皮的能力。
實驗方法:
IHC、FACS、scRNA-seq、CITE-seq、遺傳供體分離、類器官、細胞因子治療、雙 SMAD 激活。
參考文獻:
Barnes JL, Yoshida M, He P, et al. Early human lung immune cell development and its role in epithelial cell fate. Sci Immunol. 2023;8(90):eadf9988.






