m6A修飾環狀RNA驅動的正反饋回路促進結直腸癌肝轉移
結直腸癌(CRC)是最常見的消化道惡性腫瘤之一,其發病率和死亡率分別居所有惡性腫瘤的第3位和第2位。腫瘤轉移是結直腸癌患者死亡的主要原因。臨床上約有45-60%的CRC患者存在肝轉移,超過90%的肝轉移灶在初診時無法切除。未行手術治療的結直腸癌肝轉移患者的中位生存時間僅為6.9個月,5年生存率低于5%。因此,破譯結直腸癌肝轉移的機制,發現新的治療靶點,預防和干預轉移,提高患者生存率具有重要的臨床意義。環狀RNA(circRNA)是一類特殊的內源性RNA分子,具有共價閉合環狀結構,由剪接體催化的反向剪接事件產生,一個基因位點可以產生一個或多個circRNA。高通量測序和計算機模擬方法已經確定circRNA高度保守,并以疾病、組織或細胞特異性模式廣泛表達。circRNA越來越多地參與各種人類疾病的發生和發展,一些circRNA被確定為預測疾病進展和預后的生物標志物。有趣的是,最近的一些證據表明,circRNA可以被翻譯成功能性肽。例如,circRNA編碼的截短蛋白如E-Cad-254aa和ARHGAP35-1289aa已被報道分別在膠質瘤和肝細胞癌中發揮關鍵作用。由于circRNA的頭尾形狀,其編碼蛋白質的方式不依賴帽,由內部核糖體進入位點(IRES)或N6-甲基腺苷(m6A)修飾驅動。m6A是真核生物RNA中最豐富的內部修飾,它是動態可逆的。到目前為止,只有少數隱藏在circRNA中的內源性小蛋白被表征,絕大多數的功能相關性還有待發現。該研究發表在《Molecular Cancer》,IF:37.3。
技術路線:

主要研究結果:
1. Circ-YAP與結直腸癌肝轉移相關
為了鑒定在結直腸癌肝轉移中具有翻譯活性的關鍵circRNA,研究者分析了circRNA微陣列和核糖體新生鏈復合體結合RNA測序數據。接下來,檢測了circ-YAP在新鮮冷凍組織中的表達,結果顯示,與正常組織相比,circ-YAP在CRC組織中輕度升高,而在肝轉移病例中顯著過表達(圖1A)。同樣,在高轉移潛能的CRC細胞系中也觀察到高circ-YAP(圖1B)。序列分析顯示,circ-YAP來源于YAP前體mRNA第2、7外顯子的反剪接,成熟全長為842 bp(圖1C)。在正常和CRC細胞中,Circ-YAP對RNAse R消化均有抗性(圖1D),而其線性異構體則無抗性(圖1E)。此外,Circ-YAP的半衰期超過24h(圖1E)。qRT-PCR和FISH檢測結果顯示,circ-YAP主要定位在細胞質中(圖1F)。為了進一步探索circ-YAP的臨床相關性,研究者收集了石蠟包埋組織,采用ISH檢測circ-YAP的表達。與預期一致,circ-YAP在結直腸癌肝轉移組織中顯著上調(圖1G,H),曲線下面積(AUC)值為0.8433(圖1I)。更重要的是,高circ-YAP患者的生存時間比低circ-YAP患者短(圖1J)。綜上所述,這些數據表明,circ-YAP是一個真正的circRNA,可能用作CRC肝轉移的一個有前景的指標和預后標志物。
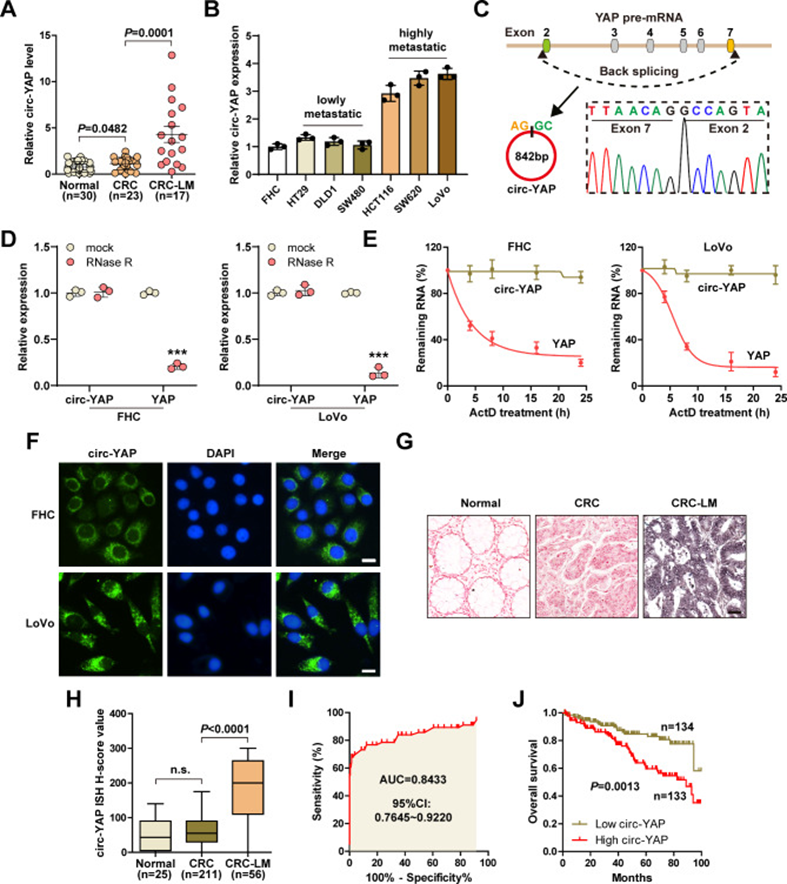
圖1 circ-YAP在結直腸癌肝轉移組織中的鑒定
2. 敲低circ-YAP可減輕結直腸癌肝轉移負荷
為了研究circ-YAP的生物學功能,研究者使用CRISPR/Cas13d技術沉默circ-YAP。如圖2A所示,設計的3種gRNA均能有效敲低circ-YAP,但不影響YAP mRNA的表達。劃痕實驗和transwell實驗顯示,沉默circ-YAP顯著抑制LoVo細胞的遷移(圖2B,C)和侵襲(圖2D,E)。接下來,研究者在circ-YAP低表達的CRC細胞中過表達circ-YAP(圖2F),結果顯示,circ-YAP過表達后細胞遷移和侵襲能力顯著增強(圖2G,H)。通過在NOD/SCID小鼠的腸壁內注射TC71 PDX細胞建立自發性結直腸癌肝轉移PDX模型(圖2I)。10周后,對照組50%的小鼠發生了肝轉移,而circ-YAP沉默組只有6.7%的小鼠發生了肝轉移(圖2J,K)。綜上所述,這些數據表明circ-YAP在CRC細胞侵襲性和肝轉移中起著至關重要的作用。
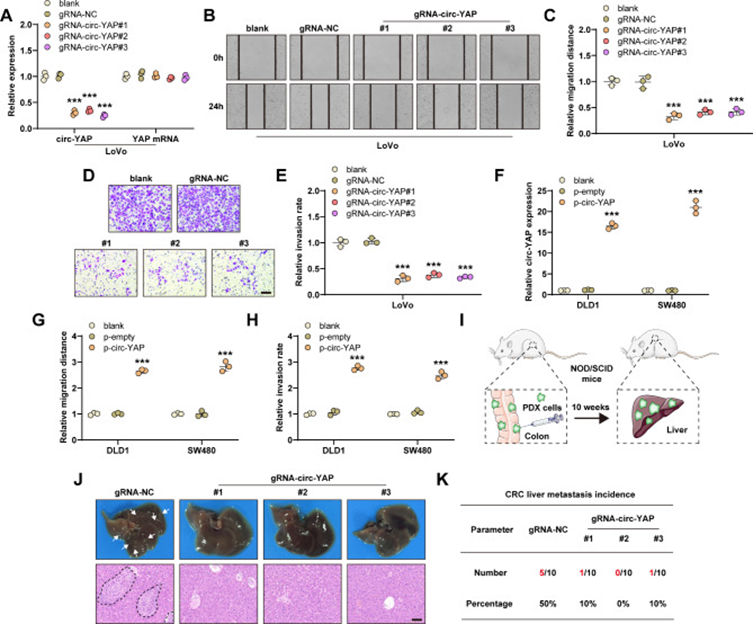
圖2 沉默circ-YAP可減輕結直腸癌肝轉移負荷
3. Circ-YAP編碼YAP蛋白異構體YAP-220aa
通過序列比對,研究者發現circ-YAP包含一個潛在的跨越ORF連接位點,編碼220-aa蛋白(圖3A,B)。為了驗證circ-YAP是可翻譯的,研究者在circ-YAP過表達載體中添加Flag標簽;其中,circ-YAP的連接位點被移動到ORF的終止密碼子,Flag序列被一分為二,位于circ-YAP的兩側(圖3C)。轉染HEK293T細胞后,flag tag抗體檢測到約26 kDa的條帶(圖3D)。考馬斯亮藍染色顯示,過表達circ-YAP后,這一條帶更加明顯,隨后,通過質譜分析驗證了YAP-220aa的獨特氨基酸序列(圖3E)。接下來,研究者制備了特異性靶向YAP-220aa的兔多克隆抗體,并證實其能有效檢測內源性YAP-220aa蛋白(圖3F)。鑒于circRNA的翻譯是由IRES或m6A修飾驅動的,研究者首先評估了IRES對circ-YAP的翻譯活性。值得注意的是,在翻譯起始位點的近端發現了一個高度保守的m6A位點“GGACA”(圖3B)。腺嘌呤突變為胞嘧啶后(圖3C),YAP-220aa蛋白幾乎無法被抗flag抗體檢測到(圖3D),這意味著m6A對circ-YAP翻譯至關重要。YAP-220aa主要定位于細胞質(圖3G),并且在高轉移CRC細胞中過表達(圖3H)。同樣,沉默METTL3顯著降低了內源性YAP-220aa的表達(圖3I),并且與低轉移的CRC細胞相比,高轉移的CRC細胞中circ-YAP的m6A富集更多(圖3J)。功能上,過表達circ-YAP增強了HT29和SW480細胞的遷移和侵襲,這些作用被m6A突變阻斷(圖3K,L)。此外,實驗肝轉移模型顯示,野生型circ-YAP增加了CRC細胞在體內的肝轉移(圖3M),而m6A突變型circ-YAP沒有增加(圖3M)。綜上所述,這些發現表明circ-YAP的功能是通過翻譯成一個新的YAP蛋白亞型,這是由m6A修飾介導的。
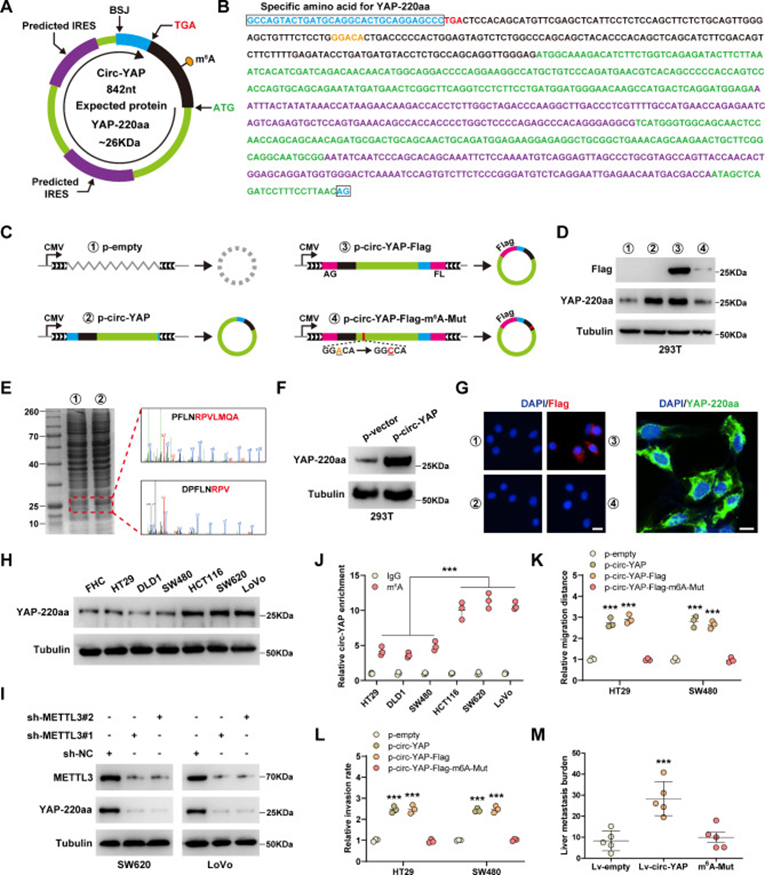
圖3 Circ-YAP編碼由m6A介導的YAP-220aa
4. 翻譯circ-YAP需要m6A閱讀器YTHDF3
研究者想知道哪些m6A閱讀蛋白參與了circ-YAP翻譯過程。如圖4A所示,敲低YTHDF3,而不是YTHDF1/2,顯著阻斷了由circ-YAP過表達引起的YAP-220aa水平升高(圖4A)。為了進一步驗證YTHDF3對circ-YAP翻譯的影響,研究者利用CRISPR/Cas9技術構建了YTHDF3敲除的CRC細胞株。結果表明,在YTHDF3?/?LoVo和SW620細胞中無法檢測到p-circ-YAP-Flag的翻譯產物(圖4B,C)。相反,YTHDF3過表達細胞中YAP-220aa的表達顯著增加,但這種作用在刪除活性YTH結構域后消失(圖4D)。RIP和RNA pull-down實驗結果揭示了circ-YAP和YTHDF3之間的相互作用(圖4E,F)。此外,體外合成circ-YAP并與GST-tag YTHDF3蛋白孵育,結果顯示circ-YAP直接結合YTHDF3(圖4G)。考慮到YTHDF3介導的翻譯調節需要非經典eIF4G2,研究者進行了Co-IP實驗,并證實YTHDF3和eIF4G2在SW620和LoVo細胞中形成內源性復合體(圖4H)。正如預期,沉默eIF4G2顯著降低了YAP-220aa蛋白水平(圖4I)。RNA pull-down實驗結果表明,eIF4G2和eIF4A/B被circ-YAP富集,而這些相互作用被YTHDF3敲除消除(圖4J,K),表明circ-YAP通過YTHDF3招募eIF4G2翻譯起始復合物。功能上,敲除YTHDF3或沉默eIF4G2后,circ-YAP引起的細胞侵襲增強被明顯抵消(圖4L,M)。
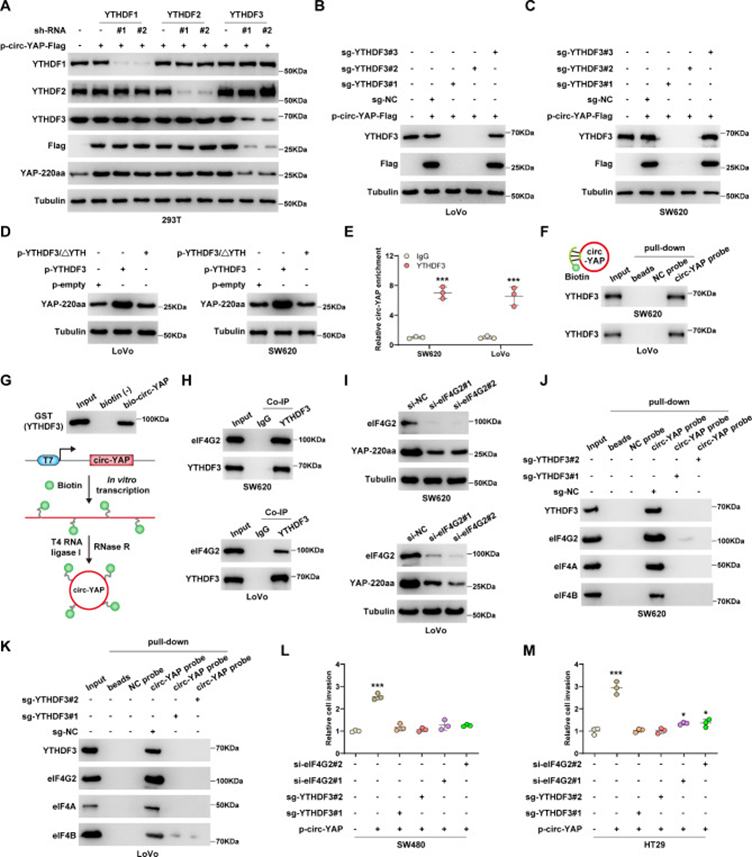
圖4 YTHDF3招募eIF4G2復合體來驅動circ-YAP翻譯
5. YAP-220aa與LATS1相互作用并增加YAP的核轉位
通過分析YAP-220aa蛋白序列,研究者發現YAP-220aa包含了YAP的WW1/2結構域,這是與LATS1相互作用所必需的,隨后YAP被14-3-3磷酸化并被保留在細胞質中。因此,研究者推測YAP-220aa可能與LATS1競爭性結合,從而阻斷YAP磷酸化。正如預期的那樣,在轉染p-circ-YAP-Flag載體的HEK293T細胞中,Flag-tag抗體大量免疫沉淀LATS1,然而,當WW1/2結構域被刪除后,上述現象消失(圖5A)。此外,在LoVo和SW620細胞中發現了YAP-220aa和LATS1之間的內源性結合(圖5B,C)。敲低circ-YAP顯著增加了YAP和LATS1, 14-3-3之間的相互作用(圖5D,E)。此外,在circ-YAP沉默的CRC細胞中,YAP-220aa減少,而YAP磷酸化增加,然而,這些作用被野生型circ-YAP過表達消除,但沒有被m6A突變的circ-YAP過表達消除(圖5F,G)。增強circ-YAP的表達導致更多的YAP從細胞質進入細胞核,m6A突變后這種現象消失(圖5H,I)。在circ-YAP沉默的CRC細胞中,YAP熒光素酶報告活性及其下游促轉移基因水平顯著降低(圖5J,K)。YAP敲低或使用YAP的藥物抑制劑維替泊芬治療后,circ-YAP誘導的侵襲和肝轉移結節被顯著消除(圖5L-N)。總之,這些數據表明,circ-YAP編碼的YAP-220aa通過與LATS1相互作用激活YAP從而促進CRC的侵襲性和肝轉移。
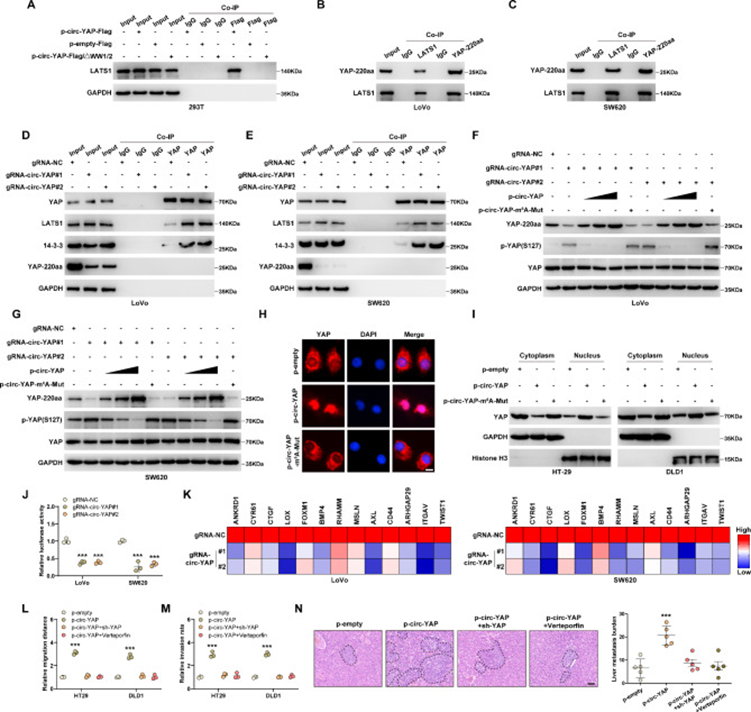
圖5 YAP-220aa增加YAP活性
6. YAP/TEAD復合體反轉錄激活circ-YAP
YAP是一種轉錄共激活因子,通過與一些轉錄因子結合來調節基因轉錄。有趣的是,YAP敲低或維替泊芬處理顯著降低了HEK293T和CRC細胞中的circ-YAP表達(圖6A)。值得注意的是,新生的circ-YAP也受到YAP和維替泊芬的影響(圖6B),這表明YAP在轉錄水平調節circ-YAP表達。越來越多的證據表明,一些circRNA具有獨立于其線性親本的自身啟動子。將circYAP的啟動子片段插入pGL3-basic載體中,熒光素酶結果顯示YAP在circ-YAP起始位點上游-974~-374處增加了circ-YAP的轉錄活性(圖6C)。通過JASPAR工具進行序列分析,在上述區域發現了兩個TEAD結合基序(TB1,-886~-877,TAAATACTAT;TB2,-406~-397,CATATTCTTT)(圖6D)。如圖6E、F所示,TB1或TB2的突變顯著降低了circ-YAP的啟動子活性,但當同時突變時,YAP-5SA引起的啟動子活性增強被完全抵消。此外,YAP-5SA增加了TEAD2沉默細胞中circ-YAP的表達,但并未增加TEAD1/3/4沉默細胞中circ-YAP的表達(圖6G,H),表明TEAD1/3/4負責yap介導的circ-YAP調控。此外,ChIP檢測的結果表明,YAP與TB1和TB2結合(圖6I),同時募集Pol II和隨后的磷酸化(圖6J,K),這是從起始復合物釋放Pol II和起始延伸所需的修飾。此外,ChIP-re-ChIP數據表明,YAP/TEAD1復合物在circ-YAP啟動子的TB1和TB2處富集(圖6L,M),這也通過使用生物素標記的探針進行的DNA下拉實驗進行了驗證(圖6N)。以上結果表明,circ-YAP被YAP轉錄激活,從而形成促進結直腸癌肝轉移的正反饋環路。
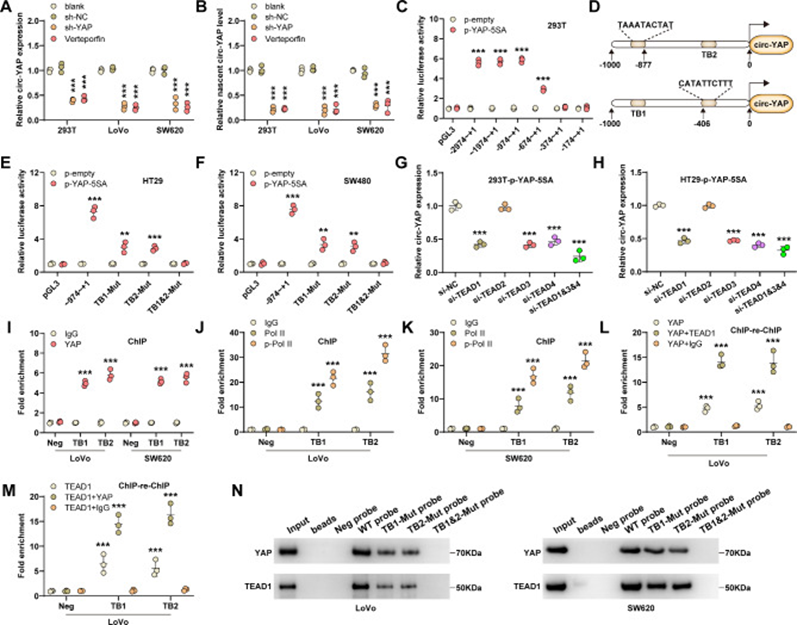
圖6 Circ-YAP是YAP激活的轉錄
7. circ-YAP/YAP-220aa/YAP調控軸的臨床驗證
最后,研究者檢測了YAP靶基因在結直腸癌組織中的表達。qRT-PCR結果顯示,circ-YAP表達與促轉移基因CYR61、CTGF、TWIST1和FOXM1呈正相關(圖7A-D)。此外,免疫染色結果顯示,92.5%的CRC病例具有相同的circ-YAP和YAP-220aa的表達趨勢,只有7.5%的病例具有不一致的表達趨勢(圖7E,F)。并且高circ-YAP與YAP的核聚集呈強正相關(圖7E,G)。YAP-220aa在有肝轉移的CRC中表達高于無肝轉移的CRC(圖7H),其AUC值為0.8597(圖7I),提示YAP-220aa可能作為預測CRC肝轉移的指標。重要的是,高circ-YAP和yap-220aa的患者比低circ-YAP和yap-220aa的患者生存時間更短(圖7J),表明兩者聯合比單獨circ-YAP具有更好的預后價值。
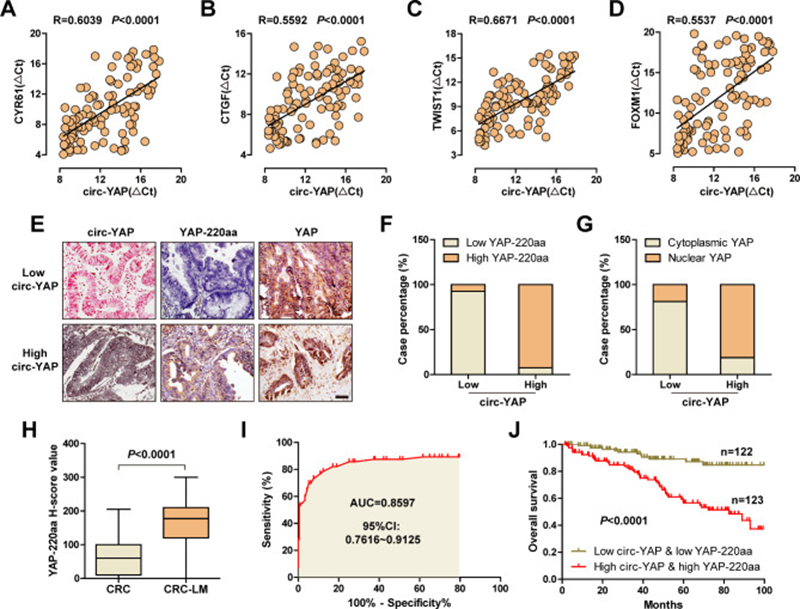
圖7 circ-YAP/YAP-220aa/YAP調控軸在臨床樣本中的驗證
結論:
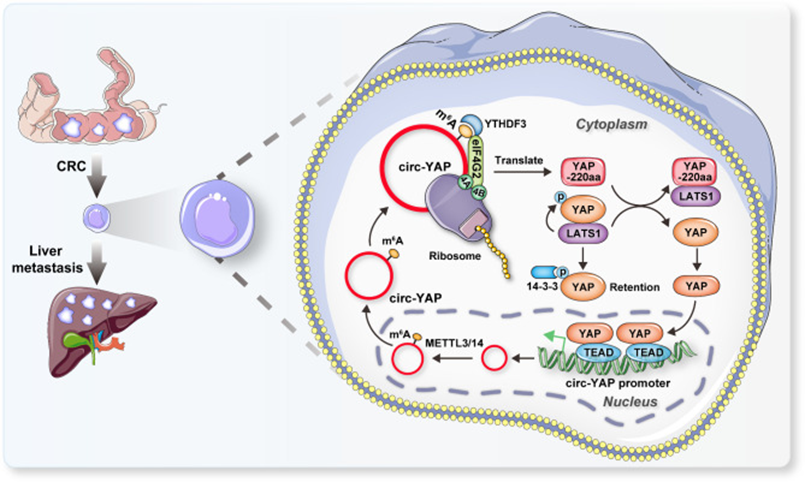
綜上所述,該研究揭示了circRNA編碼的蛋白和Hippo/YAP信號通路之間迄今未被識別的偶聯,對CRC肝轉移的治療具有指導意義。
實驗方法:
定量實時聚合酶鏈反應(qRT-PCR),熒光原位雜交(FISH),原位雜交(ISH),免疫組織化學(IHC),細胞轉染,傷口愈合實驗,Transwell實驗,CCK-8檢測,小鼠結直腸癌肝轉移模型的建立,蛋白質印跡,免疫共沉淀(Co-IP),免疫熒光(IF),RNA免疫沉淀(RIP),甲基化免疫沉淀(meRIP),RNA pull-down檢測,熒光素酶報告基因檢測,染色質免疫沉淀(ChIP),DNA pull-down檢測
參考文獻:
Zeng K, Peng J, Xing Y, Zhang L, Zeng P, Li W, Zhang W, Pan Z, Zhou C, Lin J. A positive feedback circuit driven by m6A-modified circular RNA facilitates colorectal cancer liver metastasis. Mol Cancer. 2023 Dec 13;22(1):202. doi: 10.1186/s12943-023-01848-1.






