PD-1- CD45RA+效應記憶CD8 T細胞和CXCL10+巨噬細胞 與晚期肝細胞癌中阿特朱單抗加貝伐單抗的反應相關
阿特朱單抗加貝伐單抗 (atezo/bev) 的組合極大地改變了晚期 HCC (aHCC) 的治療格局,在一些患者中實現了持久的緩解。使用單細胞轉錄組學,我們描述了接受 atezo/bev 治療的 aHCC 患者的腫瘤內和外周免疫環境。來自具有持久反應的患者的腫瘤富含 PDL1+ CXCL10+ 巨噬細胞,并且根據細胞-細胞相互作用分析,表達高水平的 CXCL9/10/11,并預計會吸引外周 CXCR3+ CD8+ 效應記憶 T 細胞 (CD8 TEM) 進入腫瘤。基于 T 細胞受體共享和偽時間軌跡分析,我們提出 CD8 TEM 優先分化為克隆擴增的 PD1- CD45RA+ 效應記憶 CD8+ T 細胞(CD8 TEMRA),具有明顯的細胞毒性。相比之下,在無反應者中,CD8 TEM 仍凍結在其效應記憶狀態。最后,在應答者中,CD8 TEMRA 顯示出與血液高度共享的 T 細胞受體,這與他們的巡邏活動一致。這些發現可能有助于了解 aHCC 中對 atezo/bev 反應的可能機制。
該研究于2023年11月發表在《Nature communications》,IF:16.6。
技術路線:
結果:
1、晚期HCC的腫瘤微環境和外周免疫系統
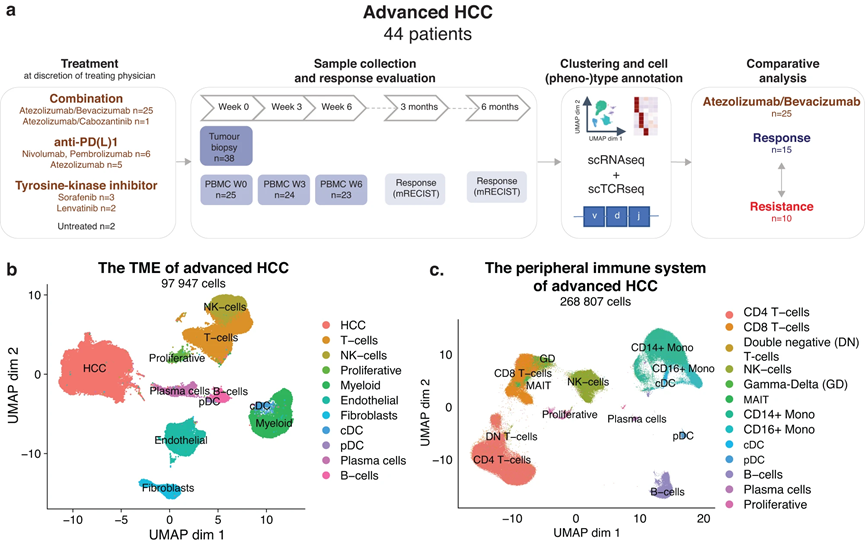
對 38 名aHCC 患者進行了治療前組織活檢,進行了scRNA-seq(圖 1a),從 97,947 個單細胞中獲得了高質量的轉錄組數據(圖 1b)。隨后的降維和聚類分析確定了幾個簇,根據標記基因表達分配給 T 細胞和 NK 細胞 (30%)、B 細胞 (5%)、髓系細胞 (12%) 和基質細胞類型 (12%)。我們還鑒定了一個增殖簇,主要由增殖的 T 細胞和一大群 HCC 癌細胞(40%)組成,表達與正常肝功能相關的基因(ALB、HP、FGA、FGB)和肝癌(AFP、SPINK1、GPC3、AKR1C1)。同樣,對連續治療(第 0-3-6 周)PBMC 樣本(n = 72,來自 25 名 aHCC 患者)進行單細胞分析,產生了 268,807 個 PBMC 的高質量轉錄組數據,并注釋為各自的使用標記基因識別細胞類型(圖1c)。這些數據共同提供了接受全身療法治療的 aHCC 患者的 TME 和外周免疫系統的獨特細胞圖譜,并為未來的研究工作提供了寶貴的資源。
2、腫瘤內 T/NK 細胞組成不同于外周 T/NK 細胞組成
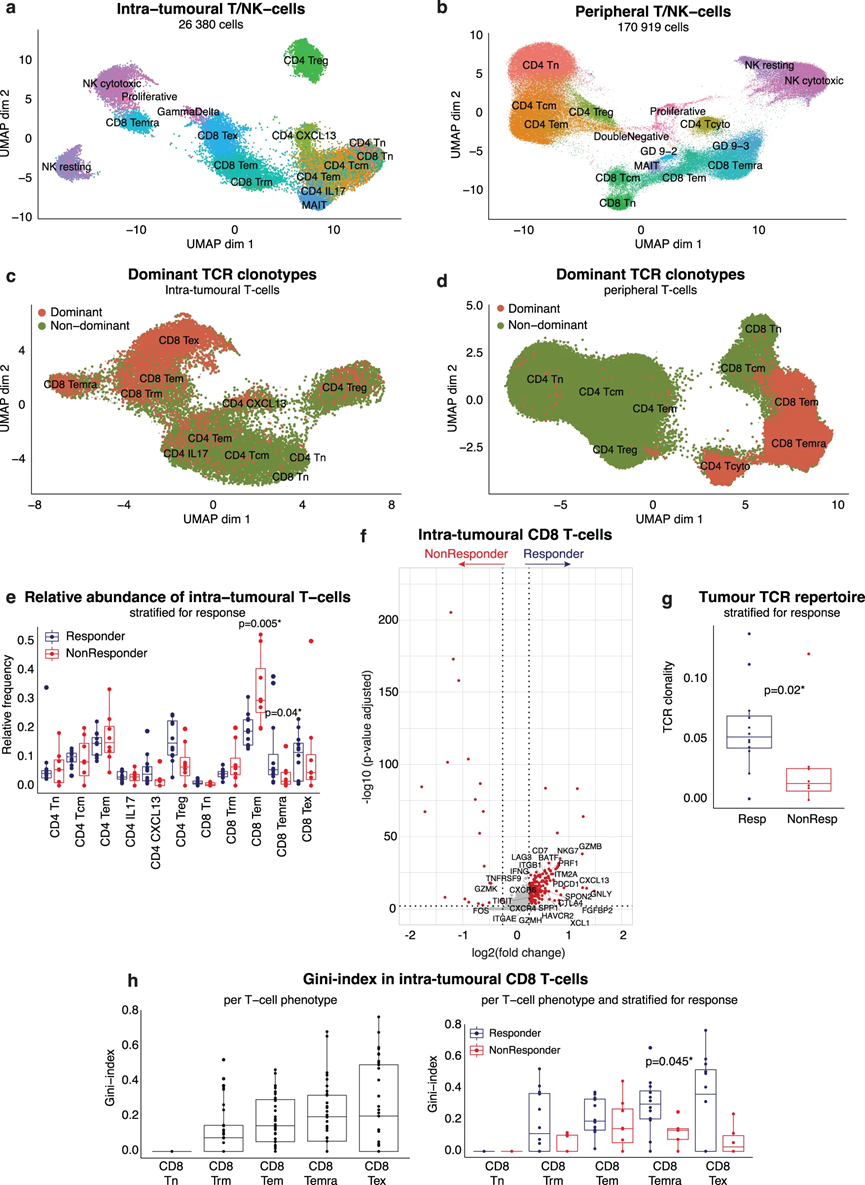
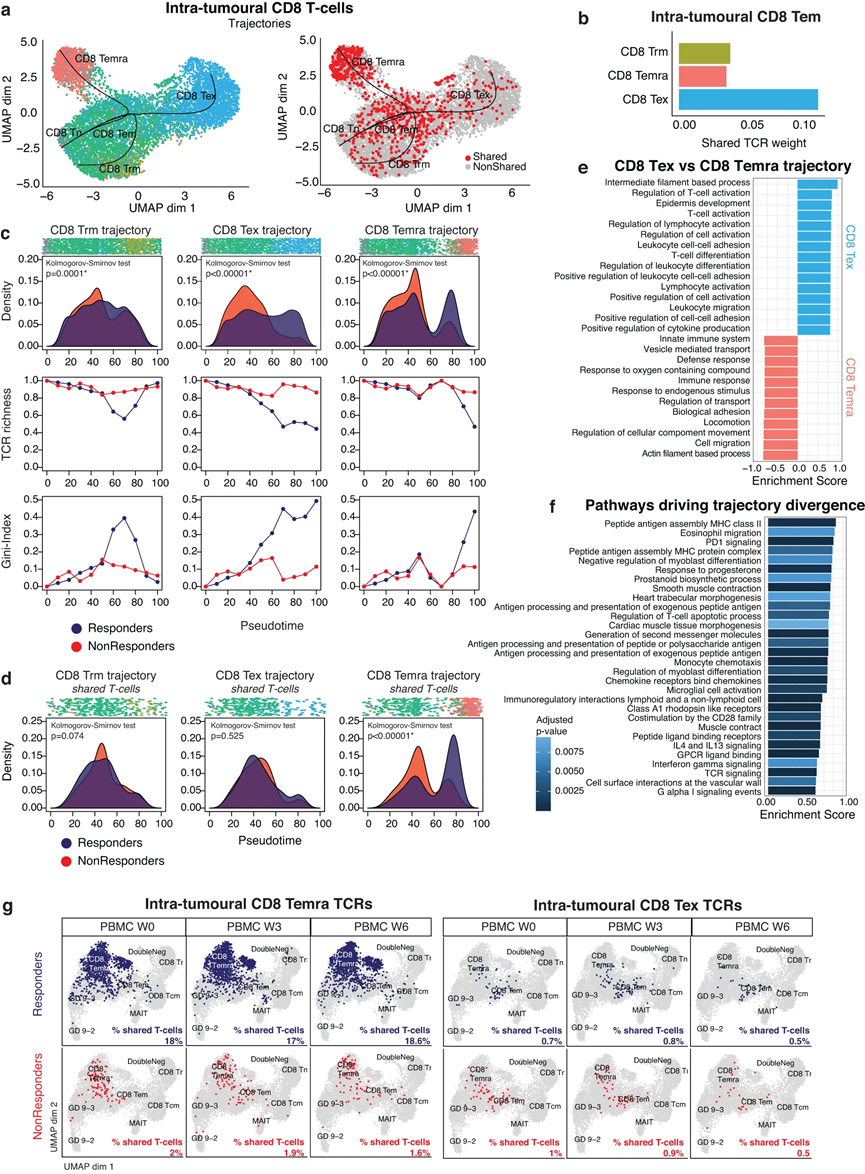
首先,我們更詳細地探索了 TME 和外周血的 T/NK 細胞劃分。分別對總共 26,380 個腫瘤內 T-/NK 細胞和 170,919 個外周 T-/NK 細胞(PBMC 的 64%)進行亞聚類,我們鑒定了 CD4 T 細胞、CD8 T 細胞和自然殺傷細胞的幾種表型細胞(NK細胞)(圖2a,b)。值得注意的是,CD4(CD4 CXCL13)和CD8(CD8 TEX)“耗盡”T細胞是TME所獨有的,其特征是PDCD1(PD1)和其他已知耗盡標記物的最高表達。根據典型標記基因(CX3CR1、SPON2、FGFBP2)的表達,我們在TME和外周血中鑒定出了CD45RA效應記憶CD8 T細胞(CD8 TEMRA)。我們使用 TotalSeq-C 數據證實了它們在蛋白質水平上的 CD45RA 表達。重要的是,CD8 TEMRA 在表型上相似,并且聚集在細胞毒性 NK 細胞附近,但根據其 CD8(CD8A、CD8B)的表達和有效 TCR 序列的檢測進行區分。
結合scRNA-seq和scTCR-seq,我們在TME中鑒定出17,842個T細胞攜帶12,690個獨特的TCR,而115,711個外周T細胞攜帶90,188個獨特的TCR序列。我們根據相同的 TCR 序列鑒定了 TCR 克隆型,并將顯性克隆型定義為由 >5 個 T 細胞共享的 TCR。在腫瘤內 T 細胞中,優勢克隆型集中在效應細胞(CD8 TEM、CD8 TEMRA)和“經歷過抗原”的 T 細胞簇(CD8 TEX、CD4 CXCL13;圖 2c)內,而非優勢克隆型主要發現于初始、記憶或調節性 T 細胞亞型。同樣,主要的外周 T 細胞克隆型與腫瘤中的表型對應物一致,集中在外周效應 T 細胞內(CD8 TEM、CD8 TEMRA、CD4 TCYTO;圖 2d)。
簡而言之,雖然表型不同,但 CD8 效應 T 細胞(CD8 TEM、CD8 TEMRA)和 CD8 耗竭 T 細胞(CD8 TEX)在腫瘤和外周血中均具有顯性 T 細胞克隆型特征。
3、克隆擴增的 CD8 TEMRA 與阿特朱單抗/貝伐單抗的反應相關
為了確定與 atezo/bev 反應相關的 CD8 T 細胞表型,我們比較了有反應者和無反應者之間腫瘤和外周免疫系統的幾個特征,包括 i) 腫瘤內 CD8 T 細胞的豐度,ii)腫瘤和外周 TCR 庫以及 iii) 腫瘤和血液之間 TCR 共享的程度。
首先,比較有反應者和無反應者之間 TME 中各種 T 細胞表型的相對豐度,我們發現 CD8 TEMRA 在有反應的腫瘤中更豐富(p = 0.04),而 CD8 TEM 在無反應者中增加(p = 0.005;圖2e)。值得注意的是,盡管CD8 TEX表達了最高水平的治療靶點PDCD1(PD1),但它們在TME中的存在并沒有根據反應而不同(圖2e)。 TME 中 CD8 T 細胞的差異基因表達揭示了細胞毒性基因(GZMB、GNLY、PRF1、GZMH)和典型 CD8 TEMRA 標記(FGFBP2、FCGR3A)的上調,表明 CD8 TEMRA 可能在實現對 atezo/bev 的持久反應中發揮重要作用(圖2f)。相比之下,無反應的腫瘤更具記憶性(FOS),并且 GZMK(一種典型的 CD8 TEM 標記物)上調(圖 2f)。其次,有反應的腫瘤的特點是具有更多克隆性的治療前 TCR 庫,而無反應者則表現出更豐富、更多樣化的非克隆基線 TCR 庫(圖 2g)。計算基尼指數時,考慮到 TCR 均勻度(1-克隆性)和 TCR 豐富度,對于每個 CD8 T 細胞表型,腫瘤內 CD8 TEM、CD8 TEMRA 和 CD8 TEX 的克隆擴增程度最高(圖 2h 左)。重要的是,當對atezo/bev的反應進行分層時,與無反應者相比,有反應的腫瘤中的CD8 TEMRA具有顯著更高的基尼指數(p = 0.045;圖2h右)。相反,在比較應答者與非應答者時,我們沒有檢測到 CD8 TEM 和 CD8 TEX 克隆擴增的顯著差異。這些發現表明,治療前存在于 TME 內的克隆擴增的 CD8 TEMRA 可能有助于 aHCC 中對 atezo/bev 的反應。
4、TCR 共享證實 CD8 TEMRA 是 aHCC TME 中的關鍵效應 T 細胞
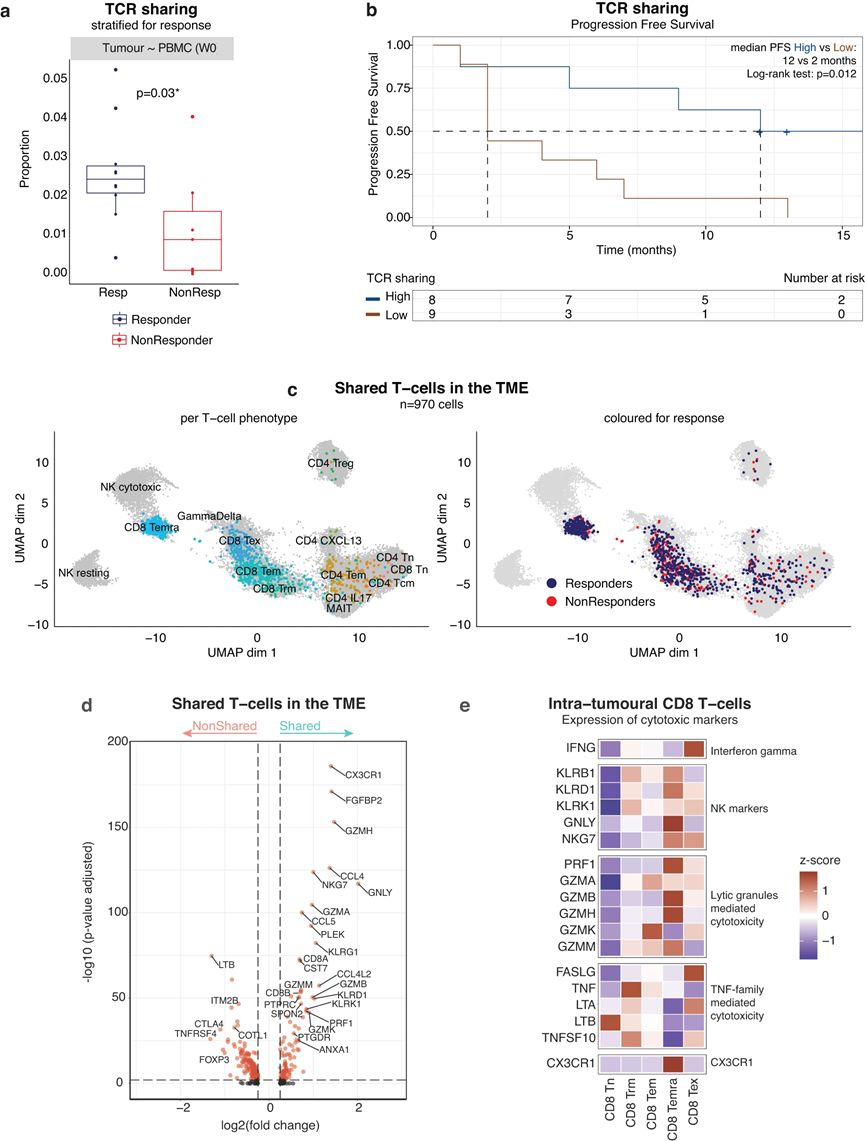
由于與外周血T細胞共享相同TCR序列的腫瘤內T細胞更有可能具有腫瘤反應性,因此我們在17例接受atezo/bev治療的患者中探索了腫瘤和PBMCs之間共享的TCR,其中10例對atezo/bev有反應。我們特別關注治療開始前(PBMC第0周)腫瘤和外周血中存在的TCR序列,假設這些共享的TCR代表了針對腫瘤和由腫瘤驅動的基線免疫反應。共檢測到403個獨特的共享的,可能是“腫瘤特異性”的TCRs,約占腫瘤中檢測到的所有TCRs的7.1%,而在外周血中檢測到的所有TCRs的0.6%。為了校正每個樣本中檢測到的T細胞數量,我們計算了共享TCR相對于PBMCs中檢測到的TCR總數的比例,發現應答者顯示出更高程度的TCR共享(平均2%;P = 0.03;圖3 a)。在共享外周T細胞的比例中檢測到類似的趨勢。重要的是,TCR共享的增加與顯著較長的PFS相關(中位PFS為12個月vs 2個月;P = 0.012;圖3b),支持我們的假設,即TCR共享可能確實鑒定了腫瘤內真正靶向腫瘤的部分T細胞。
將這些共享TCRs與TME中的T細胞表型聯系起來(圖3c左),發現大多數代表CD8 T細胞,集中于CD8效應亞型(CD8 TEM和CD8 TEMRA)。事實上,63%的CD8 TEMRA和22%的CD8 TEM在治療前的外周血中也檢測到TCR,而CD8 TEX在治療前的外周血中也檢測到TCR (13%)。與這些發現一致,差別基因表達表明,在共享TCRs的腫瘤內T細胞(n = 970個共享T細胞)中,CD8 (CD8A和CD8B)和細胞毒性標記(GZMA、GZMB、GZMH、GNLY、PRF1)以及典型的CD8 TEMRA標記(CX3CR1、SPON2、FGFBP2)過表達。相反,只在腫瘤中發現的攜帶TCR的T細胞富集了耗竭標志物(CTLA4)和調節基因(FOXP3、TNFRSF4;圖3 d)。重要的是,雖然共有的CD8 TEM存在于治療有效組和治療無效組的TME中(分別占所有瘤內CD8 TEM的18%和8%),共有的CD8 TEMRA幾乎只出現在治療有效組的腫瘤中(在所有瘤內CD8 TEMRA中,治療有效組為57%,而治療無效組為6.1%;圖3c右)。
CD8 TEMRA被描述為“近期激活的”CD8效應記憶T細胞。不表達PDCD1或其他傳統上與抗原經歷相關的標記物。相反,它們在抗原刺激后重新表達CD45RA。它們被認為是一種哨兵樣T細胞表型,在抗原頻繁接觸的炎癥部位巡邏。基于它們高表達的細胞毒性標記(PRF1, NKG7, GZMA, GZMB, GZMH, GNLY;圖3e),其依賴于T細胞及其靶細胞和指導其遷移到炎癥組織的組成性表達受體之間的直接相互作用(CX3CR1)。
5、與腫瘤抗原的相互作用驅動腫瘤內向 CD8 TEMRA 分化
為了深入了解 TME 中 CD8 TEMRA 的起源,我們使用 Slingshot 計算了腫瘤內 CD8 T 細胞的偽時間軌跡。我們認為 CD8 初始 T 細胞(CD8 TN)是軌跡的根源,因為它們具有最高的 TCR 豐度。與之前的報道一致,初始 T細胞連接到TEM細胞,然后分成三個不同的軌跡,將初始 T細胞和TEM T細胞連接到TRM、TEMRA和TEX(圖4a左)。 TCR 豐富度沿著每條軌跡下降。 CD8 TEM顯示大多數TCR克隆型與TEX重疊,但也與TEMRA和TRM重疊(圖4b),而屬于不同譜系的T細胞之間幾乎沒有TCR重疊,這支持了三種軌跡的有效性。沿每個軌跡分析標記基因證實了它們的功能注釋。
當繪制沿每個軌跡的 T 細胞密度時,我們發現響應者和非響應者之間存在顯著差異。應答者中的腫瘤內 CD8 T 細胞能夠進化為更加分化的表型,這種效應在 TEMRA 軌跡中最為明顯,而無應答者似乎凍結在假時間的早期階段(p < 0.001;圖 4c) 。沿著有反應的腫瘤的 TEMRA 和 TEX 軌跡,基尼指數穩步增加。重要的是,當評估沿著 CD8 軌跡的共享 T 細胞的密度時(圖 4a 右),我們發現這些細胞在應答者的 TEMRA 軌跡末端明顯富集(圖 4d)。相比之下,沿著 TEX 軌跡,在 TEM 階段,應答者和非應答者的 T 細胞密度都達到最大。
然后,我們使用 TradeSeq 來識別沿 TEMRA 與 TEX 軌跡差異表達的基因組(使用 diffEnd 測試)。來自 REACTOME 或“GO:生物過程”基因集的總共 13 條途徑和 46 條途徑分別在 CD8 TEMRA 和 TEX 軌跡中顯著富集。重要的是,TEMRA軌跡以與先天樣免疫相關的途徑為主(圖4e),反映了它們作為通過直接細胞毒性消除癌細胞的有效效應T細胞的作用。相比之下,TEX 軌跡富含涉及 IFNG 信號傳導以及免疫細胞激活和分化的途徑。為了了解哪些因素驅動這種雙重分化,我們再次使用 TradeSeq 評估軌跡分歧點之前和之后表達模式的差異(使用 EarlyDEG 測試),并發現總共 333 條途徑被富集。重要的是,涉及抗原結合的途徑排名最高,表明進一步分化需要與抗原直接相互作用(圖4f)。
最后,為了研究治療中的免疫反應,我們使用了治療前 PBMC 和 TME 中存在的共享 TCR 克隆型,將它們與外周血中的表型聯系起來,并在治療期間(第 0-3-6 周)采樣的 PBMC 中跟蹤它們在治療過程中的演變。首先,在 TME 中表征 CD8 TEMRA 的 422 個獨特 TCR 主要在外周 CD8 TEMRA 中發現。治療前,它們占應答者所有 CD8 外周 T 細胞的 18%(6575 個外周 CD8 T 細胞中的 1183 個),而在無應答者中僅占 2%(圖 4g 左)。追蹤治療期間的演變,有反應者的 TCR 共享程度仍然很高(6 周后為 18.6%),而我們沒有觀察到無反應者有任何顯著變化(第 6 周為 1.6%;圖 4g 左)。這與 TME 中 CD8 TEX 中發現的 1065 個獨特 TCR 形成鮮明對比,在應答者和非應答者中,在不到 1% 的 CD8 外周 T 細胞中發現了這些 TCR(圖 4g 右)。此外,在治療期間,在腫瘤內 CD8 TEX 中發現的這些 TCR 并未出現在外周血中。
總而言之,這些數據表明,雖然 CD8 TEM 存在于應答者和非應答者的 TME 中,但在受到腫瘤抗原刺激后,CD8 TEM 更有可能在應答者中分化為 CD8 TEMRA,從而可能導致直接抗-腫瘤細胞毒性。此外,CD8 TEMRA 在應答者中顯示出與 PBMC 顯著的 TCR 共享,并且在使用 atezo/bev 治療后繼續這樣做,這與它們的巡邏表型一致。相比之下,從 CD8 TEM 到 CD8 TEX 的腫瘤內分化在atezo/bev 的應答者和無應答者中同樣發生,并且 CD8 TEX 在治療前不與血液共享 TCR,在atezo/bev 治療期間也不會出現。
6、表達促炎性 PDL1 的 CXCL10+ 巨噬細胞與反應相關
雖然腫瘤內 CD8 TEMRA 與隨后對 atezo/bev 的反應相關,但它們不表達 PDCD1 (PD1)。因此,我們想知道 aHCC 中 atezo/bev 的真正靶點是否可能在表達 PDL1 的細胞中找到。 TME 中 CD274 (PDL1) 的表達普遍較低,但在髓系細胞中可清晰檢測到。因此,我們將 11,678 個髓系細胞亞聚類為單核細胞/巨噬細胞 (n = 10 609) 和樹突細胞 (DC;n = 764)。在單核細胞/巨噬細胞區室中,我們鑒定了幾種與腫瘤相關的巨噬細胞(TAM)亞型(圖5a),其中大多數表達高水平的抗炎標志物,表明aHCC中主要是免疫抑制性基線TME。然而,我們還發現了促炎性CXCL10+ TAM,其特征是參與T細胞募集(CXCL9、CXCL10)和干擾伽瑪信號傳導(STAT1、IDO1、GBP1)的基因高表達。
比較有反應和無反應腫瘤之間各種 TAM 亞型的相對豐度,我們發現無反應者具有更高豐度的表達 TREM2 的巨噬細胞,這些巨噬細胞之前被鑒定為 HCC 腫瘤中的免疫抑制性巨噬細胞,它們的存在與抗 PD1 療法的耐藥性有關。差異基因表達顯示,有反應的腫瘤巨噬細胞區室中涉及 T 細胞募集(CXCL9、CXLC10)和干擾素-γ 活性(GBP1、STAT1)的基因富集,而無反應者則富集免疫抑制標記物(GPNMB、CCL18;圖5b)。有反應的腫瘤還表現出較高水平的 CCL2,這是一種有效的單核細胞吸引趨化因子,但也參與將其他免疫細胞招募到 TME 中。最后,應答者表現出較高的 SPP1 表達,此前該表達與肺癌 CPI 單一療法的應答相關。其他通路分析證實,響應腫瘤的巨噬細胞在促炎通路中富集。重要的是,平均而言,應答者的髓系細胞表達顯著更高水平的 CD274(圖 5c 頂部)。更具體地說,CD274 表達在 Macro CXCL10 中最高,而源自響應腫瘤的 Macro CXCL10 顯示出更高的 CD274 表達(圖 5c 底部)。 Macro CXCL10 中 CD274 (PDL1) 的高表達也與較長的 PFS 相關(中位 PFS 為 13 個月與 3 個月;p = 0.035;圖 5d)。總而言之,對 atezo/bev 的反應與治療前 TME 中激活的、促炎的、表達 PDL1 的骨髓成分相關。
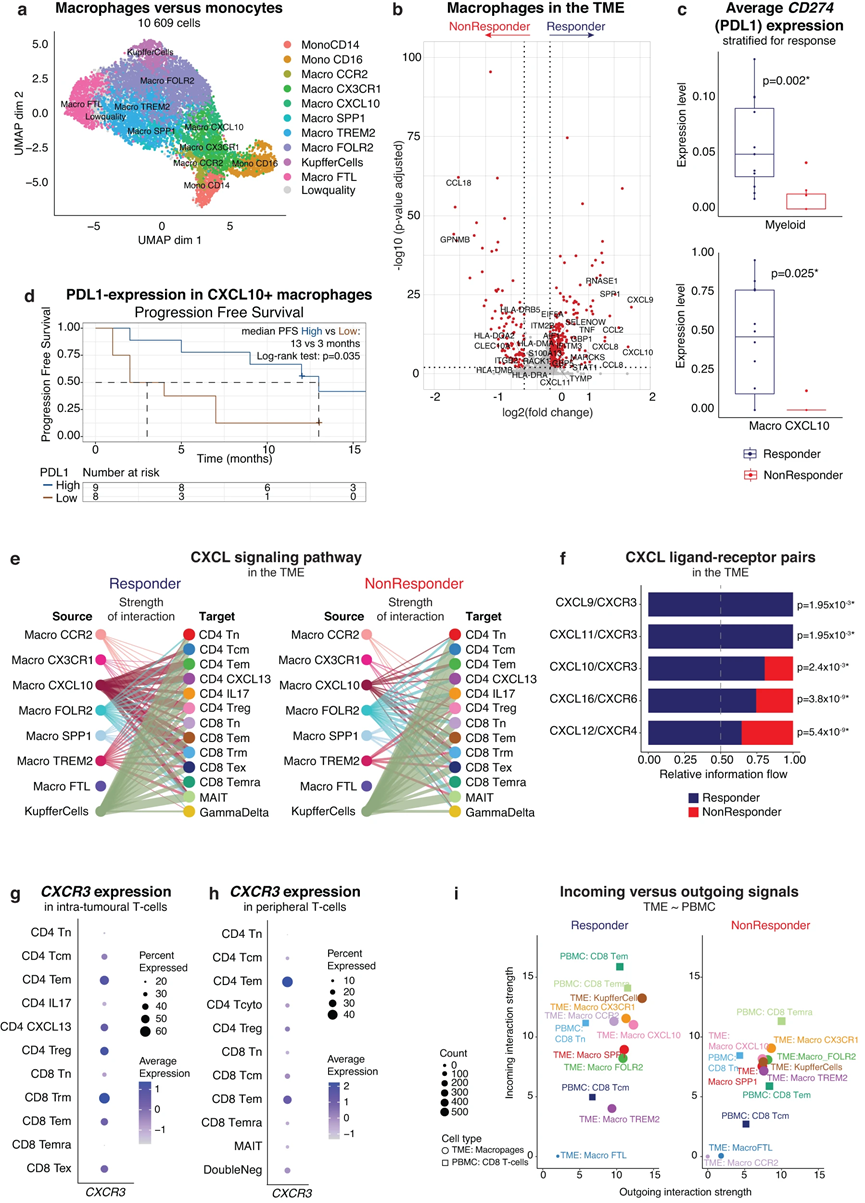
7、表達 PDL1 的 CXCL10+ 巨噬細胞將效應記憶 T 細胞招募到 TME 中
腫瘤相關巨噬細胞與外周 T 細胞招募至 TME 相關。因此,我們使用 CellChat 來預測髓系細胞和 T 細胞之間的受體-配體相互作用。首先,分別計算應答者和非應答者 TME 中免疫細胞類型之間的顯著相互作用,我們發現總體而言,應答者表現出更多的相互作用可能性。重點關注 CXCL 信號通路網絡,我們發現所有患者的肝臟駐留巨噬細胞和 T 細胞之間都存在預測的相互作用,無論反應如何。相反,與無反應者相比,有反應的腫瘤顯示出更多可預測的CXCL10+巨噬細胞和T細胞區室之間的相互作用(圖5e)。雖然CXCL12/CXCR4相互作用幾乎完全起源于Kupffer細胞,在應答者和非應答者中均發現,但與非應答者相比,CXCL9/10/11和CXCR3配體-受體對在應答者中顯著富集(圖5f) 。
在TME中,CXCR3在幾種激活的T細胞亞型(即CD4 CXCL13和CD8 TEX,以及CD4 TEM和CD8 TEM,圖5g)中顯著表達,但不在CD8 TEMRA中表達,并且沿著TEMRA軌跡,CXCR3表達達到其峰值位于效應器記憶狀態。在外周T細胞中,CXCR3主要在效應記憶T細胞中表達(圖5h)。基于這些發現,我們假設 CXCR3 與其配體 CXCL9/10/11 之間的相互作用在將外周 CD8 效應記憶 T 細胞 (CD8 TEM) 招募到 TME 中起著重要作用。為了證實這一點,我們再次使用 CellChat 探索腫瘤內巨噬細胞和外周 CD8 T 細胞之間的受體-配體相互作用。事實上,考慮到所有細胞間通訊網絡,我們發現 CD8 外周 T 細胞是應答者中最主要的信號“接收器”(圖 5i),與無應答者中的表型對應物相比,傳入信號的水平更高腫瘤。此外,在CXCL信號通路內,與無反應者相比,有反應者的腫瘤內CXCL10+巨噬細胞與外周CD8 TEM之間有更多預測的相互作用。
總體而言,這支持了以下觀點:腫瘤內髓樣區室(其特征是應答者中 CXCL9/10/11 表達上調)可能參與 TME 中 CXCR3+ 效應記憶 T 細胞的招募和激活,可能發揮作用在確定對 atezo/bev 的反應中發揮作用。
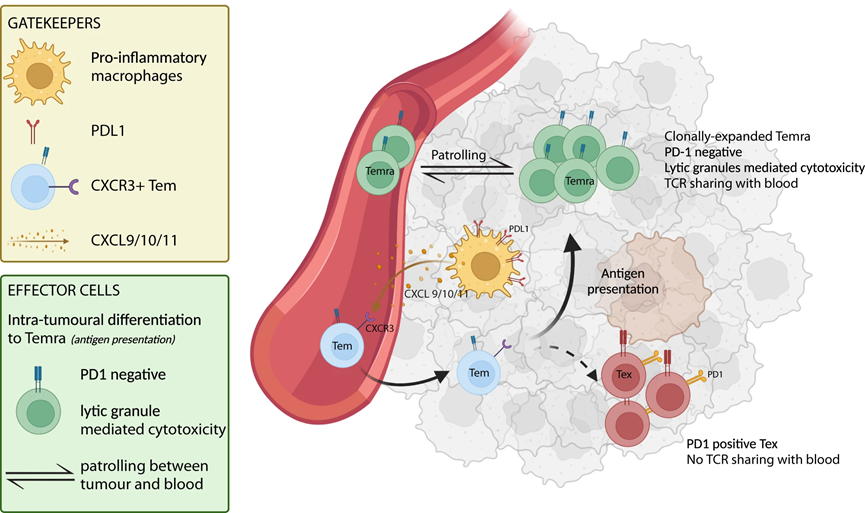
8、CD8 TEMRA 和 CXCL10+ 巨噬細胞作為 aHCC 中阿替珠單抗/貝伐單抗反應的預測生物標志物
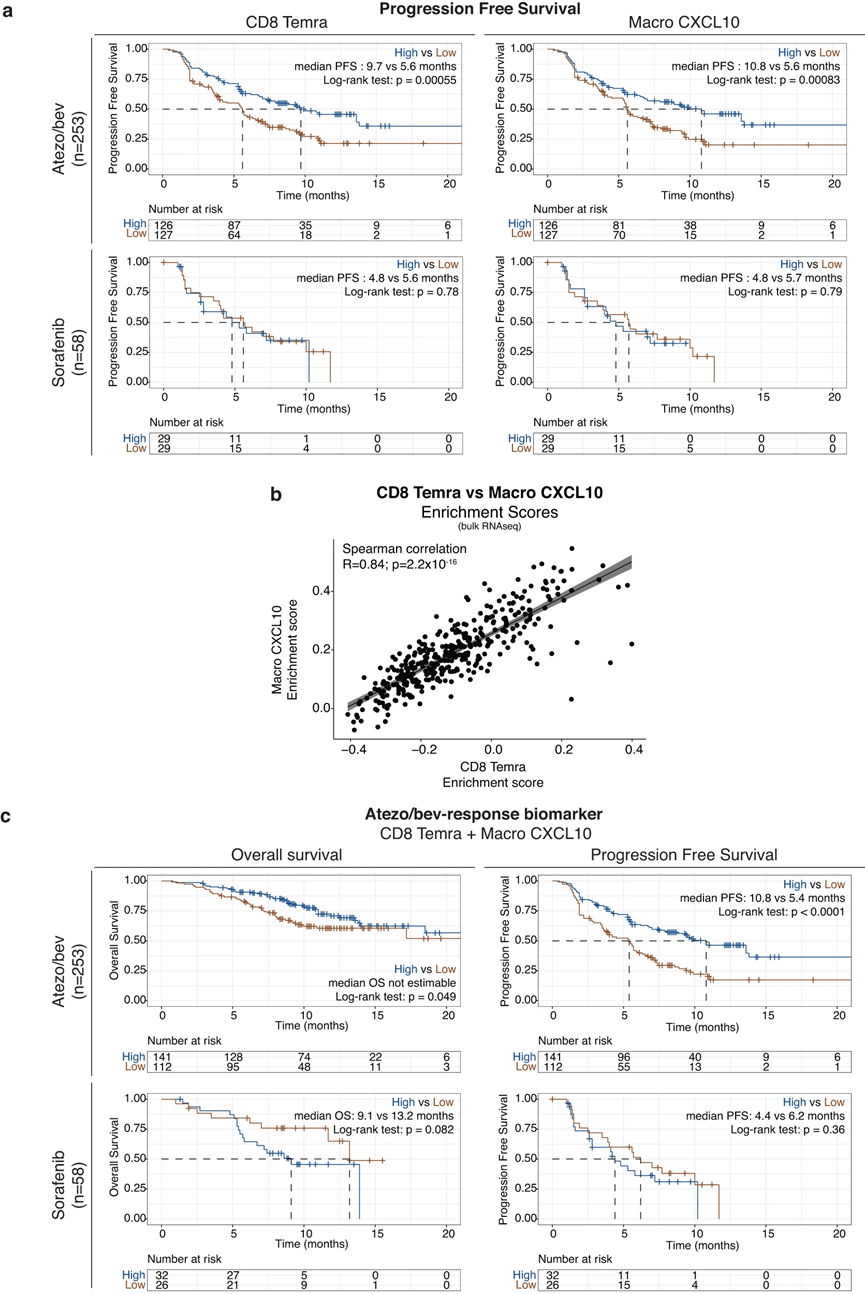
使用 scRNAseq,我們確定了克隆擴增的細胞毒性 CD8 TEMRA 作為可能的效應細胞,驅動對 atezo/bev 的反應,而 CXCL10+ 巨噬細胞 (Macro CXCL10) 可能作為看門人,負責招募啟動的效應記憶外周 T 細胞(圖 6)。接下來,我們的目的是驗證這些單細胞衍生的發現,并探索 CD8 TEMRA 和 Macro CXCL10 作為 aHCC 中 atezo/bev 反應的預測生物標志物的潛力。通過計算接受 atezo/bev (n = 253) 與索拉非尼 (n = 58) 治療的 aHCC 患者的 311 例治療前腫瘤活檢的轉錄組數據中每個樣本的 CD8 TEMRA 和 Macro CXCL10 富集評分,我們發現高 CD8 TEMRA 和 Macro CXCL10 富集評分在atezo/bev治療的患者中,CXCL10富集評分與顯著較長的PFS相關(圖7a頂部),但在索拉非尼治療的患者中則不然(圖7a底部)。此外,TME 中 CD8 TEMRA 和 Macro CXCL10 的存在密切相關(R = 0.84;p < 0.00001;圖 7b),支持它們一起填充 aHCC 的 TME 的觀點。事實上,將 CD8 TEMRA 和 Macro CXCL10 標記基因組合到單個基因集中,我們發現“atezo/bev 反應生物標記物”富集得分較高的 atezo/bev 治療患者的 OS 和 PFS 顯著延長(p = 0.049、 p < 0.0001),在索拉非尼治療的患者中未觀察到這種關聯(圖7c)。綜上所述,aHCC 患者治療前 TME 中 CD8 TEMRA 和 Macro CXCL10 的聯合存在與 atezo/bev 治療結果的改善相關,特別是驗證了單細胞衍生的發現并強調了 'atezo 的潛在價值“/bev-反應生物標志物”作為 aHCC 中對 atezo/bev 反應的預測生物標志物。
實驗方法:
scRNA-seq、T 細胞庫分析、細胞表面表位分析、TotalSeq-C、V(D)J 分析、TCR 共享、軌跡推斷分析、CellChat。
參考文獻:
Cappuyns, S., Philips, G., Vandecaveye, V. et al. PD-1- CD45RA+ effector-memory CD8 T cells and CXCL10+ macrophages are associated with response to atezolizumab plus bevacizumab in advanced hepatocellular carcinoma. Nat Commun 14, 7825 (2023).






