BMP2/GDF5和BMP4/GDF5異源二聚體的形成和表征
實驗方法:Western blots,細胞培養,熒光素酶報告分析,表面等離子體共振,非洲爪蟾發育測定,斑馬魚信號分析,晶體學,結構分析與建模
TGFβ家族的蛋白質主要作為同源二聚體被研究,也已知形成具有不同于其組成的同源二聚體的生物活性的異二聚體。例如,骨形態發生蛋白的異二聚體,包括BMP2/BMP7、BMP2/BMP6和BMP9/BMP10等,已經說明了這些異二聚蛋白在TGFβ信號轉導中的重要性。在本研究中,我們確定了成熟的GDF5可以與成熟的BMP2或BMP4結合形成BMP2/GDF5和BMP4/GDF5異源二聚體。這種BMP2或BMP4單體與具有低硫酸肝素親和力的GDF5單體的組合產生了具有中等親和力的異源二聚體。使用肝素親和層析純化異質二聚體蛋白,我們隨后確定BMP2/GDF5和BMP4/GDF5異質二聚體在一系列細胞和體內系統中始終有效地發出信號,而其同質二聚體對應物的活性則更多地依賴于環境。這些差異可能是由1型受體Alk3和Alk6的聯合親和力的增加所驅動的。此外,測定了BMP2/GDF5異源二聚體的X射線晶體結構,強調了兩個不對稱的1型受體結合位點的形成,這兩個結合位點都是相對于同型二聚體獨特的。最終,這種異源二聚體生產方法獲得了一種相對于同型二聚體配體具有獨特性質的信號分子,包括對多種1型的高親和力和中等的肝素結合親和力。本文于2023年2月發表于BMC Biology (IF=7.364)。
技術路線:

結果:
(1) GDF5/BMP2和GDF5/BMP4異源二聚體的產生和驗證
由于BMP2和GDF5同型二聚體都可以通過細菌包涵體的氧化再折疊產生和純化,我們假設可以通過修改氧化再折疊方案來形成BMP2/GDF5異型二聚體。純化并溶解BMP2和GDF5包涵體,在氧化復折疊前以1:1的摩爾比混合。然后讓BMP2和GDF5的混合物再折疊5天。重折疊后,BMP2和GDF5同型二聚體通常通過肝素親和層析從不正確折疊的種中分離出來,其中BMP2二聚體用高鹽洗脫,而GDF5結合較弱,用低鹽濃度洗脫。我們假設異源二聚體可能對肝素表現出中間親和力。因此,我們將BMP2/GDF5的復折疊混合物應用于肝素柱,在洗脫時確定了三個獨立的峰(圖1C)。SDS-PAGE和Western blots分析表明,在還原和非還原條件下,第一個峰含有GDF5同型二聚體,最后一個峰含有BMP2同型二聚體。中間峰由包含BMP2和GDF5鏈的單一二聚體組成(圖1C)。為了驗證我們的異源二聚體形成方法,我們用BMP4和GDF5重復了這一過程。同樣,從肝素洗脫譜中鑒定出三個峰,中間的峰由BMP4/GDF5異源二聚體組成(圖1D)。這些結果表明,BMP2/GDF5和BMP4/GDF5異質二聚體都可以通過氧化復折疊生成,并分離出同源性進行進一步分析。
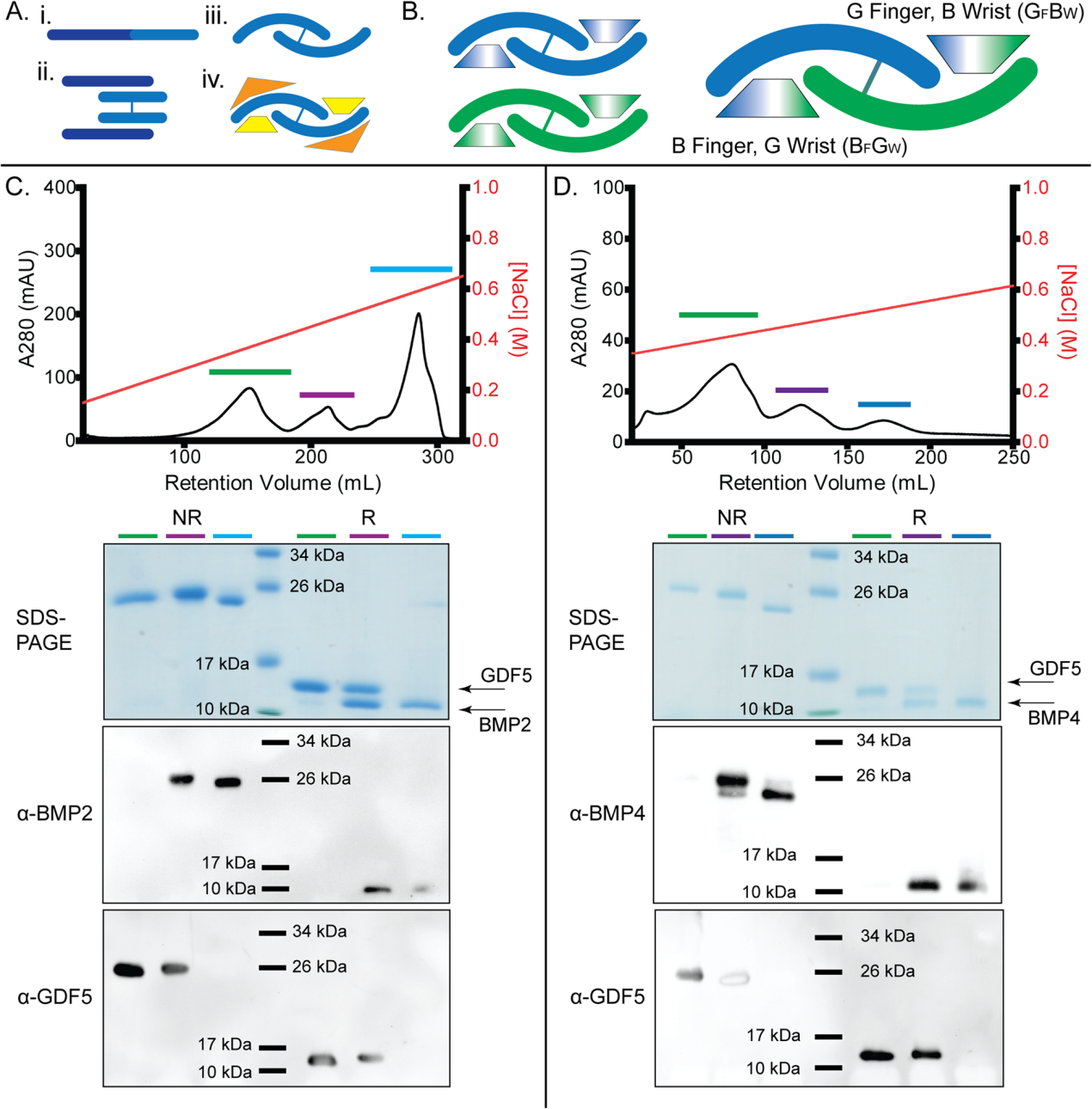
圖1:天然BMP生產和異質二聚體制造的原理圖
(2) 體外異二聚體和同二聚體信號的比較
先前對其他BMP異二聚體(特別是BMP2/7和BMP2/6)的研究發現,異二聚體往往比同源二聚體更能激活BMP信號。為了確定這是否適用于BMP2/GDF5和BMP4/GDF5異源二聚體,我們使用BRITER成骨細胞系測試了信號活性。BRITER細胞系通過SMAD 1/5/9表達熒光素酶以響應BMP信號。在該檢測系統中,BMP2/GDF5和BMP4/GDF5異質二聚體都是有效的信號分子,EC50值分別為1.7和1.1 nM(圖2)。與BMP2、BMP4或GDF5同質二聚體相比,異質二聚體的EC50值比所有同質二聚體低約3-5倍(圖2)。此外,BMP2/GDF5和BMP4/GDF5異質二聚體的信號比用等量的同質二聚體BMP2+GDF5或BMP4+GDF5組合培養的細胞更強(圖2)。此外,在配體濃度較高時,異質二聚體比各自的同質二聚體表現出更大的信號。

圖2:異二聚體在體外比同二聚體更有效
(3) 異二聚體和同二聚體信號在體內的比較
我們使用Xenopus顯影試驗來測量BMP同二聚體與異二聚體的活性。重組配體或溶劑對照被微量注射到爪蛙囊胚的囊胚腔中,并允許它們發育約46小時,直到它們達到蝌蚪期(NF37期),那時它們被評分為腹化。首先,進行了劑量反應實驗,以確定引起具有最低致死率的表型的最小有效劑量;極度腹化胚胎在原腸形成時停止并隨后死亡(圖3A)。注射了0.15 pmol和0.5 pmol蛋白質的胚胎使用背前指數(DAI)盲目評分,該指數可以測量胚胎腹化異常程度。在這個評分系統中,5分表示發育正常,0分表示腹化程度最嚴重(圖3D)。
與BMP2和BMP4相比,注射異二聚體的胚胎原腸發育停止和致死性更頻繁,并且略高于GDF5同型二聚體(圖3A)。GDF5同型二聚體比BMP2或BMP4造成更嚴重的腹化(圖3B, C)。這與體外系統相反,在體外系統中,BMP2是最有效的同型二聚體(圖2)。與GDF5類似,在所有測試濃度下,注射BMP2/GDF5或BMP4/GDF5異型二聚體與BMP2和BMP4同型二聚體相比,產生了劑量依賴性的腹化增加(圖3B, C)。
我們使用全坐位原位雜交方法,在注射后僅數小時,檢測了非洲爪蟾原腸胚形成期NF10期的一個亞群。在對照胚胎中,ventx1/2的表達僅限于發育中的原腸的最腹側(圖3E)。注射BMP2和BMP4導致ventx1/2的表達以劑量依賴的方式增加。相比之下,注射GDF5或BMP/GDF5異源二聚體可誘導ventx1/2表達域的劑量依賴性擴張,從原腸頂部擴散到背側(圖3E, F)。與BMP2和BMP4同型二聚體相比,BMP2/GDF5和BMP4/GDF5在體內都具有高度活性(圖3B)。
重組配體(BMP2, GDF5和BMP2/GDF5)被注射到斑馬魚胚胎中,無論是WT還是缺乏BMP7的突變體(bmp7asb1aub),以在受精后3小時(hpf)否定內源性BMP信號。30分鐘后,注射的胚胎、未注射的WT和突變對照,通過免疫熒光定量核pSMAD5(圖4)。在未注射的野生型胚胎中有穩健的信號傳導(圖4A),但在未注射的BMP7突變型胚胎中沒有信號傳導(圖4B)。以實驗確定的0.08 fmol劑量注射同型二聚體BMP2蛋白,以誘導輕度pSMAD5反應(圖4C),介于對照胚胎的兩個極端之間。與BMP2相比,在此劑量注射同型二聚體GDF5誘導的pSMAD5反應較弱(圖4D)。相反,注射BMP2/GDF5異源二聚體比單獨注射同型二聚體誘導的pSMAD5反應更強(圖4E, F)。這些結果表明,在該模型系統中,BMP2/GDF5異源二聚體比任何一種同型二聚體誘導的pSMAD5信號通路更強。
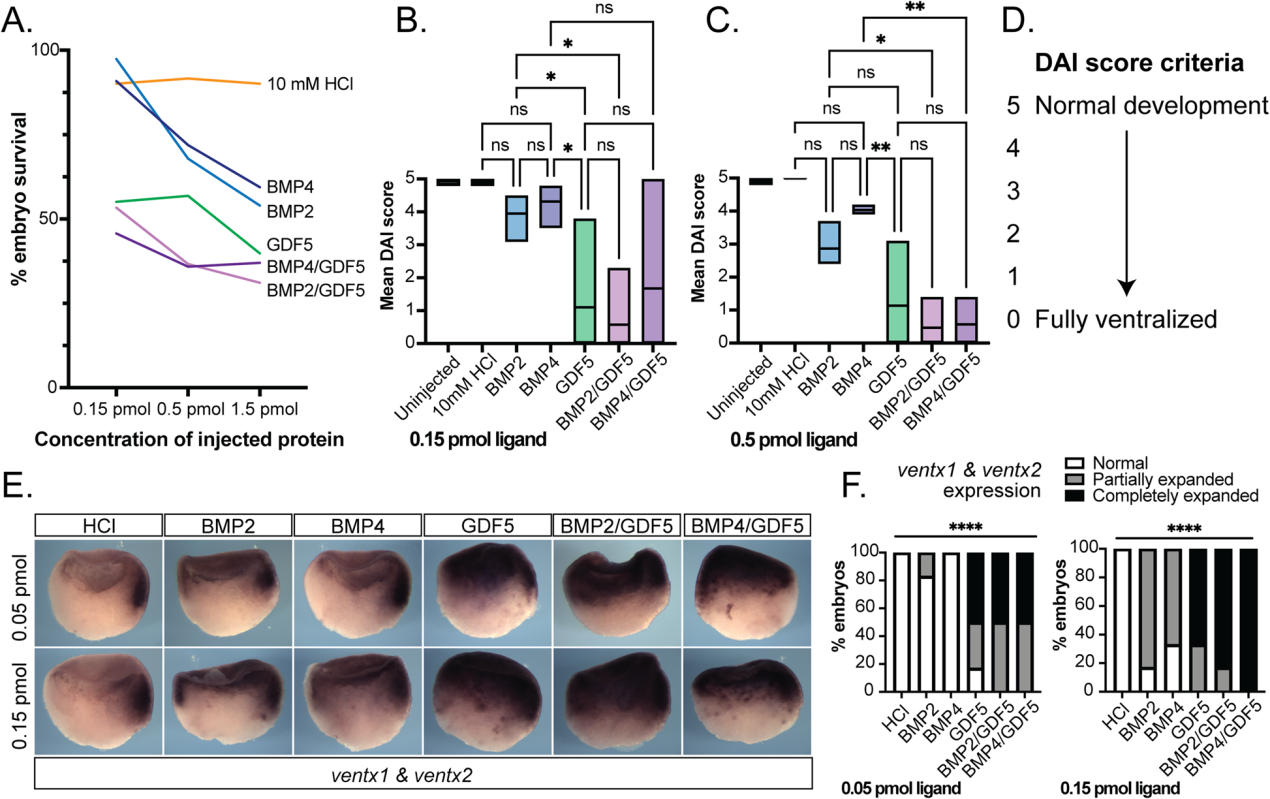
圖3:在非洲爪蟾發育試驗中,異二聚體比BMP2和BMP4同二聚體信號更強

圖4:BMP2/GDF5異源二聚體信號在斑馬魚囊胚發育中比BMP2或GDF5同源二聚體更有效
(4) 同型二聚體和異型二聚體受體結合的比較
我們使用表面等離子體共振(SPR)和測量配體與蛋白A SPR芯片結合重組嵌合FC受體。對于1型受體Alk3和Alk6,使用1:1結合模型進行了動力學分析以測量結合和擬合。圖5A中顯示了表觀平衡解離常數(KD)的比較。GDF5對Alk6 (57 pM)的親和力遠高于Alk3 (328pM)。BMP4對Alk3 (72 pM)和Alk6 (113 pM)的親和力相似,但對Alk3的偏好性較弱。BMP2優先與Alk3 (26 pM)結合,但也保留了與Alk6 (102 pM)結合的能力(圖5A)。對于所有三種同型二聚體,較低的結合親和力主要是由解離率的增加所驅動,因為關聯率相似(圖5A)。BMP2/GDF5和BMP4/GDF5異源二聚體對Alk3和Alk6都顯示出高親和KD值,且相應的解離速率較慢(圖5A)。BMP2/GDF5與Alk3結合的親和力為32 pM,與Alk6結合的親和力為26 pM。類似地,BMP4/GDF5與Alk3結合的表觀親和力為29 pM,與Alk6結合的表觀親和力為46 pM(圖5A)。實際上,異二聚體保留了它們單體組分的高親和力,導致分子與更大的受體庫具有特別高的結合親和力。此外,我們還測試了這些蛋白質與Alk2 (BMP6和BMP7的首選目標)或Alk1(與BMP9和BMP10結合)結合的能力。
我們使用SPR來確定BMP配體和2型受體之間的相對結合親和力。由于2型受體的結合位點被分離到單個鏈上,我們假設異二聚體對2型受體具有與同源二聚體相當的親和力。與1型受體相比,這種快速的解離與BMP配體對2型受體的親和力明顯較弱相一致,這意味著更短暫的相互作用。這些極快的締合和解離速率足夠接近于漸近,以至于分析軟件無法使用動力學模型擬合數據。因此,對這些SPR數據集進行了穩態結合分析,以確定表觀結合親和力。

圖5:SPR測定1型和2型受體親和力
(5) BMP同二聚體和異二聚體拮抗作用的比較
由于BMP配體受到細胞外蛋白拮抗劑的高度調控,我們接下來想確定異質二聚體是否受到BMP拮抗劑的差異調控。已有研究表明,BMP2/BMP7異源二聚體不被細胞外拮抗劑Noggin中和,而Noggin已知能有效拮抗BMP2和BMP7同源二聚體。對于BMP異質二聚體療效的增加,特別是在體內,一種可能的解釋可能與細胞外拮抗劑的活性有關。我們使用BRITER熒光素酶報告試驗測試了幾種不同的細胞外蛋白拮抗劑(具有不同的結合方式和配體偏好)對BMP信號通路的影響。具體來說,我們測試了Noggin、Grem2和NBL1。Grem2和Noggin在低濃度時都能有效拮抗BMP2和BMP4,IC50濃度約為1 nM,而抑制GDF5信號則需要更高的濃度,Grem2的IC50為38 nM,Noggin的IC50為42 nM (圖6)。Noggin和Grem2均可拮抗BMP2/GDF5和BMP4/GDF5異源二聚體,拮抗濃度與抑制BMP2和BMP4所需的濃度相似(圖6)。雖然NBL1對異源二聚體的拮抗程度略高,尤其是BMP2/GDF5(圖6),但NBL1對所有檢測蛋白的拮抗作用相對較弱。這些結果表明,BMP2/GDF5和BMP4/GDF5異質二聚體都被已知的靶向BMP同型二聚體的細胞外拮抗劑有效抑制,并且與這些拮抗劑的不同相互作用不太可能導致細胞培養和體內實驗系統中觀察到的活性差異。
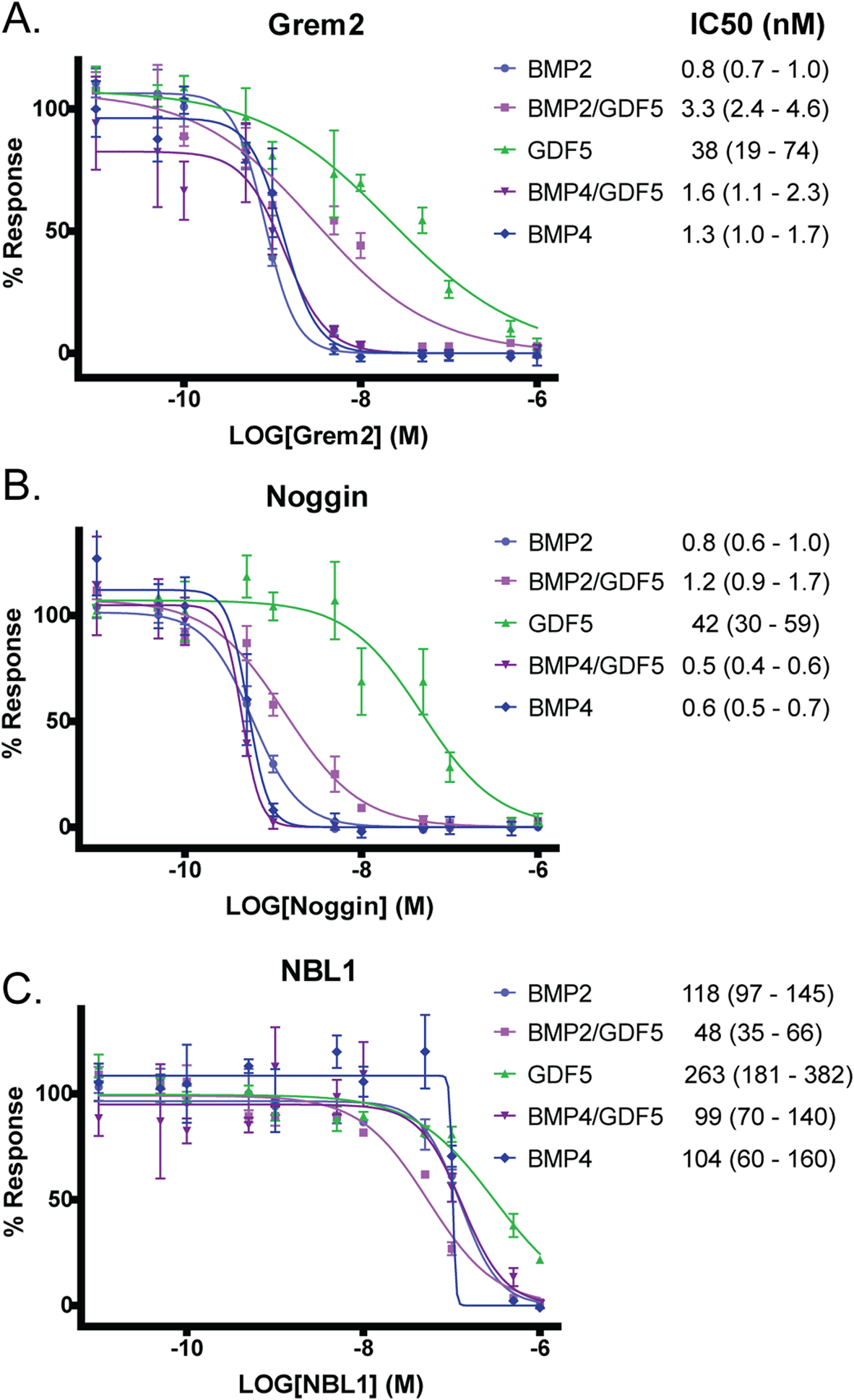
圖6:蛋白質拮抗劑對異質二聚體和同源二聚體抑制活性的比較
(6) BMP2/GDF5異源二聚體的晶體結構
我們改進的氧化復折疊方案有效地產生毫克量的BMP2/GDF5。使用這種蛋白質,我們能夠很容易地解決BMP2/GDF5的X射線晶體結構,分辨率為2.8 ?(圖7A)。這使我們有機會直接交叉比較異質二聚體的結構與先前解決的BMP2和GDF5同型二聚體的結構。BMP2/GDF5異源二聚體顯示出BMP生長因子的特征形狀,然而,二聚體清楚地顯示出不對稱的外觀(圖7A)。這與所有已發表的BMP配體結構形成鮮明對比,包括載脂蛋白結構和包含其他蛋白質結合伙伴的復雜結構,它們保持相同的基本對稱形狀。因此,在許多先前的結構中,不對稱單位只包含配體的一半。由于配體的不對稱性,不對稱單元由兩個完整的二聚體組成。對于171 Cα,兩種二聚體的RMSD為0.28,表明每種二聚體的晶體填充方式不同,對每種配體的整體形狀影響不大。
異質二聚體和同質二聚體結構之間的顯著差異發生在手指的彎曲上。與apo-BMP結構相比,異質二聚體的BMP2一半在形成BMP折疊的“手指”的β-鏈中顯示出更小的曲率。當使用DynDom(可以用來測量結構之間疇向的差異)進行分析時,異源二聚體結構的曲率下降了23°,鉸鏈點位于“手指”區域,從二聚體二硫半胱氨酸測量到19 ?(圖6B)。相反,與apo-GDF5相比,GDF5一半的β鏈曲率略有增加(圖6B)。在這里,分歧點(“鉸鏈”)發生在非常接近“指尖”的尖端,27 ?遠離中央二硫鍵,最大限度地減少了與apo-GDF5結構不同的殘基數量。因此,異質二聚體的手指可以被描述為在BMP2側打開,在GDF5側關閉。手指在二聚體上曲率的整體差異是生長因子形狀不對稱的原因。
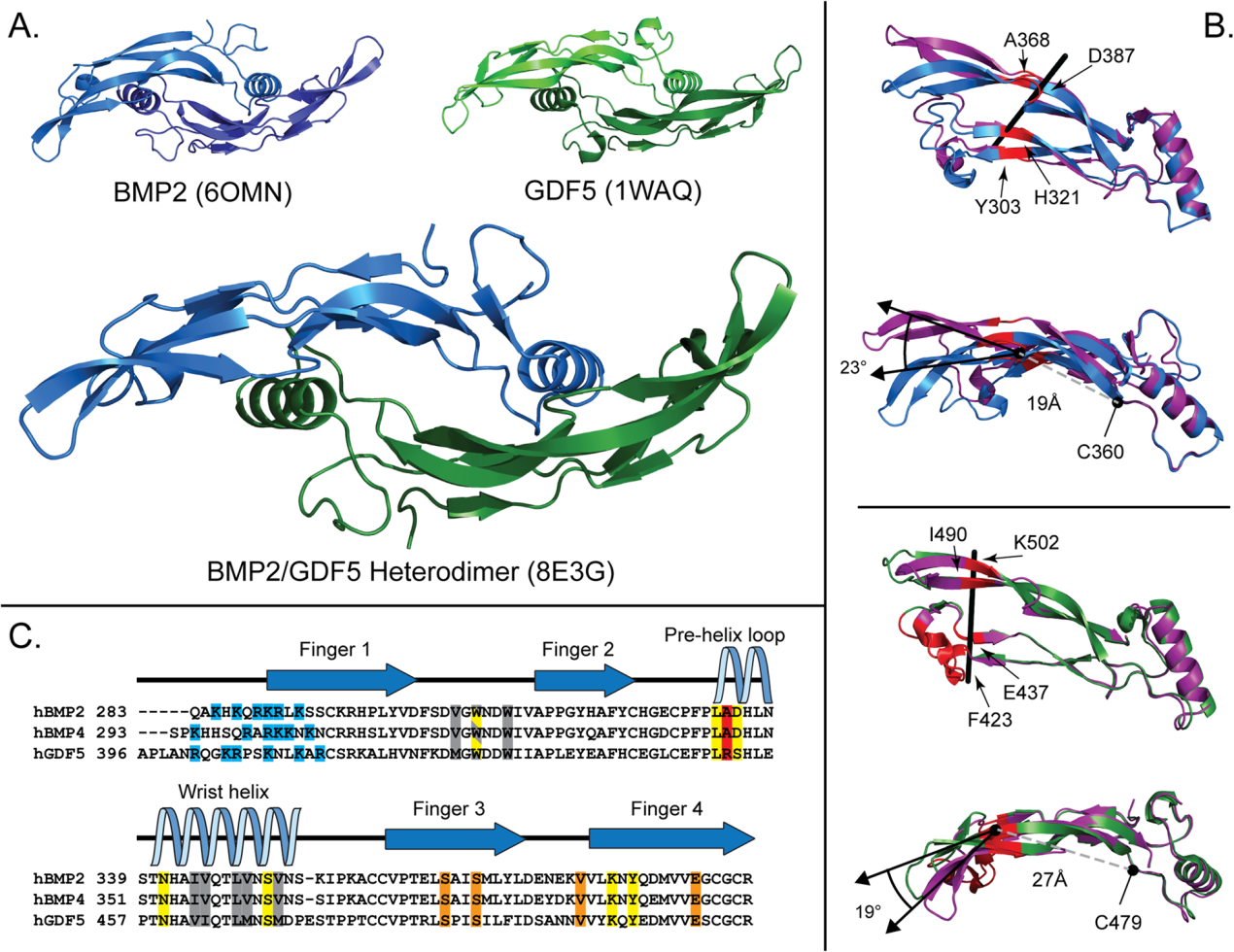
圖7:BMP2/GDF5異源二聚體的結構及1型受體結合位點與同源二聚體的比較
(7) 表面靜電分析
BMP2/GDF5異質二聚體與BMP2和GDF5同型二聚體之間的肝素/HS結合親和力差異最初是在我們的蛋白質生產方案中觀察到的,其中肝素親和層析用于將異質二聚體與同型二聚體分離。當比較同型二聚體和異型二聚體結構的溶劑靜電勢時,可以觀察到這種差異。帶正電的表面(藍色)對應于帶正電的殘基簇,包括精氨酸和賴氨酸,并與肝素/HS結合區域密切相關(圖8)。BMP2的HS結合位點已經確定地定位于成熟多肽的N端、面向細胞的蛋白質基部的賴氨酸和精氨酸殘基斑塊(QAKHKQRKRLK-) (圖7C和8,底部)。BMP4和BMP2都有三個連續長度的堿性氨基酸,在BMP4的情況下,這被證明是肝素結合的關鍵驅動因素(圖7C)。GDF5具有與BMP2和BMP4相似數量的賴氨酸和精氨酸殘基,但它們分布在較長的N端延伸處,導致局部正電荷濃度較低(圖7C)。此外,GDF5在二聚體的底部帶極負電荷,這可能抵消了在表面正面觀察到的較小陽性斑塊的影響(圖8)。GDF5較低的肝素結合親和力導致報道的哺乳動物血清水平比其他BMP高10-20倍。利用晶體結構分析了BMP2/GDF5異質二聚體的靜電表面。該分析表明,BMP2/GDF5異源二聚體在該位點上顯示了一個更中性的表面,并從其BMP2的一半保留了足夠的正電荷殘基,以形成一個更有限的肝素/HS結合基元,這與其觀察到的中間肝素結合親和力一致(圖1和8C)。

圖8:BMP2/GDF5與各自同型二聚體的靜電比較
(8) BMP2/GDF5結構中的1型結合位點分析
之前的結構已經闡明了Alk3和Alk6分別如何與BMP2和GDF5結合。這兩種配體之間有許多相似之處:受體復合物結構,結合位置保守,疏水相互作用主導界面,包括疏水三聯體位于一個單體的凹指區和第二個單體的腕螺旋面(圖7C)。類似的氫鍵也能促進受體結合(圖7C)。在BMP2的L333的主干和Alk3的Q109之間形成了一個關鍵的氫鍵,當突變為脯氨酸時,該氫鍵被干擾,導致受體結合和信號傳導消融。這種特殊的氫鍵在GDF5與Alk6結合的結構中也很明顯,盡管其必要性尚未得到實驗驗證。受體結合界面的這些相似性被認為是通過Alk3和Alk6的BMP2信號,在很大程度上可以互換。然而,一個關鍵的區別,也是GDF5對Alk3的親和力明顯低于Alk6的原因,是緊跟著這個關鍵氫鍵在L333 (GDF5中的L451)的殘基之間的差異,即BMP2中的Ala和GDF5中的Arg。BFGW結合位點可能優先與Alk6而不是Alk3結合。事實上,Alk3和Alk6在該位點的疊加表明R438會與Alk3發生立體碰撞,就像在同型二聚體GDF5中一樣。然而,由于手指曲率的差異,1型位點更加開放,這使得幾個疏水殘基遠離疊加受體。因此,雖然BFGW位點保留了GDF5的歧視性R438殘基,但口袋的整體形狀更加開放,這可能使受體的定位與同源二聚體略有不同。GFBW結合位點的功能可能類似于同二聚體BMP2,對Alk3的偏好超過Alk6,并且能夠通過這兩個受體發出強烈的信號。
我們試圖獲得關于異源二聚體中每個獨特位點的受體特異性的實驗信息,并研究BFGW結合口袋中Alk3親和力增加的可能性。我們利用了BMP2突變L333P,它破壞了1型受體的結合,以破壞異質二聚體一半上的受體結合。首先,產生具有L333P突變的BMP2同型二聚體作為對照,并在熒光素酶報告試驗中顯示不發出信號。使用L333P BMP2,我們與WT GDF5形成并分離了一個異源二聚體,預計它的一半(GFBW)上有一個中斷的1型受體結合,在另一邊(BFGW)上留下一個單一的功能位點。采用1:1結合模型,突變異質二聚體BMP2_L333P/GDF5與Alk3和Alk6結合的親和力遠低于同型二聚體GDF5,與僅具有單一1型受體結合位點的突變體一致。雖然在該結合系統中很難區分親和性和親和性的影響,但Alk3和Alk6結合的相對減少是相似的。因此,異二聚體對1型受體整體親和力的增加可能是由于在一個信號配體中有兩個不同的高親和力位點,其中一側表現為GDF5配體,另一側表現為BMP,特異性由手腕區域決定。我們無法通過破壞BFGW位點來復制這些發現,因為GDF5突變不能正確地折疊。
結論:我們開發了新的BMP2/GDF5和BMP4/GDF5異源二聚體,它們比同源二聚體BMP2,BMP4更有效地發出信號。異質二聚體顯示出肝素親和力的差異,并可能保留類似于GDF5的更高擴散勢。
參考文獻:Gipson, G. R., Nolan, K., Kattamuri, C., Kenny, A. P., Agricola, Z., Edwards, N. A., Zinski, J., Czepnik, M., Mullins, M. C., Zorn, A. M., & Thompson, T. B. (2023). Formation and characterization of BMP2/GDF5 and BMP4/GDF5 heterodimers. BMC biology, 21(1), 16. https://doi.org/10.1186/s12915-023-01522-4.






