10分以上的單細胞測序文章!揭露早期糖尿病性腎病的機械損傷信號通路
糖尿病腎病(Diabetic nephropathy,DN)是導致終末期級腎臟疾病的主要原因,而組織病理學腎小球病變是DN最早的結構改變之一。然而,啟動這些腎小球改變的信號通路尚不完全清楚。為闡明DN發生的細胞和分子基礎,作者對DN早期的2型糖尿病小鼠腎臟細胞進行單細胞和整體RNA測序。差異表達基因分析顯示,腎小球細胞類型中葡萄糖?獨立應答。腎小球細胞程序上游的基因調控網絡提示機械敏感性轉錄通路MRTF?SRF的激活主要發生在系膜細胞。重要的是,在獨立的患者隊列數據中,在DN腎小球中也發現MRTF?SRF轉錄通路的激活。此外,體外腎灌注提示MRTF - SRF的調節是腎小球過濾的常見機制。總的來說,本研究展示早期DN的單個細胞轉錄組圖譜,突出機械敏感信號通路作為糖尿病腎病的新靶點。本研究于2023年1月10日發表于期刊《Genome Med》,IF:10.18。
技術路線:
主要研究結果:
1、早期DN的BTBR ob/ob小鼠腎臟的scRNA-seq
作者生成了BTBR.Cg-Lepob/ob WiscJ;Gt (ROSA)26Sortm4(ACTB?tdTomato,?EGFP)Luo;Tg(NPHS2-cre)295Lbh;小鼠足狀突細胞報告(簡稱BTBR ob/ob或DN小鼠),以研究DN中發生的細胞和分子變化。基于研究前期的預實驗觀察,本研究將6周齡定義為DN發病期,12周齡定義為DN早期。
從總共16只小鼠中取樣腎組織,包括6周齡和12周齡的BTBR ob/ob(DN)和BTBR WT(對照)小鼠中的雄性和雌性小鼠。使用Percoll梯度部分去除樣品的近端小管(PT)段,以富集腎小球。使用冷活化蛋白酶(CAP)制備單細胞懸液,以減少腎細胞中解離誘導的假象。共70944個細胞進行預處理和質量控制(圖1B)。每種細胞類型的定義標記基因和每個簇的五篇標記基因在點圖(圖1C)。
2、DN腎臟細胞類型特異性改變提示糖尿病的葡萄糖依賴性和葡萄糖非依賴性反應
接下來,作者比較DN與對照腎臟中細胞類型中基因表達水平。總體上,作者發現6周時,所有類型的細胞中有447個差異表達基因(DEGs);12周時,所有類型的細胞中有740個DEGs(圖1D)。表明主要是這兩種類型細胞在DN的早期階段受到影響。富集分析在6周和12周時在腎小球細胞類型和PT細胞類型中識別出顯著的通路(圖1E-F)。腎小球細胞類型表現出對細胞外基質分子、細胞粘附、細胞增殖等的調節作用,以及對機械應力、細胞因子和血壓的細胞應答。PT細胞類型表現出多種代謝過程,例如生物氧化,以及參與氧化應激的反應,例如NRF2和PPAR信號通路。這些差異表明早期DN中PT和腎小球細胞類型分別具有葡萄糖依賴性和葡萄糖非依賴性反應。
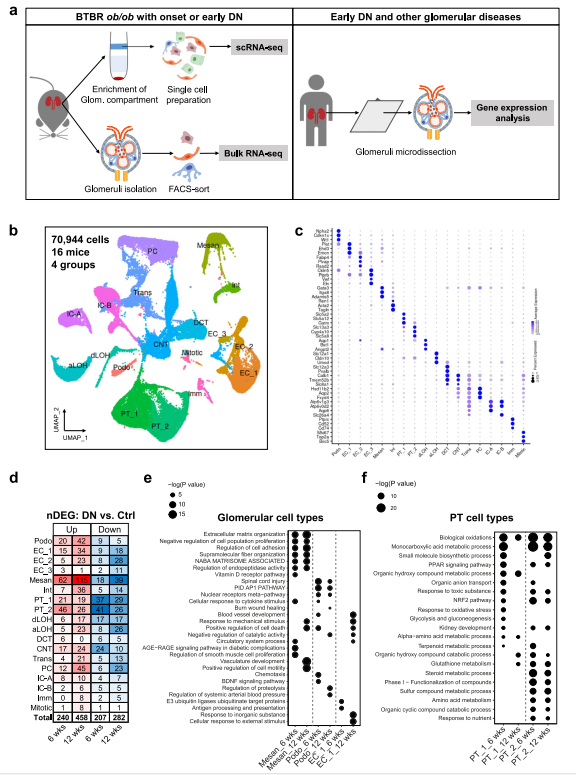
圖1 早期DN的BTBR ob/ob小鼠腎臟的scRNA-seq
將來自scRNA-seq的細胞基因表達數據與大量RNA-seq數據進行比較。足細胞、EC_1/gECs和系膜細胞顯示正Pearson相關系數,表明兩個數據集之間存在線性相關性(圖2A)。將單細胞和大量RNA-seq數據集的腎小球DEGs取交集,得到194個獨特基因(圖2B),這些基因被映射到歐洲腎臟cDNA庫(ERCB)患者數據集。在顯微解剖的DN患者腎小球中,106個基因的mRNA表達受到顯著調節(圖2B-C)。重要的是,在單細胞和大量RNA-seq數據中,在人DN腎小球中檢測到的大多數DEGs在系膜細胞中均發生顯著變化(圖2C)。
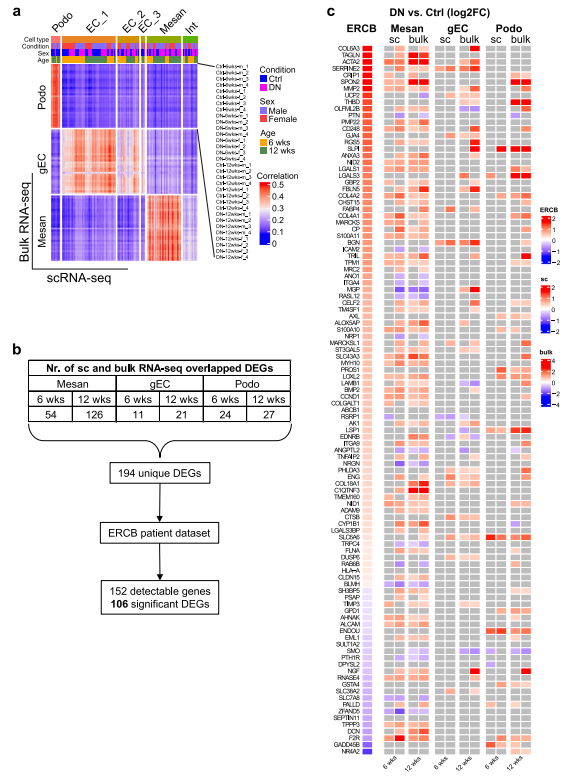
圖2人類和實驗性DN的共同特征
為識別DN腎小球細胞類型中導致基因差異表達的轉錄調控,作者使用獨創性途徑分析(IPA)進行上游分析,該分析不僅識別轉錄因子,還識別轉錄輔調控因子,如輔激活因子。在單細胞和體RNA-seq數據中通常改變的轉錄調控因子如圖3A所示。有趣的是,作者觀察到機械敏感轉錄調節因子的激活,包括心肌相關轉錄因子A和B(MRTFA/B)和yes相關蛋白1(YAP1或YAP),以及轉錄因子血清反應因子(SRF)。SRF活性在系膜細胞中較高,在足細胞和gECs中等或較低(圖3B)。
在DN腎小球細胞類型中具有顯著調控作用的MRTF-SRF轉錄靶基因如圖3C所示。MRTFA和在足細胞和gEC的細胞質和細胞核中發現MRTFB,在對照組和DN小鼠中表現出相當的表達水平(圖3D)。對照組小鼠系膜細胞中MRTFA表達水平較低,而DN小鼠中部分系膜細胞中MRTFA核積累(圖3D)。重要的是,MRTFB在系膜細胞中的核積累是明顯的,特別是在系膜擴張發生的區域(圖3D)。
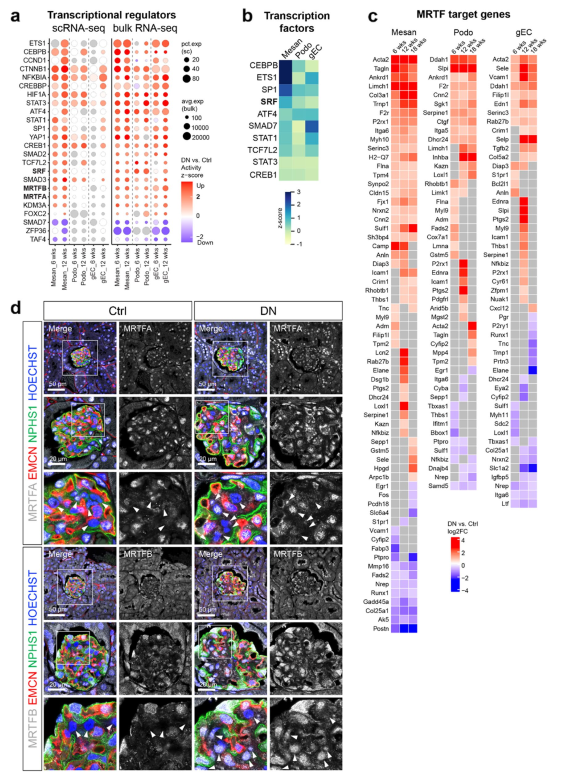
圖3 DN腎小球中機械敏性轉錄調控因子被激活
5、MRTF轉錄靶基因在DN合并2型糖尿病患者中表達上調
微解剖腎小球mRNA表達分析顯示,小鼠DN中顯著改變的各種基因在早期人類DN中也被顯著調控(圖4A)。其中許多靶基因與系膜體積呈正相關(圖4B)。MRTF轉錄靶基因被定位于ERCB數據集。這些基因在腎病和其他可能引起機械應激的疾病以及腎小球硬化的各種其他腎小球疾病的腎小球中被顯著調控,但在微小變化疾病(MCD)中沒有(圖4C)。
接下來,作者通過免疫熒光染色研究早期人DN的MRTFA和MRTFB的表達和位置。在健康和早期DN腎活檢樣本中,所有三種腎小球細胞類型中檢測到MRTFA的基礎和相當的表達水平(圖5)。與小鼠實驗結果一致,DN、MRTFB在健康人大部分系膜細胞中不存在,但在腎小球病變處的系膜細胞核中積累(圖5)。總之,作者對人和小鼠DN的免疫熒光染色分析證實MRTFB在DN早期系膜細胞中的激活。
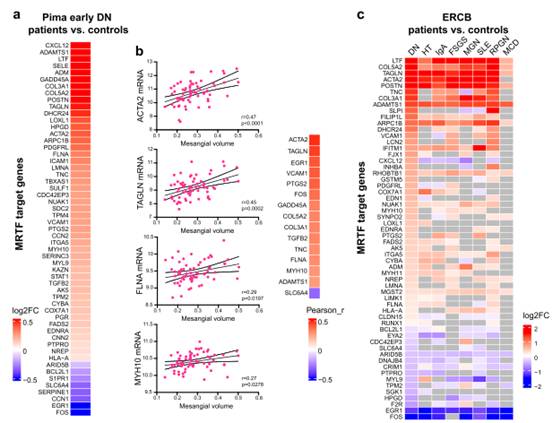
圖4 MRTF轉錄靶基因在DN合并2型糖尿病患者中表達上調

圖5 免疫熒光驗證早期DN系膜細胞中MRTFB的激活
6、腎小球系膜細胞表現出主要的信號網絡
作者的結果表明,MRTF-SRF轉錄調控在小鼠和人DN中都被激活,主要是在系膜細胞中。此外,作者還鑒定多種系膜細胞標記基因,這些基因編碼跨膜蛋白,負責機械信號的感知和轉導,包括機械敏感離子通道(MSCs)、GPCRs、整合素和鈣粘蛋白(圖6A)。接著,作者比較DN與對照組小鼠中所有腎細胞類型之間的相互作用強度,結果顯示DN腎臟中系膜細胞與所有其他細胞類型的相互作用主要(圖6B)。此外,系膜細胞主導細胞間通信(圖6C),并在DN腎小球中作為發送者與gEC和足細胞廣泛相互作用(圖6D)。這些相互作用涉及各種眾所周知的與慢性腎臟疾病(CKD)發病機制相關的生長因子信號通路,如骨形態發生蛋白(BMP),成纖維細胞生長因子(FGF),血管內皮生長因子(VEGF),以及多種細胞外基質蛋白和整合素之間的相互作用。
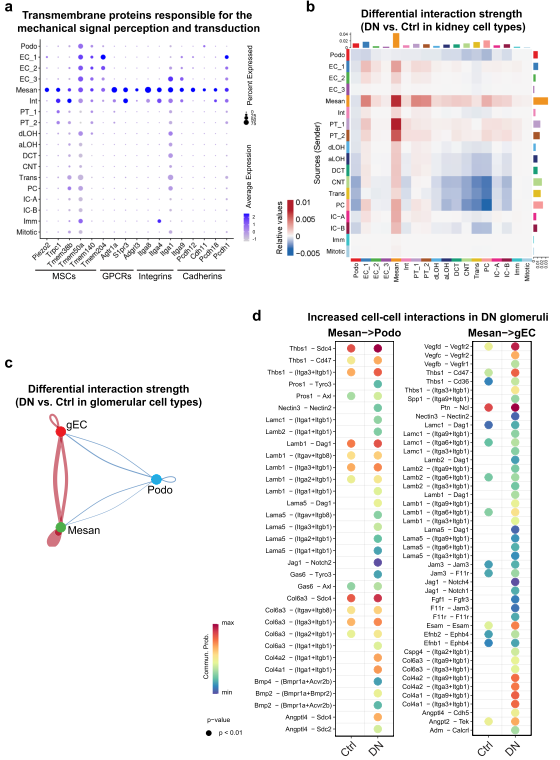
圖6 腎小球系膜細胞表現出主要的信號網絡
7、體外腎灌注激活機械敏感信號通路
作者分別生成了離體小鼠腎小球(圖7A)和豬腎皮質組織的整體和單核轉錄組學數據。并比較灌注和未灌注情況下的基因表達。在體外灌注的小鼠腎小球中,上游的DEGs分析顯示MRTFA/B、SRF和YAP1被激活(圖7B)。對顯著改變的MRTF轉錄靶基因進行富集分析,發現了肌動蛋白細胞骨架組織、VEGFA-VEGFR2信號通路、平滑肌收縮、PDGFRB通路以及細胞對外部刺激的反應(圖7C)。在體外灌注的豬腎中,從灌注和未灌注的腎皮質組織中共鑒定出11692個單核(圖7D)。基于之前報道的單核細胞數據的細胞/核他異性標記基因,Unsupervised clustering識別出18個簇,將其分為12種細胞類型(圖7E)。作者鑒定主要的腎小球細胞類型,包括由核標記基因MEIS1和FHL2定義的基質細胞類型(圖中“STROMA”表示)(圖7F)。豬腎皮質免疫熒光染色顯示,MEIS1陽性細胞主要由系膜細胞組成,也有部分間質細胞(圖7G)。對DEGs的上游分析顯示,基質細胞中MRTFA/B、SRF和YAP1被激活,足細胞和內皮細胞中YAP1和MRTFB被激活(圖7H)。顯著調控的MRTF轉錄靶基因主要存在于基質細胞中(圖7I)。這些發現支持作者的假設,即機械敏感信號通路的激活是腎小球過滲反應的常見機制。
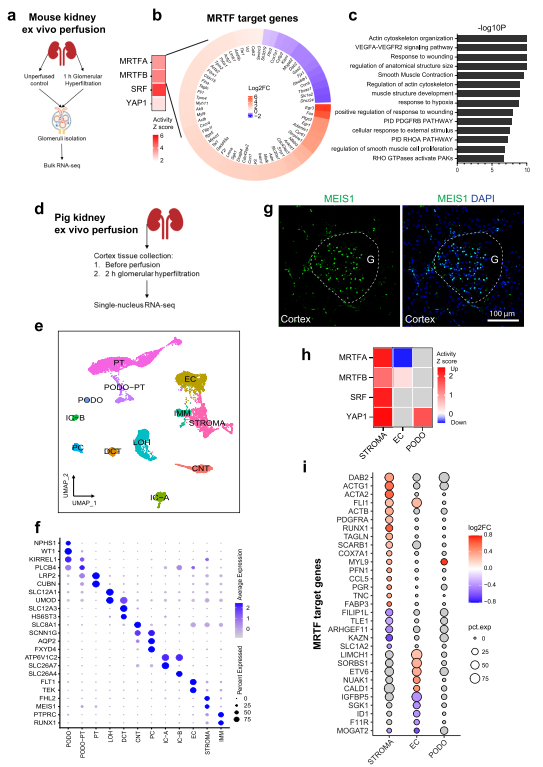
圖7腎體外灌注激活機械敏感信號通路
結論:
作者的研究展示早期DN的全面單細胞轉錄組景觀,并揭示隨著DN的發生和發展而發生的基因表達的細胞特異性改變。作者對腎小球細胞類型的深入分析表明,機械敏感信號與糖尿病性腎小球病變相關,并可能在腎小球過滲反應中發揮驅動作用。在腎小球硬化的背景下,MRTF轉錄途徑可能是腎小球共同機制的一部分。
參考文獻:
Liu S, Zhao Y, Lu S, Zhang T, Lindenmeyer MT, Nair V, Gies SE, Wu G, Nelson RG, Czogalla J, Aypek H, Zielinski S, Liao Z, Schaper M, Fermin D, Cohen CD, Delic D, Krebs CF, Grahammer F, Wiech T, Kretzler M, Meyer-Schwesinger C, Bonn S, Huber TB. (2023). Single-cell transcriptomics reveals a mechanosensitive injury signaling pathway in early diabetic nephropathy. Genome Med;15(1):2. doi: 10.1186/s13073-022-01145-4.






