表征與唾液酸化相關的長非編碼RNA,以開發一種新的信號來預測結直腸癌的預后、免疫狀況和化療反應
結直腸癌(CRC)是2020年全球第三大最常見和第二致命的腫瘤。轉移性結直腸癌患者的5年生存率僅為14%,這凸顯了早期和精確識別不同風險人群的患者以進行適當和個性化治療的必要性。正常的分期過程遵循美國癌癥聯合委員會(AJCC)的標準,這是基于腫瘤大小(T),淋巴結受累(N)和轉移(M)的TNM分期系統。CRC的共識分子亞型(CMS)也被提出作為基于基因表達的亞型。盡管這兩種分期策略在CRC治療選擇中很有價值,但同一亞型的患者仍可能表現出廣泛的臨床結局差異;因此,需要更精細的分類方法來提供更個性化的治療策略。此外,癌細胞對化療和靶向藥物的耐藥性仍然很常見,并嚴重阻礙了癌癥的管理。預測每位患者藥物敏感性的工具有助于指導治療決策。最近,免疫學方法之一的程序性細胞死亡蛋白1(PD-1)抗體治療已被證明僅在治療微衛星不穩定性高腫瘤方面成功,這使得85%的CRC患者無法從免疫療法中受益。新版本的免疫檢查點抑制劑有望擴大免疫療法的療效。因此,迫切需要發現新的生物標志物或治療靶點來預測結直腸癌的預后、治療反應和發展。該研究發表于《FRONTIERS IN IMMUNOLOGY》,IF: 8.786。
技術路線:

主要研究結果:
1. 識別預后唾液酸化相關的lncRNA特征
探索唾液酸化相關lncRNA在結直腸癌中的預后價值的過程顯示在圖1。首先,將543名臨床信息完整的患者隨機分為訓練組和驗證組。作者從MsigDB網站上下載了120個參與唾液酸和Siglec相互作用的mRNA,并帶有lncRNA注釋。正如皮爾遜相關性所揭示的那樣,共有1268個lncRNA與mRNA強相關,閾值為|r|訓練組中>0.3和P<0.001。作者接下來專注于這些與唾液酸化相關的lncRNA;單因素Cox回歸分析顯示9個lncRNA與患者OS顯著相關(P<0.01,圖2A)。ZEB1反義RNA 1(ZEB1-AS1),LOC100506691,編號:AC092687.3和編號:AC010973.2風險比(HR)超過1,這表明它們是危險因素。其余5個lncRNA,LOC100507403,LINC00261,ITGB8反義RNA 1(ITGB8-AS1),ENTPD1反義RNA 1(ENTPD1-AS1)和B4GALT1反義RNA 1(B4GALT1-AS1)是HR的保護因子<1。
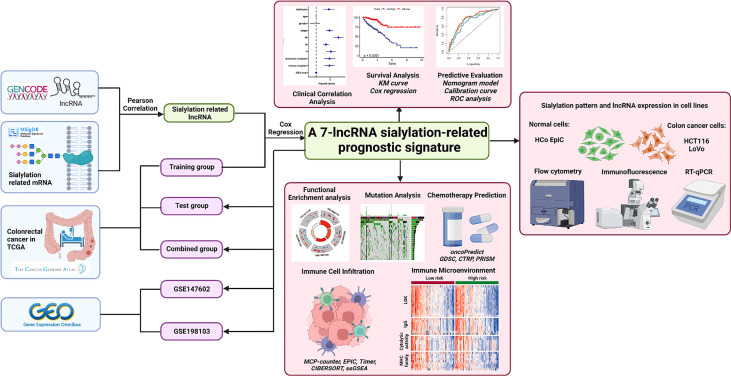
圖1 本研究的流程圖
其次,通過多元Cox回歸和逐步算法構建了基于7種唾液酸化相關lncRNA的簽名。基因如下:ZEB1-AS1,編號:AC092687.3、LOC100506691、LOC100507403、ENTPD1-AS1、LINC00261和ITGB8-AS1。每個lncRNA的系數(圖2B)與單變量Cox回歸中的HR值具有相同的趨勢。具體來說,ZEB1-AS1,編號:AC092687.3,LOC100506691顯示正系數導致較高的風險評分,而LOC100507403、ENTPD1-AS1、LINC00261和ITGB8-AS1具有負系數,因為它們是保護因素。
5種lncRNA在腫瘤組織中的表達水平均顯著較高,但LINC00261(無差異)和LOC100507403(在正常組織中顯著升高)除外(圖2C)。在組合組中,7種唾液酸化相關的lncRNA在高風險組和低風險組之間表達顯著差異,由中位風險評分(圖2D)。此外,通過Spearman檢驗計算了風險評分與七種唾液酸化相關lncRNA的關系;LINC00261呈最高負相關(r = ?0.567,圖2E)。
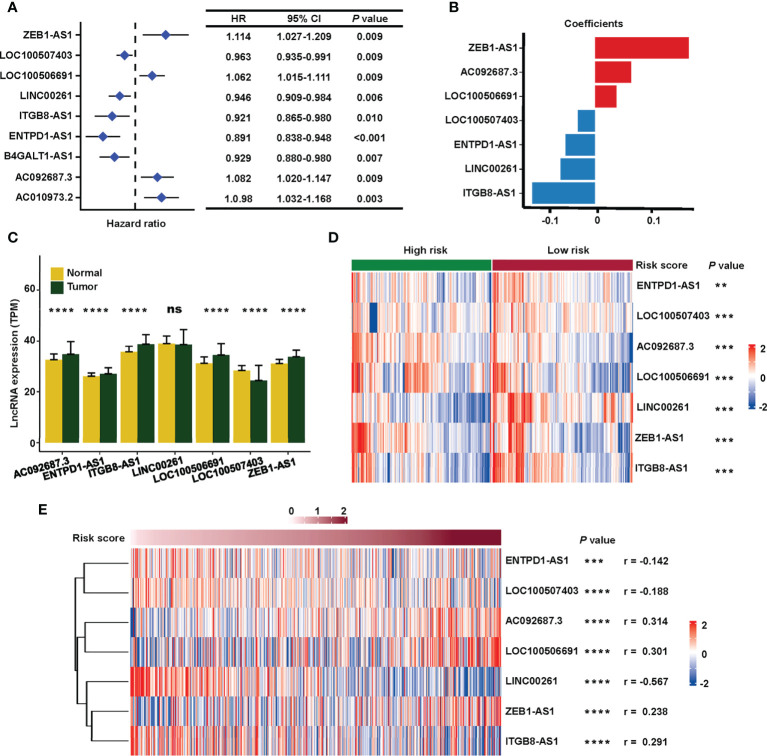
圖2 構建與唾液酸化相關的lncRNA特征
2. 基于七種唾液酸化相關lncRNA驗證特征,用于生存預測和作為獨立預后因素
根據每組計算的風險評分的中位數將患者分為高風險或低風險類型。訓練、測試和組合集的風險評分和生存狀態顯示在圖3A(上)。在高危組中觀察到較高的死亡率,表明訓練組(圖3A(左),P<0.001)和測試集(圖3A(中),P= 0.036)。高危患者的OS明顯更差(圖3A(右),P<0.001),DSS (圖3B,P< 0.001)和PFS(圖3C,P< 0.001)在TCGA組合集合中。
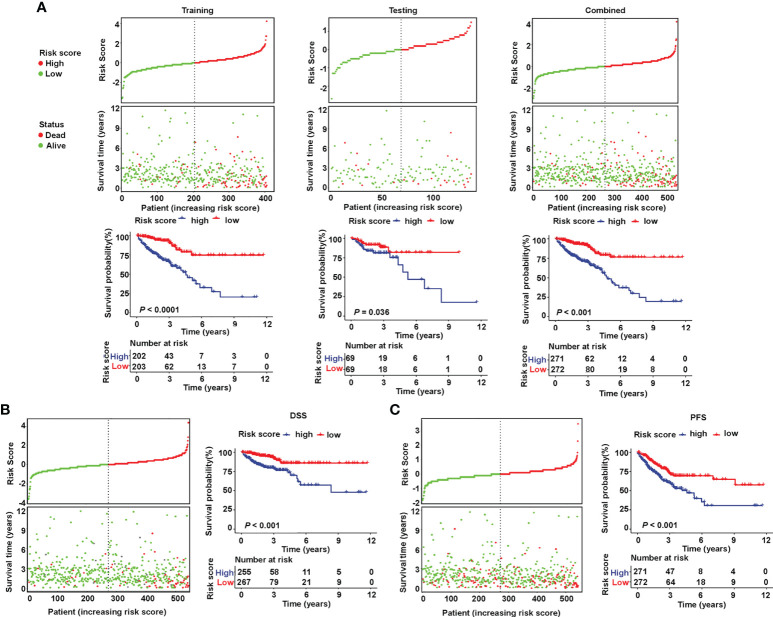
圖3 驗證TCGA中唾液酸化相關lncRNA標記的預后價值
為了檢查臨床病理特征與風險評分之間的關系,χ2在組合集合上使用檢驗和Cox回歸。高危組和低危組OS、靜脈浸潤、臨床分期、轉移分期、淋巴結分期、CMS差異,χ2測試 (圖4A)。此外,基于7種唾液酸化相關lncRNA的簽名分層的風險組與M、N和T階段以及癌胚抗原水平顯著無關,OS的多元Cox回歸結果證實了這一發現(HR = 4.343,95%CI = 2.223–8.482,P< 0.001,圖4B), PFS(HR = 1.695,95% CI = 1.095–2.623,P= 0.018,圖4C)和DSS(HR = 3.243,95%CI = 1.525–6.896,P= 0.002,圖4D)。這些結果表明,作者的唾液酸化相關的結直腸癌lncRNA標記對于預測生存結果是可靠的,可以作為獨立的預后因素。
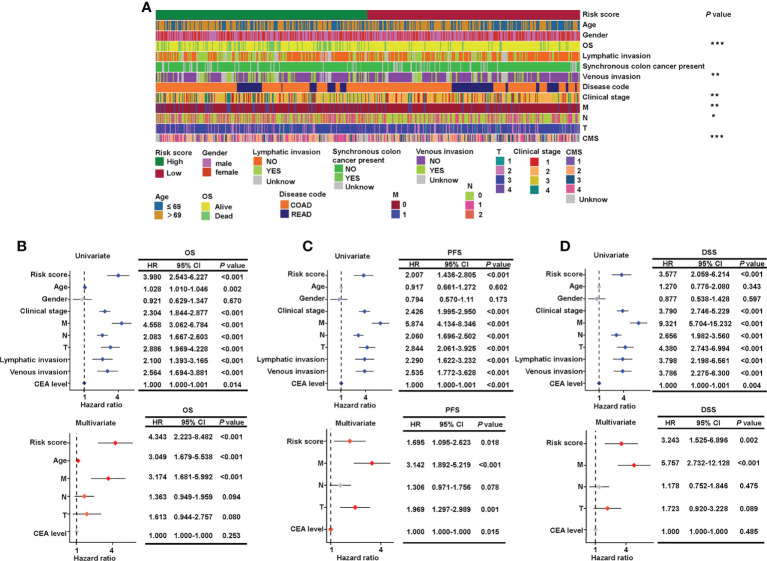
圖4 驗證風險評分與臨床病理特征之間的關系
3. 結合臨床特征的列線圖的構建和驗證
由于風險評分獨立于其他臨床特征,作者試圖優化特征以提高臨床效率。基于OS的多變量Cox回歸分析,作者整合了年齡,M分期和風險評分,以生成預測1年,3年,5年和7年后生存概率的列線圖(圖5A)。評估列線圖預測準確性的ROC曲線顯示,列線圖在1年(AUC = 0.769)、3年(AUC = 0.771)、5年(AUC = 0.781)和7年(AUC = 0.808)(圖5B)。此外,繪制校準曲線以檢查實際測量結果和預測預后值的一致性。結果表明,列線圖的預測結果與觀測結果高度一致(圖5C)。這些數據表明,作者成功地建立了一個列線圖,該列線圖結合了與唾液酸化相關的lncRNA特征和臨床特征,以實現更準確的預測。
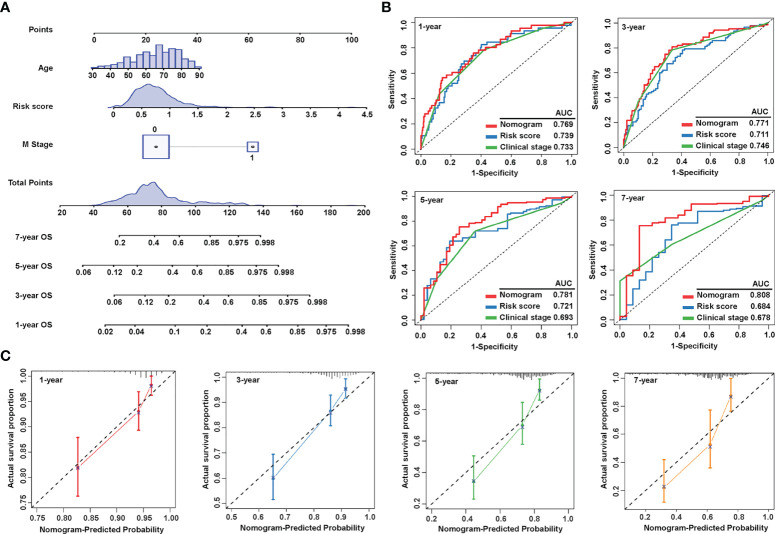
圖5 列線圖的構建和評估
4. 唾液酸化相關lncRNA標記的潛在機制分析
為了探索風險特征對患者預后進行分層的潛在機制,作者進行了突變、KEGG通路、GSEA和GO分析。由于體細胞突變是惡性腫瘤的主要原因,作者使用“maftool”包可視化了TCGA中突變譜的景觀,其中前20個最常見的突變分別顯示在高風險組和低風險組中(圖6A)。Fisher試驗顯示,除突變基因TP53(圖6B)。此外,兩組體細胞突變和新抗原數量差異無統計學意義(圖6C)。這些結果表明,基于唾液酸化lncRNA的標記的預后意義可能與體細胞突變無關。

圖6 高危和低危組的體細胞突變
接下來,作者進行了通路分析和GSEA,以研究與唾液酸化相關的lncRNA特征的潛在生物學重要性。共有603個DEG被識別為|log。2(FC)|> 0.5和調整后的P<0.05 使用R包“edgeR”(圖7A)。GSEA顯示,與細胞外基質(ECM)相關的通路,如基底細胞癌、ECM-受體相互作用、局灶粘附和刺猬信號通路,在高危組中富集,風險評分較低的患者具有豐富的細胞因子-細胞因子受體相互作用、氧化磷酸化、過氧化物酶體和核糖體(圖7B)。此外,GSEA顯示,低風險組(圖7C)。在風險預測較高的患者中,富含膠原蛋白和軸突的途徑,例如軸突發育,細胞外基質結構成分,膠原原纖維組織和軸索生成的調節。作者還對603個DEGs進行了GO分析,并確認免疫過程參與了CRC患者的唾液酸化特征相關劃分(圖 7D)。通路分析表明,免疫學和細胞外組成可能解釋了作者簽名的辨別力。

圖7 分析唾液酸化相關lncRNA特征的潛在生物學途徑
5. 唾液酸化相關特征評分的免疫微環境
為了進一步研究免疫過程是否與風險評分密切相關,作者挖掘了TCGA轉錄組學數據,通過在TIMER中使用反卷積算法來探索兩個風險組之間腫瘤免疫浸潤的差異。MCP-counter(圖8A)和EPIC(圖8B)均表明,癌癥相關成纖維細胞(稱為腫瘤間充質的關鍵成分)在高風險患者中顯著更高。抗腫瘤免疫細胞,如EPIC(圖8B)和TIMER(圖8C),以及CD8+ T細胞和CIBERSORT鑒定的幼稚B細胞(圖8D)在低風險組中的比例較高。為了進一步驗證這些發現,作者使用GSVA計算免疫浸潤(圖8E)。有趣的是,與高風險組相比,低風險組的免疫細胞比例更高,無論它們是抗腫瘤、中細胞還是促腫瘤免疫細胞,如GSVA熱圖所示。

圖8 不同風險人群的免疫細胞浸潤
此外,為了研究免疫系統亞基因,作者檢查了參與炎癥活動和免疫分子的關鍵基因。檢查所選基因與唾液酸化相關lncRNA之間的相關性(圖9A)。Serpin家族B成員1(SERPINB1)和組織蛋白酶S(CTSS)與7個lncRNA中的4個顯著相關,即ITGB8-AS1,LINC00261,ZEB1-AS1和LOC100506691。特定基因和家族,包括淋巴細胞特異性蛋白酪氨酸激酶(LCK)途徑;免疫球蛋白G(IgG)、MHC 家族和溶細胞活性基因,例如白細胞介素7受體(IL7R)、CD48、免疫球蛋白重常數γ1(IGHG1)、CTSE和CD209(圖9B);和免疫刺激劑,如CD28、IL6R 和TNFSF13 (圖9C),在高風險樣品中的表達率顯著降低。這些數據表明,不同風險組的免疫原性各不相同。
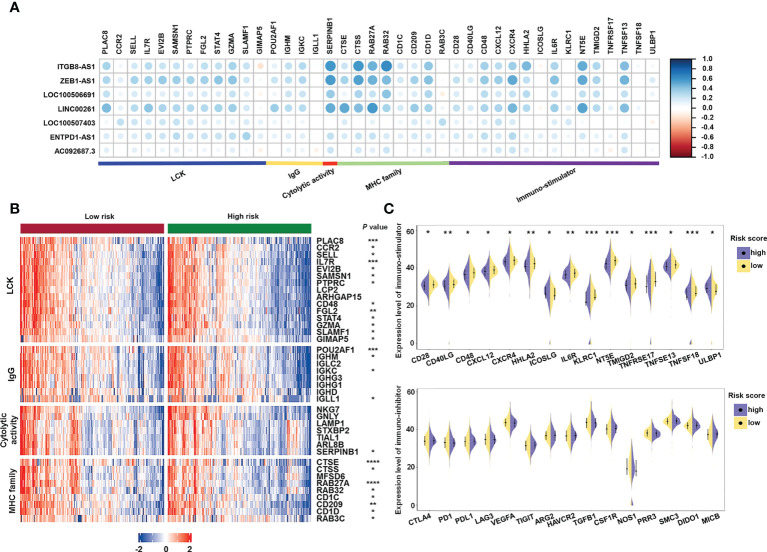
圖9 免疫相關基因與唾液酸化相關lncRNA特征的相關性分析
6. 唾液酸化相關lncRNA特征的驗證
作者使用流式細胞術和免疫熒光來探索不同細胞表面的唾液酸化模式。作者觀察到HCoEpiC和HCT116細胞的熒光強度明顯強于LoVo細胞(圖10A-C )當細胞表面用SNA染色時,SNA是一種與α-2,6連接的唾液酸結合的特定凝集素。這些結果表明,LoVo細胞的唾液酸化水平顯著降低。為了確認這七個唾液酸化相關的lncRNA標記基因的表達,對HCoEpiC和結腸癌細胞(HCT116和LoVo)進行了RT-qPCR。將HCT116細胞與HCoEpiC進行比較,作者發現ENTPD1-AS1,ITGB81-AS1,LINC00261,LOC100506691,LOC100507403和ZEB1-AS1在腫瘤細胞中顯著過表達(圖10D)。將LoVo細胞與正常結腸上皮細胞進行比較,作者發現LOC100506691和ZEB1-AS1在腫瘤細胞中的表達較高,而ENTPD1-AS1,LINC00261和LOC100507403在正常細胞中的表達較高。編號: AC092687.3ITGB8-AS1在細胞類型之間沒有顯著差異。
作者還使用了兩個GEO隊列,GSE147602和GSE198103,以調查作者簽名的預后能力。在GSE147602,該公式計算的風險評分與LOC100506691,ZEB1-AS1,ITGB8-AS1,ENTPD1-AS1和LINC00261具有很強的相關性(圖10E)。如圖10F,風險評分與轉移分期顯著相關,但與其他臨床病理特征(如性別和年齡)無顯著相關性。在GSE198103,風險評分與編號:AC092687.3、LINC00261和ITGB8-AS1(圖10G)。遠處轉移期患者的風險評分顯著高于局部或區域分期患者(圖10H)。唾液酸化相關的lncRNA標記評估CRC患者預后的能力被這兩個隊列清楚地驗證。
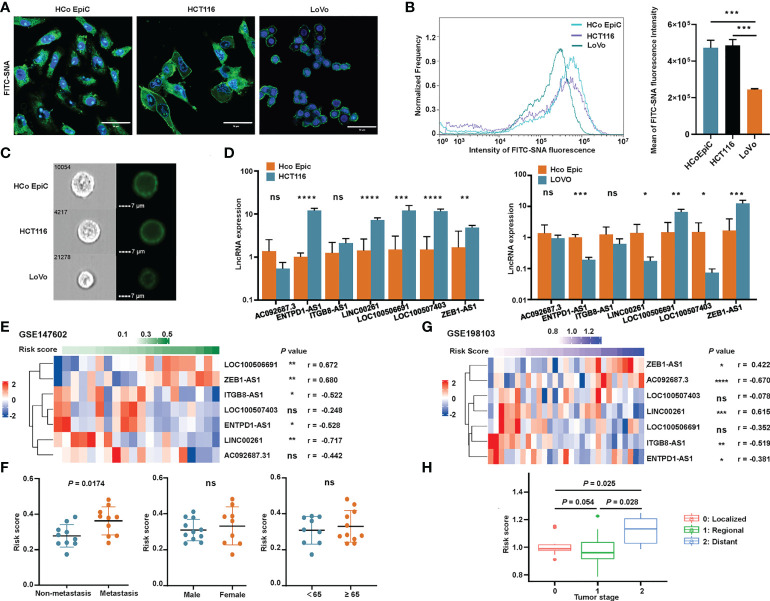
圖10 驗證與唾液酸化相關的lncRNA特征
7. 高危和低危組結直腸癌患者的藥物敏感性預測
為了評估作者的唾液酸化相關特征在臨床治療中的應用,并確定針對高危患者的有前途的藥物,作者分析了化療藥物的敏感性。在預測了543名患者的1900種化合物的敏感性后,作者在兩個風險組之間進行了Wilcoxon測試,并將調整后的P<0.05(圖11A)。在GDSC的198種化合物中,低風險組中有49種化合物的IC50顯著降低,而高風險組中只有5種化合物。臨床化療常用藥物見圖11B。5-氟尿嘧啶和奧沙利鉑的IC50在風險組間無差異,而喜樹堿、伊立替康和多西他賽的IC50在低風險組中顯著降低,這意味著風險評分較低的患者可能對這些化療化合物更敏感。靶向受體酪氨酸激酶(RTK)途徑的化合物,如西地尼、沃利替尼、福替尼和索拉非尼,預計在低風險組中更有效。兩個風險組在靶向細胞外信號調節激酶/絲裂原活化蛋白激酶(ERK/MAPK)途徑的化合物方面沒有差異。
CTRP中的44種化合物和PRISM中的280種化合物在高風險組中的AUC顯著降低。氯硝柳胺和苯丁酸氮芥處于兩個數據庫(圖11C),這意味著在CTRP(圖11D)和PRISM(圖11E)的高危組中,它們都被預測為較低的AUC。作者的研究結果表明,風險特征可以支持臨床藥物選擇,氯硝柳胺和苯丁酸氮芥可能適用于高風險患者。
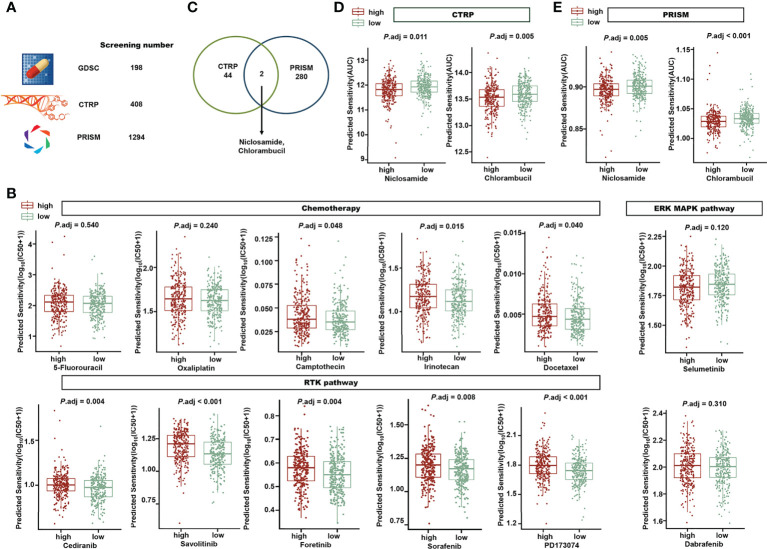
圖11 探索風險特征和藥物敏感性
結論:
綜上所述,該研究是迄今為止對唾液酸化相關lncRNA在結直腸癌患者中臨床意義的最系統的探索。作者成功開發并驗證了一種新型的七唾液酸化相關lncRNA標記,該標記在預測CRC患者的預后,免疫狀態和化療敏感性方面表現出準確的性能。該研究可為結直腸癌患者的臨床預后預測提供創新視角,為深化免疫治療改善和個體化抗腫瘤治療的理論基礎做出貢獻。
參考文獻:
Zhou M, Lv S, Hou Y, Zhang R, Wang W, Yan Z, Li T, Gan W, Zeng Z, Zhang F, Yang M. Characterization of sialylation-related long noncoding RNAs to develop a novel signature for predicting prognosis, immune landscape, and chemotherapy response in colorectal cancer. Front Immunol. 2022 Oct 18;13:994874. doi: 10.3389/fimmu.2022.994874.






