單細胞測序顯示肝細胞癌中的免疫抑制景觀
肝細胞癌占原發性肝癌病例的75-85%,是全球第三大癌癥相關死亡原因。近日,有研究的通過檢測肝細胞癌腫瘤免疫微環境(TIME),對單細胞和大塊組織測序數據的綜合分析來研究肝細胞癌的時間,揭示了肝細胞癌的時間格局,突出了主要免疫細胞類型的異質性及其在形成免疫抑制環境中的潛在機制。作者認為阻斷時間的形成可能是治療肝癌的一種有用的治療策略。該研究發表于《Frontiers in immunology》,IF:8.786。
技術路線:
主要研究結果:
1. 單細胞轉錄組分析確定了細胞組成
該研究納入了7個HCC樣本和相應的正常組織。通過質控的細胞共有39667個,其中21121個來自腫瘤組織,其余來自正常組織。然后這些細胞被分成36個簇(圖1A),前5個最重要的基因突出顯示在熱圖上(圖1B)。HCC中有9種主要的細胞類型,除肝細胞、平滑肌細胞、內皮細胞、組織干細胞外,還有許多免疫細胞(PRPTC+),包括T細胞、單核細胞、自然殺傷(NK)細胞、巨噬細胞、B細胞(圖1D、E)。在研究9種細胞系的分布時,作者注意到腫瘤組織中的主要細胞類型為肝癌細胞,而正常組織中的主要細胞類型為T細胞(圖1C)。瘤內和瘤周組織中T細胞和NK細胞的差異很大。作者認為,腫瘤組織中T細胞和NK細胞的耗竭與免疫抑制的形成有關,與腫瘤的進展有不可分割的聯系。與T細胞和NK細胞相比,HCC腫瘤組織中巨噬細胞和單核細胞的比例增加(圖1F)。新抗原是腫瘤特異性抗原(TSAs),來源于癌細胞中突變基因的表達,在正常組織中不存在。這些新抗原可吸引巨噬細胞以及單核細胞分化的DCs,后者可吞噬和呈遞這些新抗原,導致巨噬細胞和單核細胞在HCC腫瘤組織中聚集。隨后,分析了腫瘤組織與正常組織之間的基因表達差異(表S1),選出了表達量最高的5個基因,分別是腫瘤組織中的SPP1、AKR1C2、AKR1B10、AGT、EPHX1和正常組織中的NKG7、KLRD1、KLRB1、CCL5、CST7。然后標記上述基因在各細胞系中的表達情況(圖1G, H)。正常組織中的高表達基因主要分布在T細胞和NK細胞中,且NKG7、KLRD1、KLRB1是T細胞和NK細胞的標記基因。
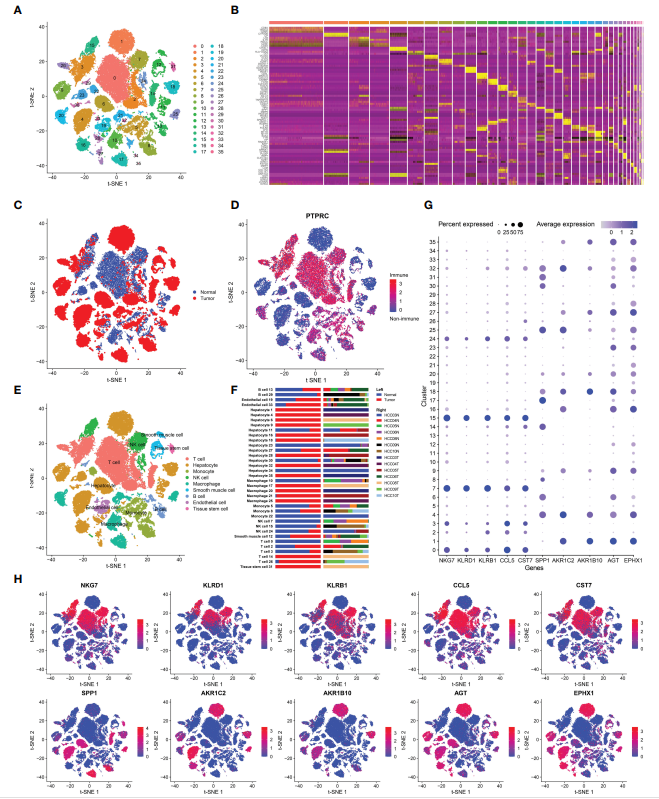
圖1 肝癌的細胞類型分類
2. Treg細胞在HCC中富集,具有明顯的代謝特征
為了研究T細胞的異質性,將12,884 個T細胞分為15個亞組,主要有4種細胞亞型:CD8+Tem、CD4+Tem、CD8+Tcm和Treg細胞。其中,CD8+ Tem細胞在正常組織中所占比例最高,而CD4+ Tem、CD8+ Tcm、Treg細胞主要在HCC組織中發現(圖2C, D)。四種t細胞亞型的前三種標記基因如圖2E所示。接下來,作者確定了四種t細胞亞型中免疫檢查點的表達水平(圖2F)。一些抑制檢查點,如TIGIT, CTLA4, TNFRSF4和TNFRSF9,僅在Treg細胞中過表達。盡管Treg細胞是免疫細胞的次要組成部分,但在時間網絡中發揮著關鍵作用。Treg細胞抑制抗癌免疫,阻礙對癌癥的保護性免疫監視,阻止有效的抗腫瘤免疫反應的形成,從而促進腫瘤的發生發展。上述僅在Treg細胞中高表達的免疫檢查點可以被認為是在HCC中恢復對癌細胞免疫的潛在治療靶點。此外,坐著利用Monocle2 R包繪制了T細胞分化軌跡(圖2G, H)。來自HCC組織的Treg細胞主要分布在分化軌跡的起點和終點,而CD8+ Tem細胞主要分布在分化軌跡的中間。通過調控Treg細胞分化和發育來耗盡和控制Treg細胞的策略值得進一步探索。此外,GSEA結果顯示,與其他t細胞亞型相比,Treg細胞富集了糖酵解、糖異生、谷胱甘肽代謝、淀粉和蔗糖代謝等代謝途徑(圖2I),表明HCC中Treg細胞不受代謝抑制,具有代謝的靈活性。該項研究結果將有助于更好地理解異常Treg細胞代謝的促腫瘤機制及其對分化和發展過程的影響。
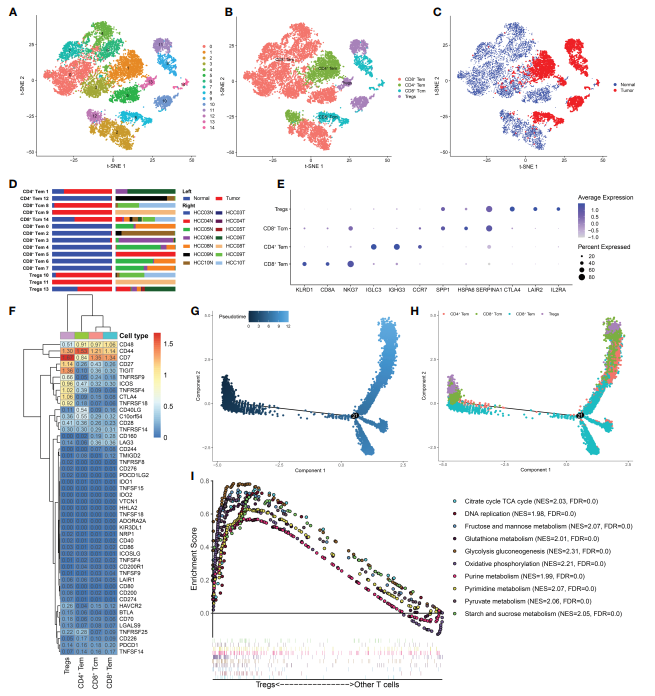
圖2 Treg細胞在HCC中富集,具有明顯的代謝特征
3. 巨噬細胞與肝癌的免疫抑制環境有關
為了研究HCC微環境中的相互作用網絡,采用基于python的細胞-細胞通訊分子分析工具CellphoneDB識別TME中的配體-受體對。使用Cytoscape對生成的網絡進行可視化。在HCC組織中,除了上皮細胞和平滑肌細胞外,巨噬細胞與其他細胞類型的交流最為豐富(圖3A),可見巨噬細胞在TME中起著重要作用。為了評估巨噬細胞的異質性,作者將所有巨噬細胞聚為8個亞簇(圖3B)。通過對細胞來源的注釋,簇1、2、4和7僅來自癌癥組織,而簇3和8僅來自正常組織。此外,簇5和簇6同時來自癌癥組織和正常組織(圖3C, D)。由于越來越多的證據顯示TREM2在腫瘤相關巨噬細胞(TAMs)和骨髓源性抑制細胞(MDSCs)中發揮作用,作者分析了TREM2在8個簇中的表達,發現TREM2在簇1、簇2和簇4中表達高(圖3E),這些簇都來自癌癥組織。為了進一步研究TREM2的臨床價值,將TCGA LIHC隊列中360例HCC患者根據TREM2的表達水平分為兩組。過表達TREM2組的預后明顯較差(圖3F),提示TREM2可能在TME的免疫抑制中起重要作用。隨后,確定免疫檢查點在8個聚類中的表達。簇1和簇4的LAIR1表達水平高于其他簇(圖3G)。LAIR1可以阻斷LAIR1和TGF-b信號通路來重塑TME,使PD - L1介導的腫瘤根除成為可能。作者的結果也表明PD - L1介導的腫瘤根除可能是一種潛在的治療策略。GSVA顯示,聚類4的細胞中脂肪生成、脂肪酸代謝和膽油酸代謝通路富集,而炎癥反應以及M2-like TAMs的特征,補體和干擾素(IFN)通路被顯著抑制(圖3H)。樹突狀細胞在與腫瘤代謝密切相關的過程中更顯著地富集,如上皮-間質轉化、缺氧和血管生成。最后,分析了TFs在各個子組中的表達情況。與其他簇相比,簇1和簇4的KLF6、PRDM1、STAT1、JUNB和HES1表達更高(圖3I)。這些結果表明巨噬細胞在TME免疫抑制中的重要作用,以及參與這一過程的潛在機制和TFs。
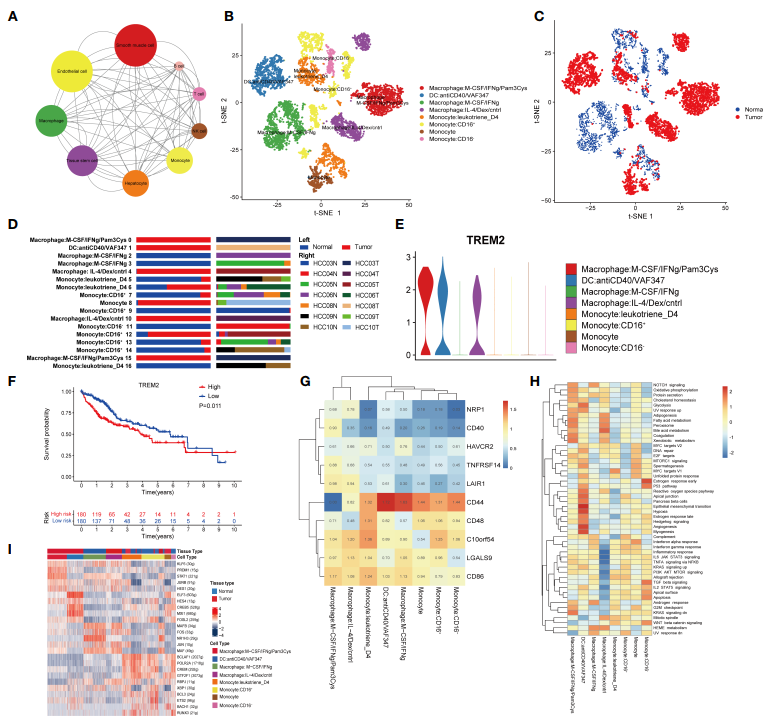
圖3 巨噬細胞與TME的免疫抑制環境有關
在瘤周和腫瘤組織中分別檢測到3151個和187個NK細胞,并將其聚類為11個子集(圖4A, B)。如前所述,與正常組織相比,腫瘤組織中NK細胞的比例顯著降低。在HCC中NK細胞明顯減少,提示癌細胞形成了一種抑制NK細胞增殖的環境,可能通過缺氧或代謝抑制,直接導致NK細胞抵抗攻擊。NK細胞在腫瘤和正常組織間的差異基因如圖4C所示(圖4C)。另外,腫瘤來源的NK細胞分布在簇9和10中,而其他簇的NK細胞則來自正常組織(圖4A、B)。為了研究簇9和簇10的異質性,檢測了NK細胞激活受體CD160、NCR3、IFNG (IFNG)和FASLG在簇9、簇10和正常組織中的表達(圖4D):與簇9的細胞相比,簇10的細胞具有更強的細胞毒性,而簇9的細胞則呈現出衰竭狀態,這表明NK細胞在腫瘤和慢性感染的情況下會耗盡,表現出低細胞毒性和效應功能。偽時間分析發現,簇10細胞出現在分化軌跡的開始階段,而簇9細胞則出現在分化軌跡的結束階段,這是一個耗盡的NK細胞子集(圖4E)。作者認為cluster 10細胞逐漸轉化為cluster 9細胞,腫瘤浸潤并形成TME。隨后,通過SCENIC分析發現,CEBPD、FOS和JUN調控的基因在cluster 10中顯著激活(圖4F)。這些結果證實了在HCC中存在兩種具有不同細胞毒性的NK細胞簇,并提示TME可能逐漸發展出多種抑制NK細胞免疫毒性的機制。

圖4 兩種不同的NK細胞亞群在HCC中具有不同的細胞毒能力
5. HCC中記憶B細胞低活性狀態
1395個B細胞,分為6個簇,并標注為4個亞型:B細胞、未成熟B細胞、記憶B細胞和漿細胞(圖5A)。幾乎所有未成熟B細胞都來自正常組織,而記憶B細胞則來自腫瘤組織(圖5B, C)。對記憶B細胞子集進行了進一步的分析,確定了腫瘤組織和正常組織之間記憶B細胞亞群的差異(圖5D)。利用CytoTRACE預測腫瘤來源記憶B細胞具有更高的分化潛能(圖5E, F)。同樣,比較不同組織來源記憶B細胞亞型的細胞周期發現,腫瘤來源記憶B細胞更大比例處于G2/M期,表明其增殖能力更強,與腫瘤來源記憶B細胞低分化狀態相一致(圖5G)。另外,腫瘤組織中處于激活狀態的記憶B細胞明顯少于瘤周組織(p = 0.011),這可能與抗腫瘤反應的發生有關(圖5H)。鑒于TME和癌細胞之間的串擾在腫瘤發生發展中的重要作用,作者比較了癌細胞和記憶B細胞之間的受體-配體對。發現與CD74+CXCR4+和CD74+CD44+相互作用的巨噬細胞遷移抑制因子(MIF)在腫瘤樣本中特異性表達(圖5I)。這也是首次發現MIF可抑制HCC中的記憶b細胞活性,抑制MIF-CD74軸可能是一種新的治療策略。
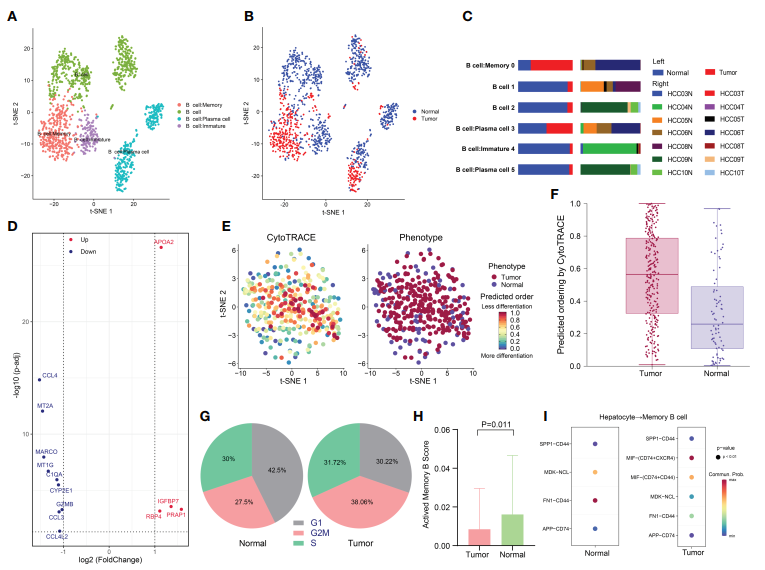
圖5 HCC中記憶B細胞低活性狀態
6. 肝癌細胞的高代謝和免疫抑制
作者發現肝癌細胞中存在明顯的CNV。同時,肝癌細胞中APOA2、APOA1、AMBP、TTR、APOH、ASGR1表達水平高。此外,來自同一患者的肝癌細胞往往聚集在一起(圖6A),這表明不同患者的肝癌細胞之間存在顯著的異質性。通過scRNA-seq數據分析檢測肝癌細胞與肝細胞之間的DEGs:MT1M, MT1H, MT1G, MT1F, MT1E, MT1X和MT1A,在癌細胞中顯著下調 (Table S2和Figure 6B)。GO富集分析顯示,上調的DEGs主要富集于核糖核苷酸代謝過程、嘌呤核苷酸代謝過程、前體代謝物和能量產生(圖6C)。GSVA結果與GO富集分析結果基本一致(圖6D),癌細胞的炎癥反應受到明顯抑制。SCENIC分析顯示,HSF1在癌細胞中顯著上調,HSF1通過誘導熱休克蛋白的表達來維持應激環境下的蛋白穩定(圖6H)。
為了根據癌細胞分化程度對HCC患者進行分層,并提供精確的治療建議,作者又進行了癌細胞分化軌跡(圖6E)。不同的腫瘤細胞分化狀態影響腫瘤細胞分化、進展以及患者預后。因此,使用ConsensusClusterPlus根據這些DEGs將TCGA LIHC患者分為3個簇(圖6F)。K-M分析顯示,聚類2組患者的OS明顯短于聚類1和聚類3組患者(圖6G)。聚類2組患者中晚期及腫瘤低分化患者較多,說明不同分化程度的癌細胞具有不同的侵襲能力,影響癌癥進展。

圖6 肝癌細胞的高代謝與免疫抑制
結論:
這項研究揭示了HCC的時間格局,強調了主要免疫細胞類型的異質性及其在免疫抑制環境形成中的潛在機制,為調節HCC的時間提供了新的理論基礎,并將有助于新的免疫療法的開發。






