新發現!轉錄組修飾與細胞自噬間的溝通
自噬對于維持細胞能量穩態和細胞適應營養缺乏至關重要,而調節自噬的營養傳感器在此前已有報道。然而,像m6A這樣的轉錄組修飾在調節饑餓誘導的自噬中的作用尚不清楚。本研究中,展示了m6A讀取器YTHDF3對誘導細胞自噬的作用。m6A修飾上調促進自噬形成和營養缺乏時溶酶體溶解。METTL3耗盡導致m6A修飾功能缺失,抑制YTHDF3介導的自噬通量。YTHDF3通過識別FOXO3 mRNA停止密碼子周圍的m6A修飾位點來促進自噬。YTHDF3還會招募eIF3a和eIF4B來促進FOXO3的翻譯,進而啟動自噬。本研究于2022年10月4日發表在期刊《Nature communications》上,IF:17.694。
技術路線:

主要研究結果:
1、YTHDF3上調是自噬誘導所必需的
為識別參與自噬的潛在的轉錄因子,作者進行了蛋白質組學分析,篩選小鼠胚胎成纖維細胞(Mouse embryonic fibroblasts,MEFs)中因營養缺乏而上調的蛋白質。作者發現m6A讀取器YTHDF3的水平顯著增加(圖1a),并用WB驗證了它的上調。在營養匱乏期間,YTHDF3水平顯著上升的同時,其他的YTH家族蛋白沒有明顯變化(圖1b)。這一發現與最近報道的缺氧YTHDF1上調表達有所不同。
分析是否YTHDF3誘導與自噬體的出現密切相關,作者用兩種不同的shRNA表達慢病毒敲低MEFs中YTHDF3。分析LC3-II存在或不存在溶酶體抑制劑bafilomycin A1(Baf.A1),結果發現沉默YTHDF3自噬體通量受損。作為自噬的另外一個指標,p62是一種自噬載體蛋白,能在自噬溶酶體中降解。而在對照細胞中,營養饑餓誘導p62降解,YTHDF3消融導致p62積累(圖1c),也表明自噬通量減少。WB分析顯示,與KD對照相比,YTHDF3恢復的營養缺乏MEF內源性LC3-II和p62降解水平均顯著增加(圖1d),證明YTHDF3挽救了shRNA誘導的自噬失活。YTHDF3的缺失持續且顯著降低了胞質中GFP-LC3點狀聚集(圖1e-f),而這種缺陷可以通過重新表達YTHDF3來挽救(圖1g-h)。此外,還發現YTHDF3過表達顯著增強自噬標志物的表達,降低p62水平(圖1i),表明YTHDF3不僅是維持生理性自噬所必需的,還介導了自噬增強。這一發現也得到了GFP-LC3實驗的證實,該實驗表明通過異位表達YTHDF3,細胞質中的GFP-LC3斑點數量增加(圖1j-k)。透射電鏡(TEM)證實YTHDF3確實導致自噬小體和自溶小體數量大幅減少(圖1l)。這些數據表明YTHDF3是一個正調控因子,是在營養缺乏時誘導自噬所必需的。
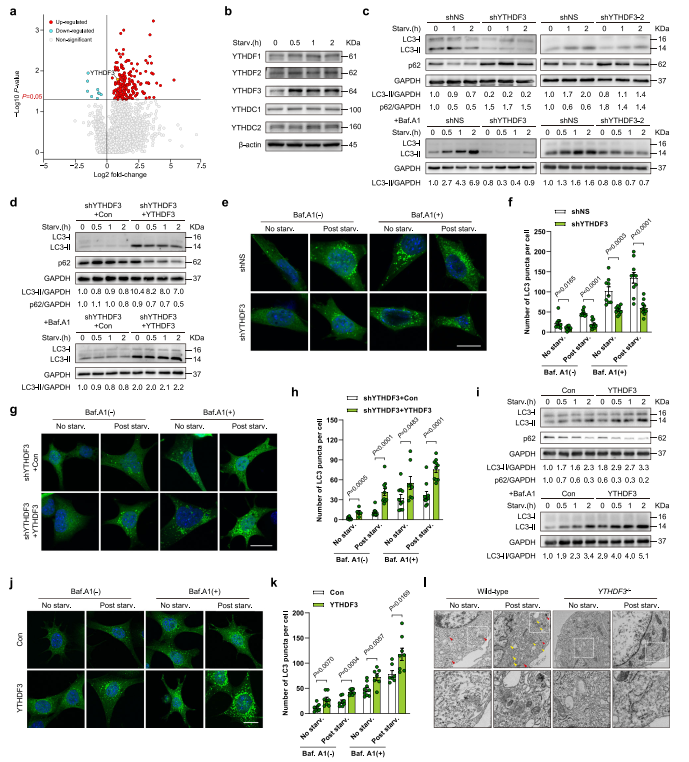
圖1 YTHDF3上調是自噬誘導所必需的
2、YTHDF3衰竭損害了自噬小體的形成和溶酶體的功能,mTORC1和AMPK信號不受YTHDF3的影響
作者進一步研究YTHDF3 KD細胞中自噬的哪個步驟被中斷。通過使用熒光標記的串聯mCherry-GFP-LC3報告蛋白,測量自噬體和自溶酶體的豐度。在營養匱乏的條件下,YTHDF3的損失使非酸性植物(mCherry+GFP+)和酸性(mCherry+GFP?)點狀數量急劇減少,說明明自噬小體的形成和自噬通量均嚴重受損(圖2a-b)。
在哺乳動物中,自噬通過ULK1復合物的刺激而啟動。當ULK1復合物被激活時,將III PtdIns3K復合物的組分磷酸化,在內質網(ER)膜上形成特化的Ptdins3P enated豐富子結構域。為探測YTHDF3是否有助于早期細胞自噬的形成。作者發現敲低YTHDF3抑制饑餓誘導的ULK1和ATG13的點形成(圖2c-d),表示UKL1復合體向吞噬體起始位點的易位受到了影響。與ATG13一致,在饑餓條件下敲低YTHDF3使ATG14點的形成和PtdIns3P結合蛋白DFCP1顯著減少(圖2c-d)。這些結果說明YTHDF3耗盡損害早期的自噬體形成,包括起始和成核。作者選擇Acridine orange(AO)作為染色劑(綠),用Baf.A1處理的細胞作為對照組,分析YTHDF3是否通過同時影響溶酶體活性來調節自噬通量。結果顯示YTHDF3-KD細胞紅綠熒光強度比降低(R/GFIR)(圖2e),說明沉默YTHDF3可以增加溶酶體pH值。LysoTracker Red staining也證實了這一結果(圖2f-g)。接下來,作者調查沉默YTHDF3是否影響溶酶體的水解功能。作者將DQ-Red BSA載入對照組和YTHDF3 KD細胞中,DQ-Red BSA在被溶酶體蛋白酶降解時釋放熒光單體。YTHDF3 KD細胞中紅色熒光減弱,表明細胞內蛋白水解減少(圖2h-i)。因為不同的內吞率可能會影響DQ-Red BSA販運到溶酶體中,作者使用cell-permeant Magic Red測量組蛋白酶B活性。結果顯示YTHDF3 KD細胞只具有較低的Magic Red(圖2j-k),提示溶酶體組織蛋白酶活性受損。這些結果表明YTHDF3耗盡損害自噬體的形成,導致溶酶體功能障礙。
基于上述結論,作者考慮YTHDF3是否影響上游mTORC1和AMPK信號的活性。作者通過測定mTOR在S2448和mTORC1下游靶點的磷酸化狀態來分析mTORC1活性,包括p70S6K在T389和4E-BP1在T37/46。在對照組和YTHDF3 KD細胞中,mTOR S2448、p70S6K T389和4E-BP1 T37/46的磷酸化水平在營養缺乏時顯著降低(圖2l)。作者通過測量AMPK α在T172和AMPK底物RAPTOR在S792的磷酸化水平來評估YTHDF3是否調節AMPK活性。AMPK α T172和RAPTOR S792的磷酸化水平在營養饑餓時顯著增加,而YTHDF3 KD細胞中的變化模式與對照組細胞相同(圖2m)。這些數據表明,mTORC1和AMPK信號不受YTHDF3的影響。
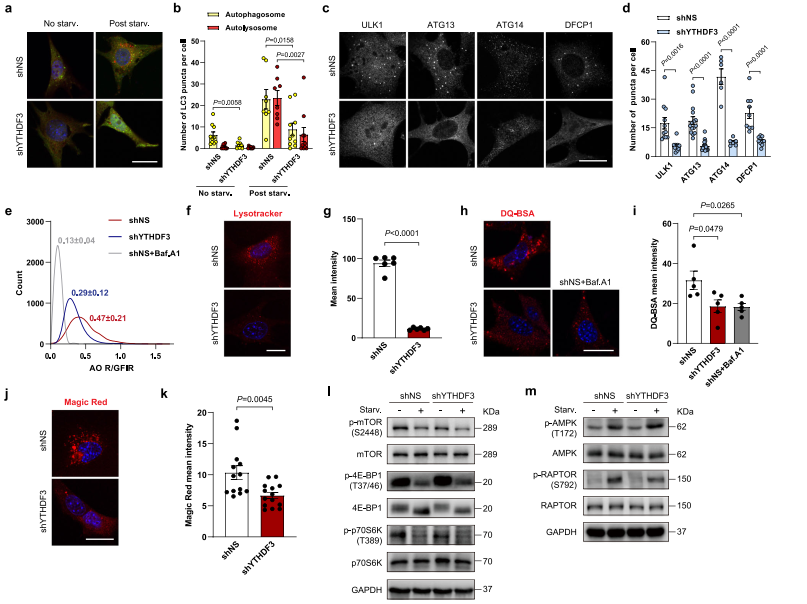
圖2 YTHDF3衰竭損害了自噬小體的形成和溶酶體的功能
3、YTHDF3需要METTL3介導的m6A修飾來促進自噬
為評估自噬過程中m6A的變化,作者使用一種識別m6A修飾核酸的抗體進行了免疫熒光分析。研究發現在營養缺乏時m6A信號于細胞質中積累(圖3a-b)。同時,YTHDF3也在這一過程中積累(圖3a-b)。用oligo(dT)純化的Poly(A)+ RNA在營養缺乏時m6A修飾顯著增加(圖3c),提示mRNA的m6A水平在自噬誘導過程中升高。
作者希望鑒別了負責mRNA的m6A超甲基化的m6A編碼器,發現只有METTL3在營養匱乏條件下顯著誘導(圖3d)。敲低METTL3降低自噬誘導過程中mRNA的高甲基化(圖3e)。這說明METTL3在營養匱乏條件下對m6A的誘導是必需的。
作者觀察到d3-m6A與RNA探針的摩爾比在饑餓后6小時下降(圖3f),表明METTL3的催化活性下降。有趣的是,METTL3蛋白水平在長時間饑餓中沒有顯著變化(圖3g)。作者推測這可能是細胞在營養耗竭狀態下的一種代償機制。研究使用兩種不同的shMETTL3慢病毒感染過表達YTHDF3的MEFs,發現營養饑餓誘導的LC3-II積累和p62降解顯著減弱(圖3h)。是否METTL3對ythdf3促進自噬的作用依賴于其m6A催化活性,作者將野生型或催化突變型METTL3重新引入到METTL3沉默的細胞中,并表明野生型METTL3,而不是催化突變型,可以挽救自噬缺陷METTL3沉默細胞(圖3i)。與這些結果一致的是,一項mCherry-GFP - LC3串聯報告實驗表明,在過表達YTHDF3的MEFs中,營養缺乏時,METTL3的損耗會影響自噬體和自溶酶體的生成(圖3j-k),并且野生型METTL3可以恢復這種功能失活,而催化突變體則不能(圖3l-m)。總的來說,這些數據表明YTHDF3需要METTL3介導的m6A修飾來促進自噬。

圖3 YTHDF3需要METTL3介導的m6A修飾來促進自噬
4、受抑制的RPS27a-METTL3相互作用使METTL3在饑餓下穩定
為測試METTL3是否參與轉錄調控,作者首次分析營養缺乏狀況下,METTL3 mRNA豐度。研究結果顯示在營養匱乏的條件下,METTL3 mRNA豐度小幅度增加(圖4a)。然后作者檢測營養饑餓是否影響METTL3 mRNA的穩態,沒有觀察到顯著差異(圖4b)。但METTL3蛋白營養饑餓時上調在一個經典的蛋白酶抑制劑MG132的治療下完全消除了(圖4c)。這表明營養缺陷下METTL3是蛋白質穩定性的主要控制因子。環己酰亞胺(CHX)的chase實驗證實了這一觀點,揭示了饑餓狀況減弱METTL3蛋白的降解(圖4d)。此外,作者還發現營養饑餓顯著降低METTL3泛素化(圖4e)。為識別與METTL3相互作用的潛在調控因子,并解釋其在饑餓反應中去泛素化的原因,作者在MEFs中過表達Flag標記的METTL3,并將抗Flag免疫沉淀物進行質譜分析。令人驚喜的是,作者發現了6個泛素化相關蛋白與METTL3共化,包括RPS27a,RPL23,RPL11,RPS2,RPS3和HSPA5(圖4f)。研究數據揭示營養饑餓減緩了RPL27a與METTL3的相互作用,增加了RPL11和RPL23與METTL3的相互作用(圖4f-g)。而且RPS27a,RPL23和RPL11的表達沒有受到饑餓的顯著影響(圖4h)。這些結果說明這些蛋白質與METTL3的相互作用將影響METTL3蛋白的泛素化和穩定性。作者檢測了MEFs中METTL3的表達來進一步驗證上述結果,這些MEF轉染了分別靶向RPS27a,RPL23和RPL11的siRNA,發現siRPS27a MEFs中METTL3上調,但RPL11或RPL23敲低的MEFs中METTL3沒有顯著變化(圖4i)。因為RPS27a是一種泛素融合蛋白,它可以釋放活性泛素單體,介導蛋白的泛素降解,所以作者研究了RPS27a是否導致METTL3泛素化。結果顯示RPS27a強烈減弱的METTL3泛素化抑制(圖4j)。這些結果表明,營養饑餓時RPS27a-METTL3相互作用受損導致METTL3泛素化抑制,從而增強METTL3穩定性。
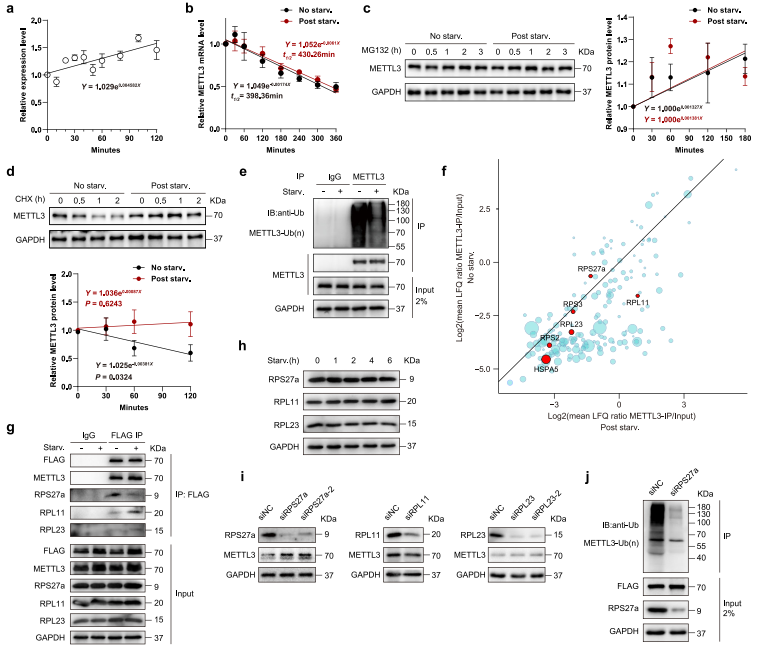
圖4 受抑制的RPS27a-METTL3相互作用使METTL3在饑餓下穩定
5、YTHDF3識別饑餓誘導的FOXO3 mRNA的m6A高甲基化
接下來,作者嘗試識別營養缺乏時與不同的YTHDF3結合的mRNA。發現了1041個上調的,1814個下調的轉錄因子(圖5a)。分析這些結合位點,m6A核心基序“GGAC”被高度檢測到(圖5b)。大多數的這些結合位點定位在蛋白編碼轉錄和高度聚集在CDS和3’UTR區域,特別是在停止密碼子附近(圖5c),與m6A峰的分布模式一致。因此,作者推斷在營養缺乏時mRNA能與YTHDF3結合主要依賴于m6A修飾。
隨后,作者發現與正常組織相比,營養缺乏時期,共2811個mRNA的m6A峰增多和2552個mRNA的m6A峰減少(圖5d)。
為鑒別營養缺乏時與YTHDF3結合增加潛在的m6A高甲基化靶點,作者將營養缺乏時YTHDF3 RIP-seq富集峰與超m6A峰交叉,得到了86個峰(圖5e)。在這86個峰中,有7個基因被注釋到GO-term自噬(0006914),包括FOXO3,BMF,DDIT3,AP4M1,SESN2,ZFYVE1和ZFYVE26(圖5e)。RIP-qPCR實驗結果表明,YTHDF3營養缺乏時,這些自噬相關轉錄本中FOXO3富集的最為顯著(圖5i),并且都依賴于METTL3。
根據研究數據顯示,當營養缺乏時,FOXO3 mRNA中的m6A高甲基化峰位于終止密碼子周圍的CDS和3'UTR區域(圖5f)。MeRIP-qPCR分析驗證沉默METTL3減少了由于營養缺乏而在FOXO3轉錄本停止密碼子周圍CDS和3'UTR區域的m6A峰,也減弱了m6A高甲基化水平(圖5g-h)。與FOXO3 mRNA衰減的m6A同步,YTHDF3與FOXO3 mRNA的結合相應減少(圖5i)。作者使用重組YTHDF3蛋白和含有不同FOXO3的CDS或序列的生物素化RNA探針進行了電泳遷移率轉移試驗(EMSAs)3'UTR加或不加m6A修飾。結果表明,一旦從RNA探針上去除m6A修飾,無論m6A位于FOXO3的CDS或3'UTR中,YTHDF3與探針之間的相互作用都顯著減弱(圖5j-k)。此外,由于與YTHDF3結合的探針1或3的觀察到的帶強度顯著高于與YTHDF3結合的其他探針,作者推斷FOXO3-CDS上2158 nt、2151 nt、2163 nt(探針1)和2295 nt(探針3)的m6A位點對于YTHDF3識別FOXO3終止密碼子區域可能比其他m6A位點更關鍵(圖5j-k)。總之,這些結果表明,在營養缺乏期間,METTL3介導的m6A高甲基化是YTHDF3 - FOXO3 mRNA相互作用所必需的。

圖5 YTHDF3識別饑餓誘導的FOXO3 mRNA的m6A高甲基化
6、FOXO3是YTHDF3促進自噬的關鍵
為研究YTHDF3在調節FOXO3表達中的作用,研究敲低YTHDF3,發現在正常和營養饑餓條件下,FOXO3蛋白水平都顯著降低(圖6a)。相應地,YTHDF3過表達導致FOXO3表達增加(圖6a)。沉默YTHDF3導致參與自噬起始、成核、擴張和自噬溶酶體融合的FOXO3靶點的mRNA水平降低,而過表達YTHDF3導致這些基因的表達上調(圖6b)。WB實驗進一步驗證了這些變化(圖6c)。數據顯示,在營養匱乏時,p-FOXO3(S413)水平在細胞核中增加,在細胞質中減少,其方式與總組分類似(圖6a)。另一方面,作者檢測到YTHDF3 KD細胞中pFOXO3(S413)水平下降,而YTHDF3過表達導致相反的效果。然而,磷酸化FOXO3與泛FOXO3的比值不受明顯影響(圖6a)。這些結果表明,YTHDF3可能在調節FOXO3的翻譯中起關鍵作用,而不是FOXO3翻譯后修飾如磷酸化。通過沉默或過表達YTHDF3,大部分FOXO3參與自噬的靶基因包括在mRNA和蛋白水平上均有顯著變化。然而,四個基因(BECN1、ATG12、ATG4A和ATG4C)的蛋白水平變化非常輕微,而它們的轉錄水平卻發生了顯著變化(圖6b-c)。作者認為這可能是由于基因特異性和細胞類型依賴性基因表達規則的差異。接下來,作者研究了METTL3缺失后FOXO3的表達情況。在正常和饑餓條件下,敲低METTL3明顯抑制了YTHDF3過表達MEFs細胞核和細胞質中FOXO3的表達水平(圖6d)。在METTL3沉默的細胞中,細胞核中的FOXO3明顯低于對照細胞,因為它在饑餓的反應中轉移到細胞核(圖6d)。此外,參與自噬的FOXO3靶基因的大部分蛋白水平也被METTL3敲除減弱,而被METTL3過表達增強(圖6e)。然而,在沉默或過表達METTL3的MEFs中也檢測到FOXO3靶點表達的差異(圖6e)。綜上所述,這些數據進一步表明YTHDF3具有調節作用FOXO3的表達和改變FOXO3靶向自噬基因的表達依賴于METTL3。
為確定受損的FOXO3表達是否導致YTHDF3缺陷細胞的自噬功能障礙,研究進行了拯救實驗(圖6g)。在YTHDF3缺陷的細胞中異位表達FOXO3,挽救了在Baf.A1存在和不存在的情況下自噬標志物水平的降低,挽救了p62的降解(圖6h),恢復了FOXO3靶基因的表達水平(圖6i-j)。利用mCherry-GFP-LC3報告載體,作者證明了FOXO3的異位表達極大地恢復了YTHDF3缺陷引起的自噬體形成和自噬流缺陷(圖6k-l)。為進一步確定FOXO3在YTHDF3調節自噬中的作用,敲除FOXO3并檢測YTHDF3的實驗數據顯示,沉默FOXO3顯著阻礙YTHDF3促進的LC3-II水平上調和p62降解(圖6m)。mCherry-GFP-LC3報告基因實驗表明,敲除FOXO3抑制饑餓時YTHDF3過表達誘導的自噬體和自溶酶體的形成(圖6n-o)。這些結果表明FOXO3是YTHDF3促進自噬的關鍵功能靶點。

圖6 FOXO3是YTHDF3促進自噬的關鍵
7、YTHDF3促進FOXO3翻譯,但是不影響其mRNA的穩定性
作者想知道YTHDF3調控FOXO3表達的機制。敲除YTHDF3并沒有影響FOXO3 mRNA的水平(圖7a),這表明YTHDF3可能對FOXO3的翻譯有影響。多聚體分析證明了這種破壞YTHDF3在40S/60S核糖體和80S單體部分顯著增加,在多聚體部分顯著減少(圖7b)。YTHDF3缺陷細胞的翻譯池(多體)中FOXO3 mRNA的水平低于對照細胞(圖7c),表明YTHDF3的缺失減弱了FOXO3的翻譯。
為解決FOXO3-CDS中m6A位點對YTHDF3促進FOXO3轉譯的影響,作者生成了野生型和突變型FOXO3-CDS表達結構。上游CDS的m6A突變基序(FOXO3-CDS-mut2)作為對比。數據顯示FOXO3-CDS-mut1而不是FOXO3- CDS -mut2消除了YTHDF3增強的FOXO3表達(圖7d),這表明FOXO3- CDS中終止密碼子附近的m6A位點在YTHDF3促進FOXO3的翻譯中起著關鍵作用。熒光素酶報告基因檢測YTHDF3促進FOXO3翻譯。鑒定出的FOXO3的3’ UTR部分,被克隆到pEZX-MT06載體中報告基因螢火蟲熒光素酶的3 ' UTR區域(圖7e)。這些結果表明FOXO3-中終止密碼子附近的m6A位點3'UTR區域也參與調節YTHDF3 FOXO3翻譯。
此外,作者還研究了YTHDF3是否調節FOXO3 mRNA的穩定性。用轉錄抑制劑放線菌素D(actinomycin D,Act D)處理,在對照組和YTHDF3缺陷細胞組之間無顯著差異(圖7h),表明YTHDF3不影響FOXO3 mRNA的穩定性。數據表明,YTHDF3促進FOXO3的翻譯取決于它對FOXO3 CDS和3'UTR區域停止密碼子周圍m6A位點的識別,但YTHDF3不影響FOXO3 mRNA的穩定性。
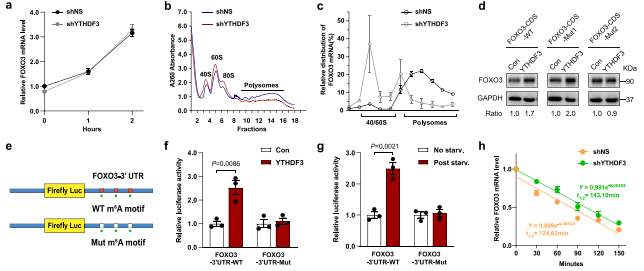
圖7 YTHDF3促進FOXO3翻譯,但是不影響其mRNA的穩定性
8、YTHDF3可能與eIF3a和eIF4B相互作用促進FOXO3的翻譯
從免疫共沉淀(co-IP)LC-MS / MS數據中,作者注意到YTHDF3與多個翻譯起始因子共純化。eIF3a和eIF4B是營養缺乏時最顯著上調的蛋白質(圖8a-b)。對不同核糖體組分的WB分析發現,當YTHDF3缺失時,eIF3a和eIF4B從較重的多聚體組分轉移到較輕的多聚體組分(圖8c),表明eIF3a和eIF4B可能在YTHDF3對翻譯的影響中發揮作用。silico docking分析顯示eIF3a、eIF4B和YTHDF3之間存在潛在的蛋白質相互作用。
在對接能最低的對接模型(YTHDF3-eIF3a: - 1002.8; YTHDF3-eIF4B: - 834.7)中,以下殘基被定位在模型界面并負責相互作用:YTHDF3中的Y424、E426和T441以及eIF3a中的R476、R483和I484;YTHDF3中的Y424、T441和S470以及eIF4B中的S88、F99和Y141(圖8D)。co - IP實驗發現在正常和無營養條件下,內源性eIF3a和eIF4B與YTHDF3共沉淀;營養饑餓可以同時增加沉淀的eIF3a、eIF4B和YTHDF3的數量。在YTHDF3 KD MEFs中,有少量蛋白沉淀(圖8e)。接下來,作者在裂解液中添加RNase A并沒有減少與YTHDF3分離的eIF3a和eIF4B的量,這表明這種相互作用是不依賴于RNA的(圖8f)。為確定eIF3a和eIF4B對FOXO3翻譯的影響,作者使用shRNA慢病毒敲低eIF3a或eIF4B(圖8g)。敲低這兩種蛋白中的任何一種都降低了FOXO3蛋白水平(圖8g),表明FOXO3的翻譯被削弱了。這些結果表明YTHDF3可能與eIF3a和eIF4B相互作用,促進FOXO3的翻譯。Co-IP實驗也證實了YTHDF3與PABP1或eIF4G2在MEFs中的相互作用。然而,這些相互作用在營養饑餓后顯著減少(圖8h),而YTHDF3和eIF3a或eIF4B之間的相互作用增加(圖8e),表明YTHDF3和翻譯起始調節因子之間的相互作用在不同的細胞亞型和不同的細胞應激條件下可能有很大的不同。
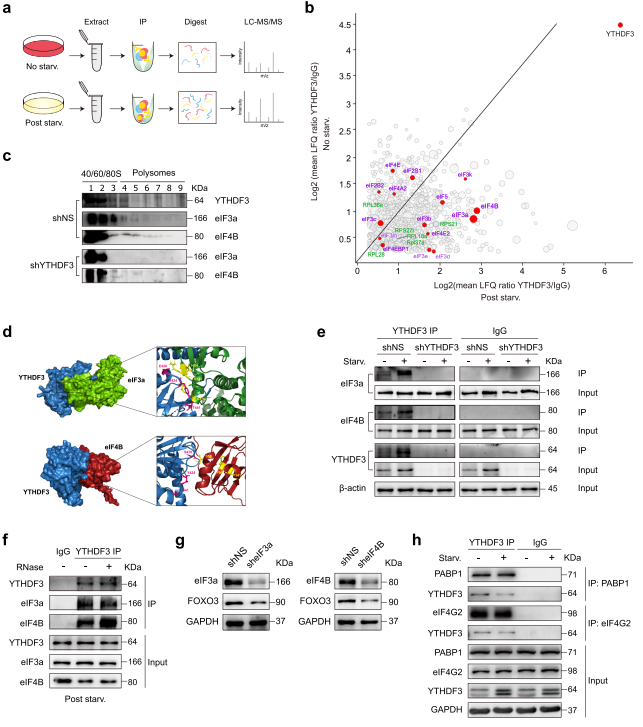
圖8 YTHDF3可能與eIF3a和eIF4B相互作用促進FOXO3的翻譯
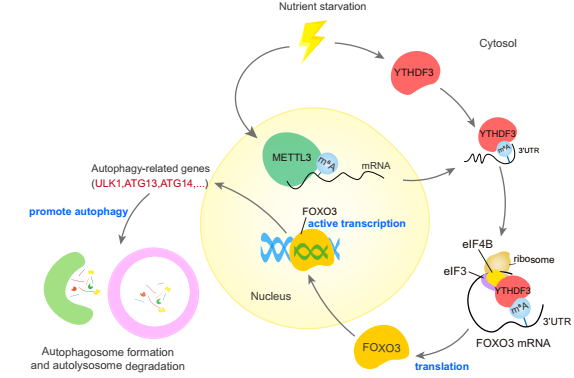
圖9 機制圖
結論
總的來說,本研究揭示了轉錄組學和自噬之間的重要聯系。作者提供了m6A閱讀器的證據YTHDF3作為一個營養應答器,結合m6A高甲基化,由METTL3安裝在FOXO3 mRNA的停止密碼子周圍,然后YTHDF3募集eIF快速促進FOXO3的翻譯,進一步在轉錄上激活核心自噬基因的一部分,從而促進自噬。
參考文獻
Hao W, Dian M, Zhou Y, Zhong Q, Pang W, Li Z, Zhao Y, Ma J, Lin X, Luo R, Li Y, Jia J, Shen H, Huang S, Dai G, Wang J, Sun Y, Xiao D. Autophagy induction promoted by m6A reader YTHDF3 through translation upregulation of FOXO3 mRNA. Nat Commun. 2022 Oct 4;13(1):5845. doi: 10.1038/s41467-022-32963-0.






