LnRNA提供了重要的染色質(zhì)支架——為蛋白質(zhì)相互作用和骨髓瘤生長
多發(fā)性骨髓瘤是一種復(fù)雜的漿細胞惡性腫瘤,約占血液系統(tǒng)腫瘤的10%,目前仍無法治愈。越來越多的證據(jù)表明非編碼RNA(noncoding RNA,ncRNA)在多發(fā)性骨髓瘤中發(fā)揮關(guān)鍵作用。在本研究中,作者使用了大規(guī)模的CRISPR干擾活性篩選來詢問多發(fā)性骨髓瘤中細胞生長對lncRNA基因的依賴性,并確定了miR-17-92集群宿主基因(MIR17HG)的突出作用,發(fā)現(xiàn)一種MIR17HG衍生的lnc-17-92,以一種獨立于microRNA和DROSHA的方式為c-MYC與WDR82之間的相互作用提供了染色質(zhì)支架,從而促進ACACA的表達。本研究建立了一種新的致癌基因MIR17HG,為轉(zhuǎn)化臨床試驗提供了有效的抑制劑。
技術(shù)路線:
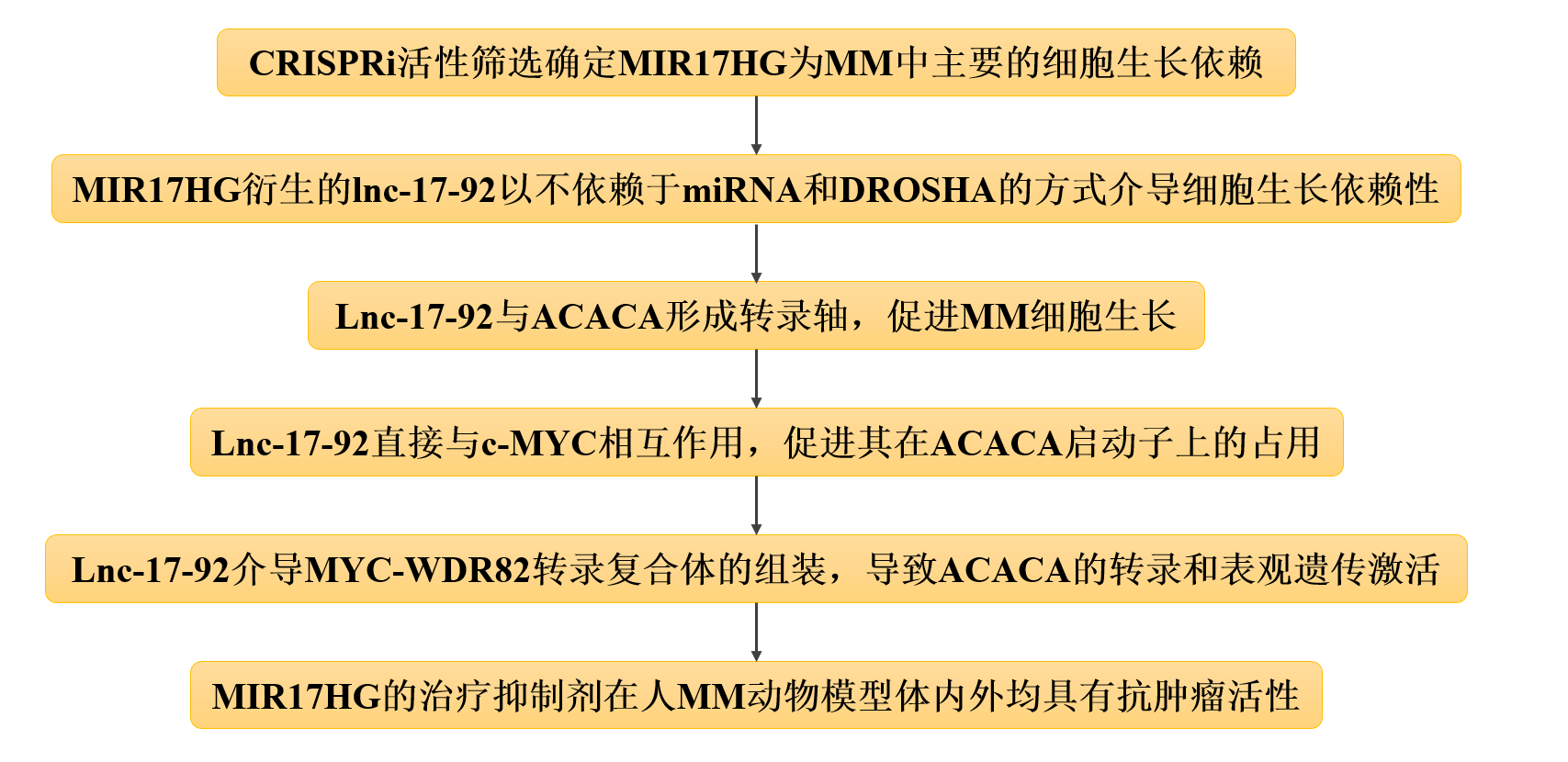
主要研究結(jié)果:
1、CRISPRi活性篩選確定MIR17HG為MM中主要的細胞生長依賴
作者分析了360個新診斷的多發(fā)性骨髓瘤(MM)患者的RNA-seq數(shù)據(jù),并在原代MM細胞和70個MM細胞系中鑒定了913個lncRNA轉(zhuǎn)錄本( 圖1A,I )。為系統(tǒng)地研究這些lncRNA在MM細胞生長中的作用,作者轉(zhuǎn)導(dǎo)了3個MM細胞系( H929、KMS-11和KMS-12-BM ),該細胞系表達了dCAS9 - KRAB融合蛋白,該文庫由7個sgRNA(small guide RNA)組成,分別針對所識別的lncRNA的913個轉(zhuǎn)錄起始位點( TSS )和576個陰性對照sgRNA ( 圖1A、II )。3周后,作者使用深度測序和基于模型的全基因組CRISPR - Cas9基因敲除( MAGeCK )穩(wěn)健排序聚合算法( RRA )對MM細胞群體中相對貧乏或富集的sgRNA進行了測試。
最富集或最貧乏的sgRNA在次級篩選中進一步測試,使用224個靶向lncRNA的TSS混合文庫,已知蛋白編碼癌基因( MYC、IRF4 )或腫瘤抑制因子( TP53 )的TSS作為陽性對照,2245個非靶向sgRNA作為陰性對照( 圖1A,III )。在次級篩選中,4個MM細胞系( H929、KMS11、KMS12BM和AMO1)被用來檢測和排序顯著耗盡或富集的sgRNA。如預(yù)期的那樣,靶向IRF4和MYC的sgRNA在3種( MYC )或全部( IRF4 )細胞系中顯著缺失,而靶向TP53的sgRNA在兩種TP53野生型細胞系( AMO1和H929 )中顯著富集。
作者對sgRNA敲除進行排序分析,發(fā)現(xiàn)MIR17HG是最主要的依賴,在所有測試的細胞系中,RRA評分等于或優(yōu)于靶向MYC或IRF4的評分(圖1B)。為進一步驗證這一數(shù)據(jù),作者接下來在四環(huán)素誘導(dǎo)系統(tǒng)啟動子的調(diào)控下,轉(zhuǎn)導(dǎo)4個靶向MIR17HG的sgRNAs轉(zhuǎn)導(dǎo)表達dCAS9 - KRAB融合蛋白的MM細胞系,觀察到感染非靶向sgRNAs的細胞相比,持續(xù)暴露于強力霉素后,細胞生長減少(圖1C)。此外,作者使用2種不同的鎖核酸( LNA ) gapmeR ASOs(反義寡核苷酸)靶向MIR17HG新生RNA ( pre-RNA ),用于RNase H介導(dǎo)的降解,轉(zhuǎn)染11種MM細胞系,包括對常規(guī)抗MM藥物(AMO1-ABZB對硼替佐米耐藥;AMO1-ACFZ對卡非佐米耐藥;MM.1 R對地塞米松耐藥)耐藥的細胞系,并證實對MM細胞活力的顯著影響?yīng)毩⒂谶z傳和分子背景(圖1D)。
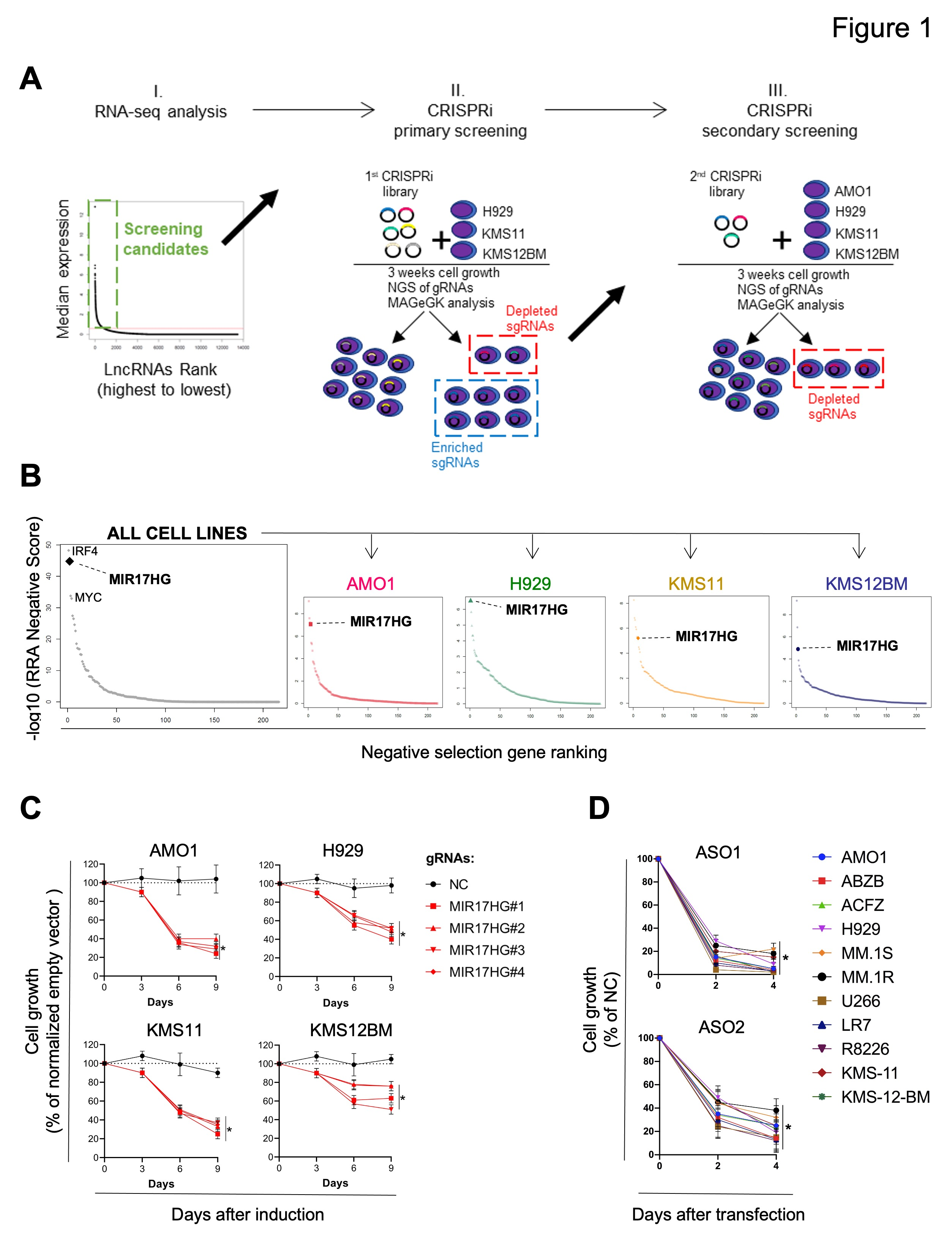
圖1 CRISPRi活性篩選確定MIR17HG為MM中主要的細胞生長依賴
2、MIR17HG衍生的lnc-17-92以不依賴于miRNA和DROSHA的方式介導(dǎo)細胞生長依賴性
MIR17HG是miRNA簇miR-17-92和lncRNA的一個位點,命名為lnc-17-92。lnc-17-92有兩種異構(gòu)體,一種是~ 5000 nt長的(lnc-17-92TV1),另一種是~ 900 nt的( lnc-17-92TV2),它們都尚未被功能研究( 圖2A )。在MM細胞系中,作者通過單分子RNA-FISH證明了lnc-17-92的核富集( 圖2B )。作者發(fā)現(xiàn)在3個大隊列的初診MM患者中,lnc-17-92的高表達與更短的無事件生存( EFS )和總生存( OS )相關(guān)( 圖2C )。
為檢測lnc-17-92的獨立活性,作者首先通過異位表達原始前體pri-mir-17-92建立過表達miR-17-92的兩種MM細胞系。在這些細胞系中特異性敲除lnc-17-92,ASOs靶向MIR17HG前體RNA的5’ 端,該區(qū)域不被pri-mir-17-92覆蓋,并觀察到細胞生長的顯著抑制,而異位的pri-mir-17-92不能挽救細胞生長( 圖2D )。接下來,作者建立了兩個DROSHA基因敲除( DR-KO )的MM細胞系( AMO1DR-KO和H929DR-KO),使用ASO1處理敲低lnc-17-92后,在DR-WT和DR-KO細胞系統(tǒng)中仍然觀察到強烈的抗增殖活性( 圖2E )。重要的是,在NOD SCID小鼠中,暴露于gymnotic ASO1會破壞AMO1DR-KO細胞建立腫瘤的能力,導(dǎo)致動物生存期延長(圖2E - G)。這些結(jié)果表明,lnc-17-92TV1是MIR17HG癌癥依賴性的主要中介因子,獨立于miR-17-92的作用和生物發(fā)生途徑。
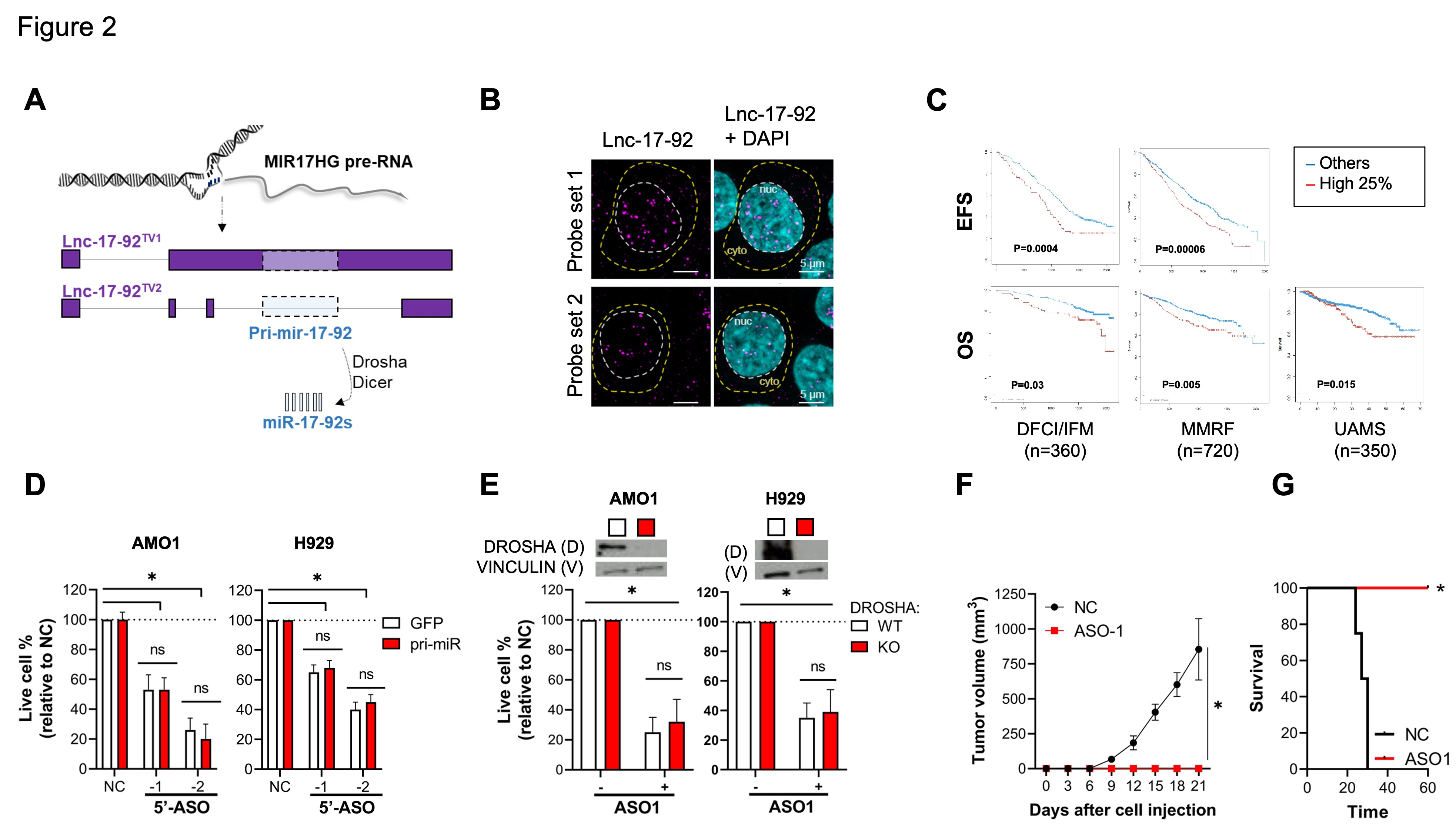
圖2 MIR17HG衍生的lnc-17-92以不依賴于miRNA和DROSHA的方式介導(dǎo)細胞生長依賴性
3、Lnc-17-92與ACACA形成轉(zhuǎn)錄軸,促進MM細胞生長
Lnc-17-92的核富集提示其可能在基因表達調(diào)控中發(fā)揮作用。因此,作者在DR-WT ( AMO1和H929 )和DR-KO ( AMO1DR-KO ) MM細胞系中使用早期暴露于gymnotic ASO1來消除lnc-17-92,以避免在DROSHA WT細胞中調(diào)節(jié)miR-17-92和miR-17-92的經(jīng)典靶標(biāo),并在所有測試的細胞系中鑒定出7個lnc-17-92消除后迅速下調(diào)的基因( 圖3A )。作者在體外用ASO1處理3例MM患者的CD138 +細胞驗證了這些發(fā)現(xiàn)( 圖3B )。此外,作者在2個大型RNA-seq MM患者數(shù)據(jù)集( IFM / DFCI和MMRF / CoMMpass)中觀察到lnc-17-92與其靶基因之間存在顯著的正相關(guān)性( Spearman r > 0.3 ; p < 0.001) ( 圖3C )。
利用熒光素酶報告基因?qū)嶒灒?93TDR - KO細胞中,在存在或不存在lnc-17-92缺失的情況下,作者證明了lnc-17-92對這些基因的調(diào)控,除了ANO6,發(fā)生在啟動子水平( 圖3D )。與此一致,作者通過染色質(zhì)分離RNA沉淀( ChIRP )實驗和qRT - PCR分析證實了lnc-17-92在頂端靶標(biāo)ACACA的啟動子區(qū)域存在相互作用( 圖3E ),并且通過對lnc-17-92和ACACA前體mRNA的單分子雙RNA FISH分析顯示lnc-17-92頻繁地定位到ACACA位點( 圖3F )。與隨機斑點相比,lnc-17-92在ACACA基因位點的近端定位明顯更頻繁( 圖3F )。
在已確定的lnc-17-92靶點中,ACACA對MM細胞的增殖和存活影響最大( 圖3G )。ACACA編碼脂肪從頭合成途徑的限速酶ACC1,在不同的癌癥環(huán)境中支持腫瘤發(fā)生。這些數(shù)據(jù)表明lnc-17-92是一種染色質(zhì)相互作用的lncRNA,具有轉(zhuǎn)錄調(diào)節(jié)功能。

圖3 Lnc-17-92與ACACA形成轉(zhuǎn)錄軸,促進MM細胞生長
4、Lnc-17-92直接與c-MYC相互作用,促進其在ACACA啟動子上的占用。
作者進行RNA Protein pull-down ( RPPD )實驗,發(fā)現(xiàn)MYC與lnc-17-92TV1形成復(fù)合物( 圖4A )。用MYC抗體進行RNA免疫沉淀實驗( RIP )證實lnc-17-92TV1的富集( 圖4B )。此外,RNA yeast-3-雜交( Y3H )實驗證實了在體內(nèi)細胞模型中l(wèi)nc-17-92TV1-MYC相互作用,如酵母克隆生長所示( 圖4C )。
接下來,作者評估MYC和lnc-17-92是否協(xié)同促進ACACA在MM細胞中的表達。在MM細胞中敲除lnc-17-92的確可以在不影響MYC表達的情況下消除MYC在ACACA啟動子上的占位( 圖4D ),并且僅在高MYC水平存在的條件MYC Tet - Off細胞系P493 - 6中降低ACACA的表達( 圖4E )。這些數(shù)據(jù)表明lnc-17-92TV1與轉(zhuǎn)錄因子MYC形成RNA -protein復(fù)合體,促進其在ACACA啟動子上的染色質(zhì)占用和轉(zhuǎn)錄活性。
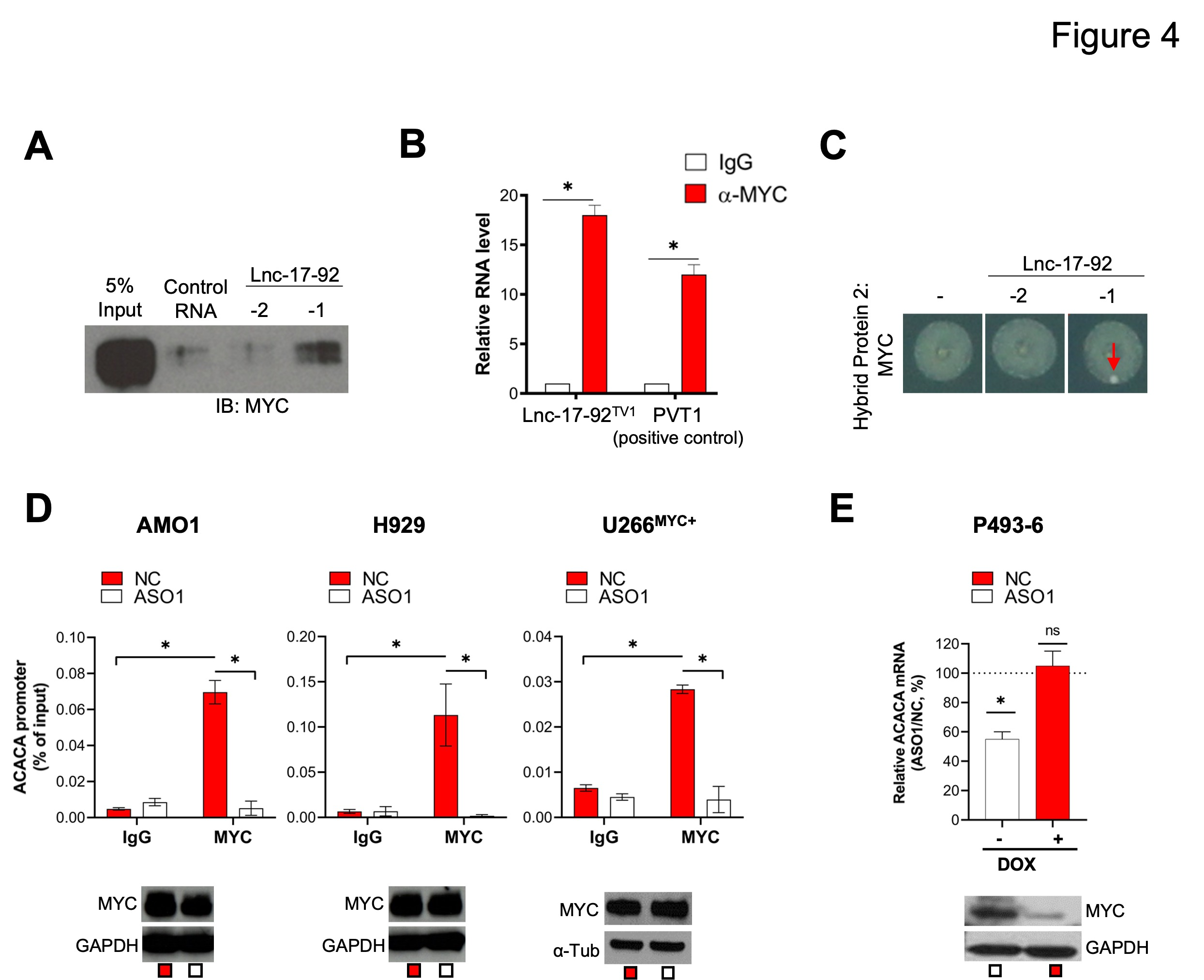
圖4 lnc-17-92直接與c-MYC相互作用,促進其在ACACA啟動子上的占用
5、Lnc-17-92介導(dǎo)MYC-WDR82轉(zhuǎn)錄復(fù)合體的組裝,導(dǎo)致ACACA的轉(zhuǎn)錄和表觀遺傳激活
為確定lnc-17-92是否影響這些蛋白質(zhì)-蛋白質(zhì)相互作用,作者在三個MM細胞系( AMO1、H929和U266MYC +)中整合了鄰近依賴性生物素識別( BioID )分析、免疫共沉淀實驗和質(zhì)譜分析( Co-IP/MS )的結(jié)果。這一分析突出了WDR82是一個非常高可信度的lnc-17-92依賴的MYC互作因子( 圖5A )。RPPD和RNA Y3H實驗進一步證實lnc - 17 - 92TV1和WDR82之間存在直接的RNA -protein相互作用( 圖5B-C )。
WDR82是SET1甲基轉(zhuǎn)移酶復(fù)合物的調(diào)節(jié)成分,它在活性位點的轉(zhuǎn)錄起始位點催化組蛋白H3 Lys-4 ( H3K4 )甲基化( mono-,di-,tri-),這是MYC與染色質(zhì)結(jié)合和反式激活的先決條件。在MM細胞中,敲低WDR82降低了ACACA啟動子上H3K4me3和MYC的占位(圖5D-E),降低了ACACA mRNA表達(圖5F)。這證實在MM細胞中沉默WDR82對H3K4甲基化的整體影響。此外,研究利用表達異位WDR82 - GFP融合蛋白的MM細胞證明了lnc-17-92表達對于WDR82在ACACA啟動子上的占位是必需的(圖5G)。此外,lnc-17-92缺失導(dǎo)致ACACA啟動子上H3K4me3水平降低(圖5H),但不影響H3K4甲基化狀態(tài)( 圖5I )。
這些發(fā)現(xiàn)表明lnc-17-92TV1是一個染色質(zhì)支架,介導(dǎo)MYC-WDR82多蛋白轉(zhuǎn)錄復(fù)合體的組裝,以控制ACACA和可能的其他基因的表達。
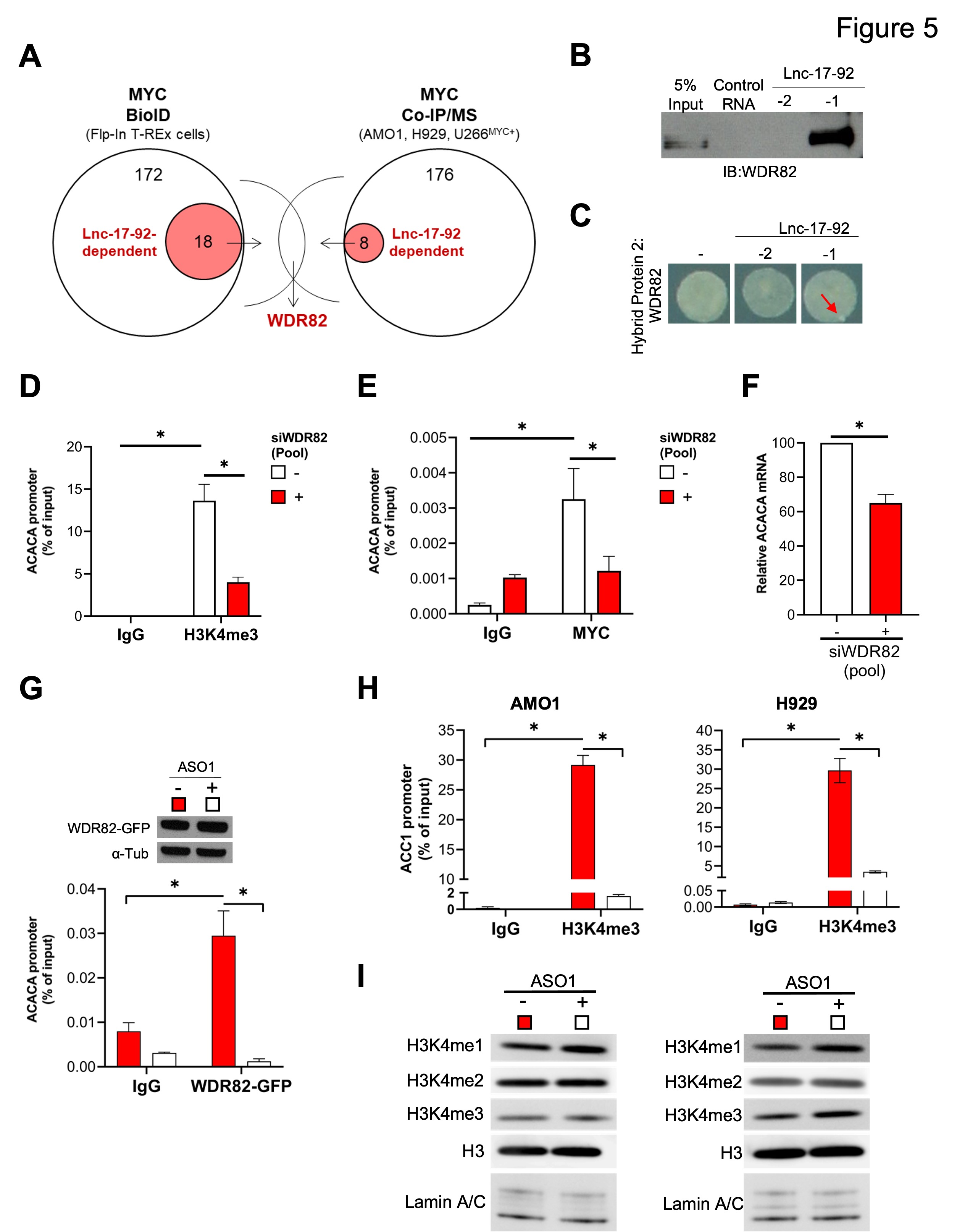
圖5 Lnc-17-92介導(dǎo)MYC-WDR82轉(zhuǎn)錄復(fù)合體的組裝,導(dǎo)致ACACA的轉(zhuǎn)錄和表觀遺傳激活
6、MIR17HG的治療抑制劑在人MM動物模型體內(nèi)外均具有抗腫瘤活性
為開發(fā)臨床應(yīng)用的抑制劑,作者篩選了八十多個fully phosphorothioated ( PS )、2 ' – O-methoxyethyl(2 '-MOE)修飾、lipid-conjugated的ASOs,它們既可以觸發(fā)RNase H介導(dǎo)的MIR17HG pre-RNA ( gapmeRs ) 降解,也可以通過RNase H-independent機制( blockmeRs )發(fā)揮作用。該方法鑒定了一種18-mer tocopherol (T)-conjugated gapmeR G2-15b-T ( ' G ' )和一種18 – mer tocopherol (T)-conjugated steric blockers SB9-19-T ( ' B ' ),它們在大量MM細胞系和CD138 +原代MM細胞中都具有強烈的抗增殖作用,同時保留了來自3個健康捐獻者的非惡性細胞系(THLE-2、HK-2、HS-5和293T)和PBMC(外周血單核細胞)。
為評估這兩個化合物的體內(nèi)抗腫瘤活性,作者首先使用免疫缺陷的NOD SCID小鼠建立了基于AMO1的漿細胞瘤異種移植模型。在這里,作者觀察到G2-15b-T(腫瘤生長抑制,TGI=76%)或B9-19-T(TGI=69%)治療周期后腫瘤生長顯著減少(圖6A)。對該治療后小鼠的腫瘤進行分析,證實了lnc-17-92的表達降低(圖6B),以及l(fā)nc-17-92的靶標(biāo)( ACACA、EPT1、EXT1、CCDC91、ANO6、FER和ZYG11A)的調(diào)節(jié)(圖6C)。
接下來在彌漫性骨髓瘤侵襲模型中證實了G2-15b-T和B9-19-T具有顯著的抗MM活性,其中MOLP8-luc + MM細胞的腫瘤生長通過生物發(fā)光成像( BLI )評估。在該模型中,用G2-15b-T ( TGI = 84 % )或B9-19-T ( TGI = 52 % )治療一個周期后,腫瘤生長明顯被拮抗。用G2-15b-T治療后,8只小鼠中有2只( 25 % )腫瘤被清除(圖6D)。重要的是,兩種抑制劑都顯著延長了動物的存活時間(圖6E)。
最后,作者通過尾靜脈注射從晚期患者( PDX-NSG )獲得的CD138 + MM細胞,建立了臨床相關(guān)的PDX-NSG小鼠模型。在這個模型中,使用人類kappa light chain作為替代物在血清樣本中監(jiān)測腫瘤生長。值得注意的是,作者觀察到G2-15b-T治療周期后腫瘤生長的消退,其效果與硼替佐米(陽性對照)相當(dāng)(圖6F)。

圖6 MIR17HG的治療抑制劑在人MM動物模型體內(nèi)外均具有抗腫瘤活性
結(jié)論
總的來說,這項研究建立了具有獨特的lncRNA功能的MIR17HG,它能促進蛋白質(zhì)-蛋白質(zhì)和蛋白質(zhì)-DNA相互作用,對促進腫瘤治療有積極意義。
參考文獻
Morelli E, Fulciniti M, Samur MK, Ribeiro C, Wert-Lamas L, Henninger JE, et al. A MIR17HG-derived Long Noncoding RNA Provides an Essential Chromatin Scaffold for Protein Interaction and Myeloma Growth. Blood. 2022 Sep 20:blood.2022016892. doi: 10.1182/blood.2022016892.






