不一樣的研究視角——乳酸受體HCAR1促進神經細胞增殖改善新生兒腦卒中
新生兒腦缺氧缺血(HI)是新生兒死亡和殘疾的主要原因,目前唯一的治療方法是低體溫療法。然而,仍需要新的藥物來保護大腦,并在受傷后促進其恢復。對小鼠的研究發現,乳酸可能有助于大腦恢復。乳酸還可以作為一種信號分子,與細胞表面HCAR1結合。然而,人們對HCAR1在大腦中扮演的角色以及它是否有助于大腦從缺氧缺血性損傷中恢復知之甚少。為此,Kennedy等比較了WT和HCAR1敲除的經歷HI腦損傷的新生小鼠。結果發現雖然HCAR1并不能保護小鼠免受HI的傷害,但它確實能幫助大腦恢復,即通過啟動與免疫系統和細胞周期有關的基因,導致新的腦細胞形成,以重新填充受傷的區域。相比之下,缺乏HCAR1的小鼠的腦組織幾乎不產生任何新細胞。本研究于2022年8月發表在《eLife》IF:8.713期刊上。
技術路線:

主要實驗結果:
1、HI后腦組織再生需要HCAR1
為了研究HCAR1在應激誘導的神經元損傷和隨后的神經發生中的作用,作者在9天齡的HCAR1 KO和WT小鼠中誘導HI。HI后,采用TTC染色檢查急性腦組織損傷,HCAR1 KO和WT小鼠在HI后24小時顯示同側半球全面損傷,兩組間的TTC百分比無顯著性差異(Figure 1A–B),表明HCAR1不能影響大腦的急性損傷。在HI急性期后,有一個神經發生和組織修復的階段。為了評估HCAR1在組織修復中的潛在作用,測量了HI后42天的組織損失。結果顯示,WT小鼠的腦組織丟失占到17%,而HCAR1 KO小鼠的腦組織丟失高達31%,極顯著高于WT小鼠,這表明HCAR1在HI后誘導神經發生和組織修復中具有重要作用。綜上,HCAR1不能保護大腦免受腦HI后的急性組織損傷,但能促進腦組織再生。
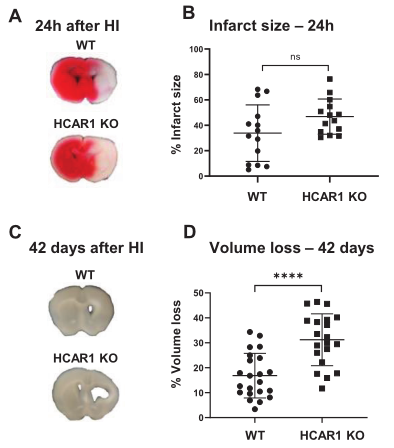
圖1 HCAR1不能保護大腦免受腦HI后的急性組織損傷,但能促進腦組織再生
缺血性損傷后的組織修復是通過增加神經祖細胞的增殖和分化來實現的。為了測試HCAR1對神經前體細胞增殖和細胞命運的影響,對來自HCAR1 KO和WT小鼠前腦的球進行了神經球實驗。結果發現來自HCAR1 KO小鼠的神經球與來自WT小鼠的神經球相比發展出更少的細胞集落(Figure 2A–B and G)。兩種基因型的球體平均大小差異不顯著(Figure 2A–B and H)。這說明HCAR1 KO神經前體細胞的自我更新能力較低,增殖能力較弱。為檢測HCAR1是否影響細胞命運,將神經球分離,在分化培養基中培養5天,用神經元標志物Tuj1和星形膠質細胞及神經前體細胞標志物GFAP進行免疫標記,結果顯示與WT組比較,HCAR1 KO組Tuj1+陽性神經元比例顯著下降(Figure 2C–D,I),而GFAP無差異(Figure 2E–F,I)。這表明HCAR1可能會引導神經前體細胞走向神經元的命運,但還需要更多的實驗來研究其對細胞分化的影響。
由于神經球數據提示神經前體細胞增殖受損,所以隨后檢測了HCAR1 KO和WT小鼠HI后的體內細胞增殖。小鼠于HI后4-7天注射增殖標記物BrdU,第7天處死。本文集中分析紋狀體室下生態位,因為這是一個包含大量缺氧缺血后細胞增殖的神經前體細胞的區域,但由于室管膜下層區域(SVZ)的HI反應存在區域差異,所以作者分析了兩個獨立的室下生態位區域,即心室毗鄰室下區(V-SVZ)和更側位腦室的下-中間區(SVZ-IZ)(Figure 2J)。在SVZ-IZ中,受HI影響的同側半球的總體細胞密度比WT小鼠的對側半球增加了47%,而在KO小鼠中(Figure 2K–L and O),細胞總體密度沒有影響(Figure 2M–O),并且相比于KO組,HI后WT組的總體細胞密度顯著更高(Figure 2O)。此外,WT小鼠的HI受損同側細胞增殖的BrdU +細胞比例增加了一倍,而KO小鼠無顯著改變,HI后WT組的BrdU +細胞也顯著高于KO小鼠(Figure 2P)。總之,這些數據表明HCAR1 KO小鼠在HI后不能完全激發細胞增殖。然后觀察HI誘導的雙皮質素陽性(DCX+)神經元前體細胞的增殖。HI后,在同側SVZ-IZ中兩種基因型小鼠的DCX+ / DAPI +細胞比例都增加了一倍以上,表明HCAR1 KO小鼠中有完整的反應性神經發生(Figure 2K–N and Q),然而DCX +BrdU +的神經前體細胞比例的增加只在WY小鼠中觀察到,KO小鼠則沒有顯著差異(Figure 2K–N and R)。綜上所述,這些數據表明HCAR1 KO小鼠在HI后不能增加神經前體細胞的增殖,提示HCAR1需要刺激神經細胞增殖來誘導缺血損傷后的組織修復。
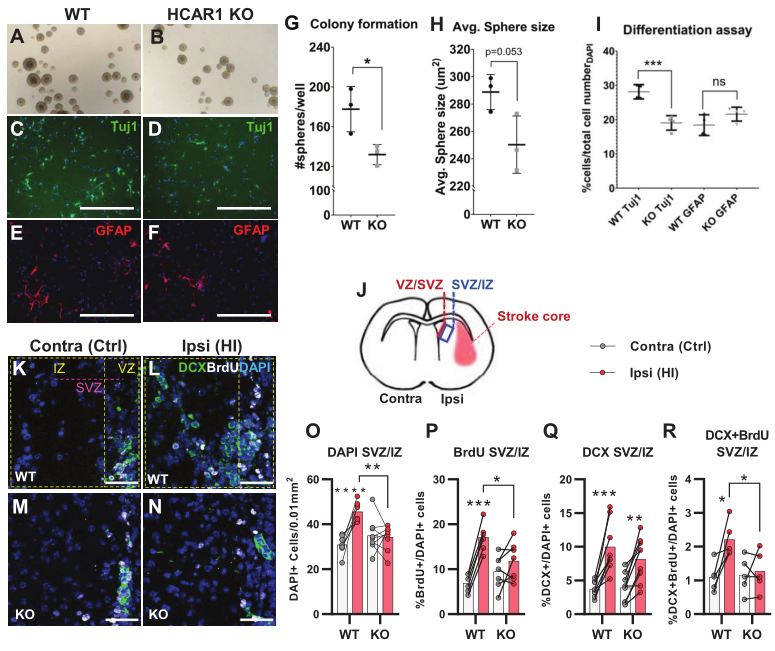
3、HCAR1 KO小鼠的小膠質細胞增殖和激活受損
在大腦HI之后,小膠質細胞被招募到受傷的部位,在那里它們清除死細胞的碎片,以促進修復過程,這過程需要增加小膠質細胞的增殖、活化和遷移。與前述只有WT小鼠在HI后總細胞密度增加的腦室下生態位相反,兩種基因型小鼠梗死周圍區域的細胞密度都有增加(Figure 3A–E)。WT組HI同側小膠質細胞比例增加,HCAR1 KO組小膠質細胞比例增加不明顯(Figure 3F)。如預期的,與對側相比,WT小鼠HI同側半球增殖的小膠質細胞比例明顯增加,然而,在HCAR1 KO小鼠中未檢測到增加(Figure 3G)。以上HCAR1 KO導致表明小膠質細胞增殖受損。
然后評估了小膠質細胞的激活情況。激活的小神經膠質細胞有更大的細胞體和更少的分支,即它們有更短和更少的分支。在WT小鼠中,HI同側半球的小膠質細胞比對側的小膠質細胞體積更大,分支更少,這表明其表型被激活(Figure 3A–B,H-I),而在KO組則無顯著差異,表明HCAR1 KO導致小膠質細胞激活缺陷。
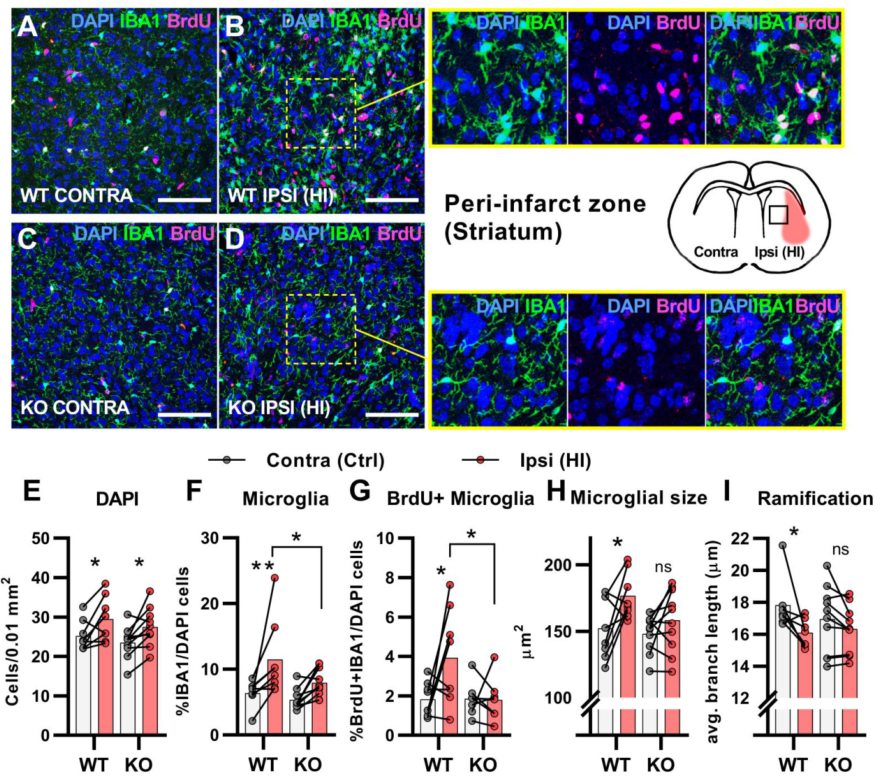
圖3 HCAR1 KO小鼠HI后小膠質細胞活化和增殖缺陷
鑒于以上數據表明HCAR1對于HI后的神經元和小膠質細胞增殖非常重要,所以作者進一步探究了HCAR1是否也參與了其余腦細胞如星形膠質細胞和少突膠質細胞的增殖。用GFAP和增殖標記物BrdU進行免疫標記,顯示WT小鼠HI同側半球的GFAP+細胞和增殖的GFAP+雖然GFAP可以標記非反應性星形膠質細胞和反應性星形膠質細胞,但需要注意的是,并非所有非反應性星形膠質細胞都是GFAP陽性,而反應性星形膠質細胞的特征是GFAP水平高細胞的比例的顯著增加,但在HCAR1 KO小鼠中沒有增加(Figure 4A–F)。雖然GFAP可以標記非反應性和反應性星形膠質細胞,但需注意的是,并非所有非反應性星形膠質細胞都是GFAP陽性,而反應性星形膠質細胞的特征是GFAP水平高。因此,GFAP +細胞的增加主要代表反應性星形膠質細胞增生,這發生在梗死周圍區域。
隨后用Olig2標記少突膠質細胞,該標記可以標記所有發育階段的少突膠質細胞。HCAR1 KO和WT小鼠HI后梗死灶周圍少突膠質細胞或增殖少突膠質細胞的比例均無明顯變化(Figure 4G–L)。但WT小鼠梗死區域Olig2+BrdU+標記的增殖性少突膠質細胞的密度顯著增加,而KO小鼠則無變化(Figure 5C-D),暗示HCAR1可能參與少突膠質細胞的增殖。
最后,通過使用APC標記成熟和前少突膠質細胞(不是少突膠質細胞前體),發現HCAR1 KO和WT小鼠的中HI后同側半球的細胞比例都顯著降低了(Figure 4M–Q),APC細胞密度也都顯著下降(Figure 5E)。
以上結果表明HCAR1影響梗死區周圍的反應性星形膠質細胞和少突膠質細胞的增殖。
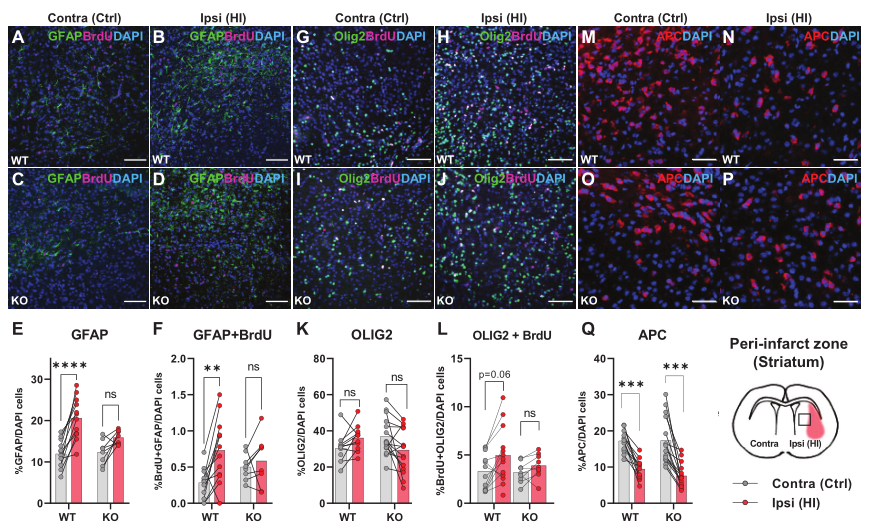
圖4 HI后星形膠質細胞和少突膠質細胞增殖
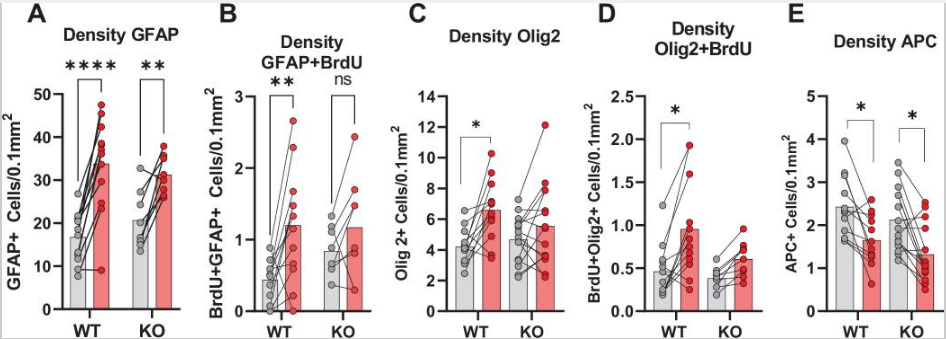
圖5 梗死周圍GFAP、Olig2和APC的密度測定
5、HCAR1 KO小鼠SVZ對HI的轉錄反應較弱
為研究HCAR1參與腦組織再生的機制,通過RNA測序對大腦HI后小鼠受影響的同側和對側(對照)半球的SVZ區域進行了全轉錄組分析。PCA顯示來自WT小鼠同側半球的組織樣本遠離對側半球的樣本,表明對HI有很強的轉錄反應(Figure 5A)。來自HCAR1 KO小鼠對側半球的樣本與WT對側樣本具有相似的基因表達模式。值得注意的是,HI同側HCAR1 KO樣本也與WT和KO對側樣本聚在一起。表明HCAR1 KO腦室對HI的轉錄反應似乎嚴重受損。
然后,對SVZ樣本進行GSEA分析,以識別該區域兩種基因型之間的差異調控通路。多個通路在HCAR1 KO和WT的HI同側SVZ樣本中有差異表達(Figure 5B)。有趣的是,HCAR1 KO的細胞周期通路強烈下調。四個不同實驗組中差異調控細胞周期基因的相對表達情況如Figure 5C所示。與野生型相比,HCAR1 KO細胞周期基因的下調可能是HI后HCAR1 KO細胞增殖不足的原因。為在蛋白水平上驗證轉錄組結果,選擇兩個表達差異的Cyclin D2和B1進行Western blot驗證。結果顯示,HCAR1 KO中Cyclin D2蛋白水平僅為WT的67%,B1水平無統計學差異(Figure 5F-H)。因此,HI后HCAR1 KO細胞周期基因轉錄的降低在一定程度上可以在蛋白水平上得到證實。
與WY小鼠比較,HCAR1 KO同側半球補體和凝血級聯(complement and coagulation cascade)通路下調(Figure 5B and D)。有趣的是,補體系統參與了小膠質細胞的激活,所以HCAR1 KO中小膠質細胞的反應減弱可能是上述小膠質細胞激活下降的原因。與WT組比較,HI后HCAR1 KO中大量的小膠質細胞激活標記物也顯著下調(Figure 5E),這再次支持了該猜想。
總之,HCAR1 KO小鼠的SVZ區域對HI表現出強烈的轉錄反應受損。這可以解釋HI后細胞增殖和小膠質細胞活化受損,提示HCAR1是缺血后組織修復的關鍵轉錄調控因子。
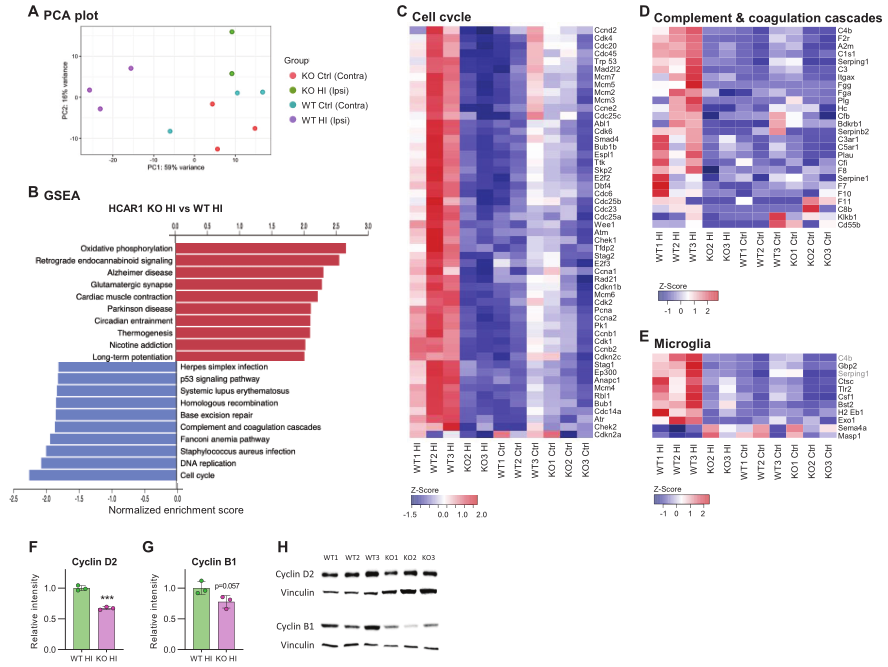
圖5 HCAR1調控缺血的轉錄反應,包括細胞周期和補體通路
參考文獻:
Kennedy Lauritz., Glesaaen Emilie R., Palibrk Vuk., Pannone Marco., Wang Wei., Al-Jabri Ali., Suganthan Rajikala., Meyer Niklas., Austb? Marie Landa., Lin Xiaolin., Bergersen Linda H., Bj?r?s Magnar., Rinholm Johanne E.(2022). Lactate receptor HCAR1 regulates neurogenesis and microglia activation after neonatal hypoxia-ischemia. Elife, 11(undefined), undefined. doi:10.7554/eLife.76451






