教你用7張圖發8分一區文章 RNA結合蛋白PCBP1通過穩定DKK1 mRNA和隨后下調β-catenin抑制肺腺癌的進展
近日,有研究通過發現polyc -RNA結合蛋白1 (PCBP1)作為腫瘤抑制因子和RNA調節因子,在人類癌癥中下調,從PCBP1出發揭示其在肺腺癌(LUAD)中的生物學功能。該研究發表在Journal of Translational Medicine》,IF:8.440。
技術路線:

主要研究結果:
1. PCBP1低表達預示腫瘤患者預后不良
PCBP1多在不同水平上參與基因表達調控,其中一些成員在腫瘤發生中起著重要作用。hnRNP家族在腫瘤組織中顯著下調,而PCBP1在早期死亡組和長期生存組中表達差異最顯著(圖1A)。K-M生存曲線顯示,在TCGA和GSE19188隊列中,PCBP1低表達組的總生存期均明顯較差(圖1B)。此外,PCBP1在遠處轉移患者對應的IV期腫瘤組織中表達顯著降低(圖1C, D)。這些結果提示PCBP1在肺腫瘤發生中起重要作用。
接下來,分析PCBP1在LUAD中的表達及其對診斷的預測價值。免疫組化顯示PCBP1在肺腫瘤組織中表達下降(圖1E, F)。PCBP1與腫瘤侵襲、淋巴結轉移和臨床分期顯著相關(圖1F)。作者比較了肺腺癌正常組織和腫瘤組織,發現PCBP1 mRNA水平在腫瘤中較低(圖1G)。此外,PCBP1與三個病理參數在mRNA水平上有更顯著的相關性(圖1G)。PCBP1在蛋白和mRNA水平的低表達與LUAD患者的低生存率密切相關(圖1H, I)。綜上所述,這些數據表明PCBP1是LUAD患者潛在的預后生物標志物。
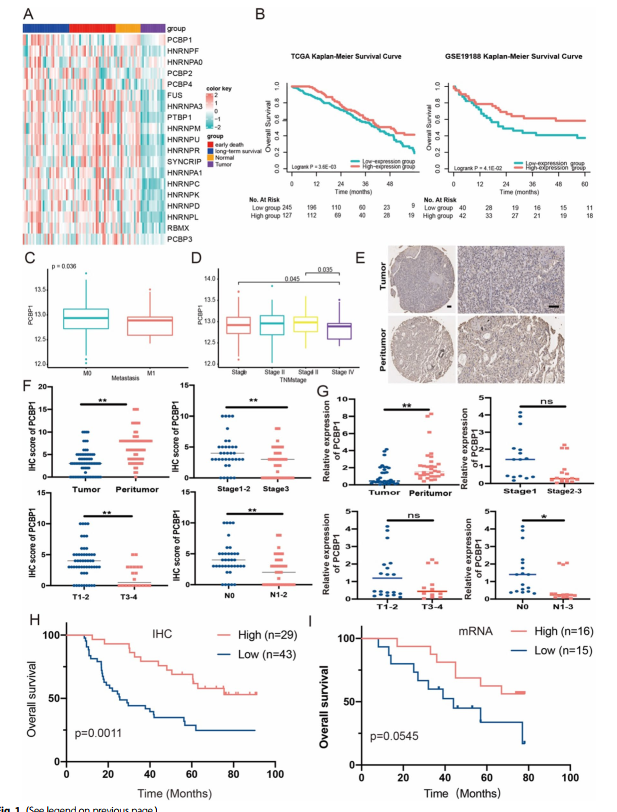
圖1 PCBP1的預后和潛在生物學價值的鑒定
2. PCBP1在體外可抑制LUAD細胞的增殖和遷移
接下來,探討PCBP1在LUAD進展中的作用。采用集落形成和CCK-8實驗評估PCBP1對細胞增殖的影響:PCBP1敲低顯著增加了A549和H358細胞的集落形成(圖2A, B)和細胞增殖。Sh-PCBP1細胞的細胞增殖率增加(圖2D,E),PCBP1過表達抑制細胞增殖(圖2F)。創面愈合實驗表明,與對照組細胞相比,sh-PCBP1細胞具有更高的細胞遷移能力(圖2G、H),而這些指標在過表達PCBP1的細胞中降低(圖2I)。綜上, PCBP1可以抑制肺腺癌的發展。

圖2 PCBP1對LUAD體外生物學行為的影響
3. PCBP1與肺腺癌患者的腫瘤轉移相關
為了了解PCBP1影響LUAD存活的分子基礎,在PCBP1缺失后對A549細胞進行了RNA測序。與對照組相比,sh-PCBP1中有643個下調基因和490個上調基因(圖3A)。為了進一步研究已鑒定的DEGs的特征,采用基因腫瘤學和KEGG通路富集方法對交叉的差異基因進行分析。差異基因主要在與腫瘤轉移相關的生物過程中富集:細胞粘附分子結合、上皮細胞遷移(圖3B)和Wnt信號通路(圖3D)。這些通路都與腫瘤轉移有關。上皮-間充質轉化(Epithelial-mesenchymal transition, EMT)是腫瘤轉移的重要生物學過程。EMT相關基因取自“hallmark_epithelial - epithelial - MESENCHYMAL_TRANSITION”基因列表,使用熱圖顯示(圖3C)。對差異基因的富集分析顯示,富集通路主要存在于轉移相關信號通路中,而在KEGG通路分析中,Wnt通路調控腫瘤轉移。RNA-Seq分析顯示,在Wnt信號通路中,與對照組相比,PCBP1敲除細胞中有6個基因上調,10個基因下調(圖3E)。根據PCBP1的表達情況,將TCGA-LUAD患者分為高表達組和低表達組。在GSEA結果中,PCBP1低表達組也富集了“上皮-間充質轉化”通路(圖3F)。因此選擇了22個基于fold-change和功能的差異基因對PCBP1敲低和過表達細胞進行qRT-PCR以驗證RNA測序結果(圖3G)。這些發現揭示了PCBP1與LUAD患者轉移之間的聯系。
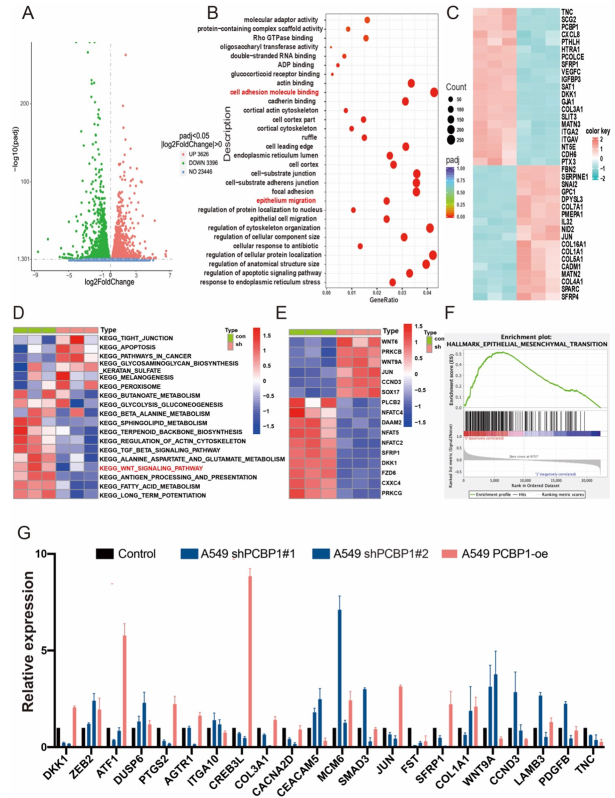
圖3 PCBP1在轉移中的表達
4. PCBP1通過直接結合DKK1 mRNA抑制LUAD進程,延長其mRNA穩定性
DKK1屬于與肺癌轉移相關的Wnt信號通路。基于以上結果, DKK1可能是影響PCBP1改變時腫瘤轉移的關鍵因素(圖4A)。結果表明,在A549和H358細胞中PCBP1敲低可降低DKK1蛋白水平,而在A549細胞中過表達PCBP1可提高DKK1 mRNA水平(圖4B)。在蛋白質水平上也觀察到了同樣的結論(圖4C)。PCBP1已被確定為調節許多癌癥相關基因的選擇性剪接、翻譯和RNA穩定性。為了確定PCBP1和DKK1之間的相互作用,進行了RIP分析。RIP分析顯示,在A549細胞中,DKK1結合PCBP1(圖4D)。此外,利用A549細胞裂解液進行RNA-pull down,然后進行western blot分析和銀染(圖4E),驗證了細胞中DKK1與PCBP1的結合。此外,又評估了DKK1 mRNA對放線菌素D治療的響應穩定性。PCBP1過表達導致DKK1 mRNA半衰期延長(圖4F)。這些結果表明,PCBP1通過穩定DKK1 mRNA密切調控DKK1的表達。

圖4 PCBP1介導DKK1 mRNA的穩定性
5. PCBP1通過靶向DKK1抑制Wnt/β - catenin通路
DKK1是β - catenin依賴的Wnt信號通路的抑制劑。DKK1調控失調現已成為多種人類癌癥的重要因素。Western blot結果顯示,PCBP1敲除細胞中β-catenin表達上調,PCBP1過表達細胞中β-catenin表達下調。然而,phospho-β-catenin的表達則相反(圖5A)。此外,western blot檢測EMT相關標志物水平,表明PCBP1降低了Vimentin水平,而升高了claudin-1水平(圖5A)。Transwell實驗顯示,與對照細胞相比,sh-PCBP1細胞具有更高的細胞遷移能力(圖5B)。接下來,研究PCBP1是否通過調控DKK1在LUAD中抑制細胞遷移和遷移。RT-qPCR結果顯示,si-DKK1#1和si-DKK1#2敲除效率較好(圖5C)。PCBP1-OE轉染A549細胞后,,phospho-β-catenin和claudin-1水平升高,β-catenin和vimentin水平降低,但si-DKK1逆轉了這些結果(圖5D)。此外,過表達PCBP1的A549細胞的細胞遷移能力明顯下降,通過下調DKK1可以消除這種能力(圖5E)。綜上所述,這些數據表明DKK1是PCBP1的重要下游靶點。

圖5 PCBP1/DKK1/β-catenin在LUAD細胞中調節遷移和EMT
6. PCBP1在體內可抑制LUAD的腫瘤生長和轉移
采用小鼠尾靜脈注射PCBP1敲除細胞的方法,探討PCBP1在肺轉移中的作用。PCBP1基因敲除顯著降低了H358小鼠模型的體重,并加重了A549(圖6A-C)和H358(圖6D-F)小鼠模型的肺轉移負擔。在皮下異種移植模型中,PCBP1基因敲除組的腫瘤體積似乎比對照組大(圖6G,H)。而PCBP1過表達組的腫瘤生長被顯著抑制,腫瘤體積更小,重量更輕(圖6I)。此外,IHC分析顯示,轉染sh-PCBP1后腫瘤組織中ki67陽性細胞明顯增加。此外,測量BALB/c nu小鼠切除腫瘤的重量,發現PCBP1抑制了腫瘤的生長和重量(圖6J)。總之,這些數據表明PCBP1介導肺轉移和LUAD腫瘤生長。

圖6 PCBP1在LUAD體內抑制腫瘤生長和轉移
7. 在LUAD患者中PCBP1與DKK1呈正相關
為了檢驗這些發現的臨床相關性,使用免疫組化染色檢測了72名具有配對相鄰正常組織的LUAD患者的臨床注釋隊列中PCBP1、DKK1和β-catenin的表達。數據顯示,與配對正常肺組織相比,腫瘤組織中DKK1蛋白表達下降,β-catenin蛋白表達增強(圖7A, B)。在LUAD患者中,DKK1高表達與生存率的提高密切相關,而β-catenin高表達則預示預后不良(圖7C)。同時,IHC染色檢測到DKK1和β-catenin的表達與腫瘤的大小,N分期和腫瘤分期有關(圖7D)。PCBP1得分較高的組織DKK1表達增加,β-catenin降低。相反,PCBP1得分較低的組織表現出較低水平的DKK1表達和較高水平的β-catenin(圖7E)。這些結果表明,在LUAD中PCBP1和DKK1呈正相關(圖7F)。PCBP1和DKK1均與β-catenin呈負相關(圖7F)。同樣的結果在TCGA和GSE19188數據庫中得到驗證(圖7G)。這些結果表明PCBP1與DKK1呈正相關,而PCBP1和DKK1與β-catenin呈負相關,而β-catenin是LUAD OS的獨立預后標志物。
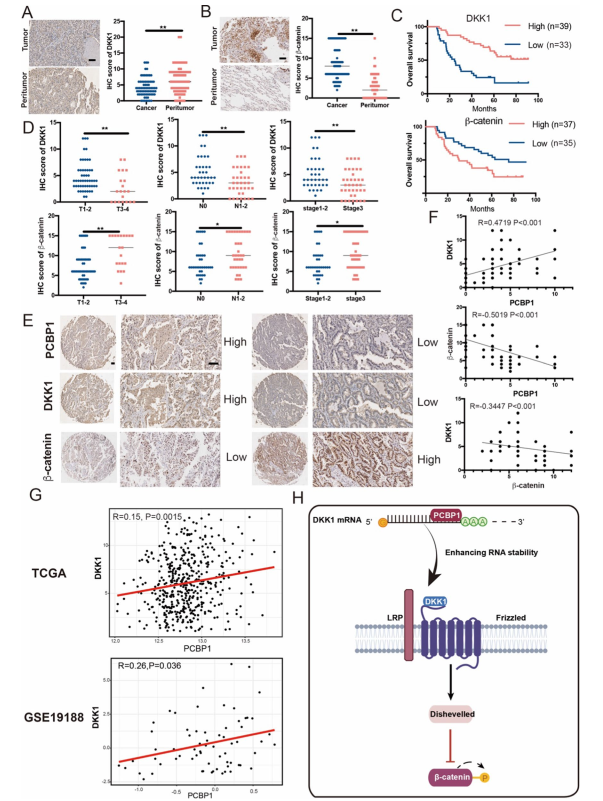
圖7 高水平的PCBP1和DKK1在LUAD中表達預示著良好的臨床結局
結論:
該數據揭示了PCBP1-DKK1-β-catenin在LUAD中的一種新的調控機制,并表明PCBP1可能作為一種與良好預后因素相關的新標志物,強調了PCBP1作為一個有前途的治療靶點的潛力。






