線粒體融合/裂變干預——特異性心臟病藥物作者發現琥珀酸脫氫酶組裝因子4(SDHAF4)在心肌和人類患者的病變心臟中在病理應激反應中下調,并證實心臟SDHAF4介導
琥珀酸脫氫酶被稱為線粒體復合體II,因其在線粒體功能中的獨特作用而吸引了人們對其參與人類疾病研究的興趣。在此,作者發現琥珀酸脫氫酶組裝因子4(SDHAF4)在心肌和人類患者的病變心臟中在病理應激反應中下調,并證實心臟SDHAF4介導的線粒體復合體II組裝中斷能促進擴張型心肌病進展。本研究于2022年6月發表雜《NATURE COMMUNICATIONS》IF:17.694。
技術路線:

主要實驗結果:
1、人中SDHAF4異常表達以響應心臟損傷和心臟病變
心臟是線粒體含量較高的器官之一,心肌的功能主要依賴于線粒體的穩態。作者猜想SDHAFs可能參與了調控心臟功能。檢測了心肌梗死(MI)小鼠模型心臟組織中的4個SDH組裝因子的表達,結果發現只有SDHAF4的mRNA和蛋白表達(Fig. 1a-1d)在MI建模后顯著下調。免疫熒光揭示SDHAF4與線粒體的初步共定位(Fig. 1e)。在酵母中SDHAF4可以促進SDHA與SDHB的組裝。值得注意的是,MI手術后SDHA和SDHB之間的相互作用降低,提示SDHAF4在MI小鼠中起一定的下調作用(Fig. 1f, g)。在GSE135055數據中,SDHAF4在心臟中的表達下降與人類心臟疾病密切相關,包括DCM(擴張型心肌病)和MCD(微血管冠脈疾病)。綜上所述,這些結果表明SDHAF4表達對心臟損傷非常敏感。作者推測SDHAF4可能是參與調節心臟穩態的復合物II的獨特因子。

通過構建 Sdhaf4 的 floxed 等位基因(Sdhaf4fl)并隨后生成 Ckmm-Cre 轉基因介導心臟和骨骼肌中 Sdhaf4 失活的小鼠,以檢測SDHAF4 在心臟中的作用。該突變小鼠命名為Sdhaf4 fl/fl,Ckmm-Cre或Sdhaf4 Ckmm。Sdhaf4 Ckmm小鼠的存活力顯著降低,沒有一只突變鼠存活超過12周(Fig. 2a)。Sdhaf4 Ckmm小鼠的心臟明顯增大,提示突變鼠心臟缺陷。心電圖結果顯示和對照組比較,Sdhaf4 Ckmm小鼠的FS%和EF%都顯著下降(Fig. 2c–f),表明Sdhaf4丟失損害心臟功能。
隨后將Sdhaf4-floxed 等位基因小鼠和三苯氧胺誘導的Myh6-Cre轉基因小鼠(Mer-CreMer)雜交以進一步驗證SDHAF4缺失對心臟表型的影響。三苯氧胺處理完善了Cre重組酶介導的小鼠心肌組織中SDHAF4的特異性缺失(Fig. 2g)。三苯氧胺誘導8周后,純合小鼠(Sdhaf4 fl/fl,Mer-CreMer,Sdhaf4 Mer-CreMer)的存活力顯著下降,且心臟顯著增大(Fig. 2h, i)。綜上,這些結果表明SDHAF4缺失導致心臟和致命性異常,這表明Sdhaf4是心臟的一個必需基因。

3、心臟敲除SDHAF4后誘發擴張型心肌病
接下來作者分析了心臟在不同階段的總體形態學以監測Sdhaf4 Ckmm小鼠的病理過程。在出生后的前6周,Sdhaf4 Ckmm小鼠的體重和它們同窩出生的WT小鼠的體重相似(Fig. 3a),但是心臟重量在3周的時候逐漸增加(Fig. 3b)。HE染色觀察到最后階段的心室組織發生擴張,表明Sdhaf4缺失導致心臟重塑和DCM進展(Fig. 3c)。Masson染色顯示在最初4周內,Sdhaf4 Ckmm小鼠的心臟纖維化無明顯改變,但是在后后7周出現明顯的膠原沉積(Fig. 3d)。一致的,心肌病標記基因(胎兒基因)的表達在Sdhaf4 Ckmm小鼠4周齡時開始上調(Fig. 3e)。心肌病標記基因表達上調在三苯氧胺誘導的Sdhaf4 Mer-CreMer小鼠中也觀察到了(Fig. 3f)。這些結果表明,心臟中Sdhaf4的缺失引發了心臟發病機制。

4、阻斷復合體Ⅱ的組裝導致線粒體功能異常
SDHAF4被證明與催化SDHA亞基特異性相互作用,并促進其與SDHB的結合,進而組裝SDH復合物。所以作者檢測了SDH復合物在小鼠心臟中不同時期的表達水平。SDHAF4的表達和其它SDH復合物亞基的表達在產后發育中逐漸增加(Fig. 4a)。在出生后3周齡時SDHAF4缺失導致SDH亞基的蛋白表達顯著下降,但復合物I、III、IV和V組分的豐度在這個年齡的突變心臟中沒有改變(Fig. 4b, c)。盡管Sdhaf4 Ckmm小鼠心臟中SDH亞基的蛋白表達下降,但是它們的mRNA水平并未改變(Fig. 4d),所以作者推測,復合體II的異常很可能發生在翻譯后水平,主要是由于裝配缺陷。
接下來作者分析了SDHAF4缺失對復合物組裝的影響。使用心肌組織的免疫沉淀顯示Sdhaf4缺失減少了SDHA和SDHB之間的相互作用(Fig. 4e, f),這個可能導致SDH亞基降解,泛素化修飾水平增加證實了這一猜想(Fig. 4g)。此外,線粒體超復合物的形成被抑制,并在突變心臟中觀察到線粒體耗氧量的顯著下降(Fig. 4h–j)。有趣的是,出生3周后,相對ATP水平保持不變,但在8周齡的Sdhaf4 Ckmm小鼠心臟中下降(Fig. 4k)。這些結果說明SDHAF4缺失阻斷復合體Ⅱ的組裝并導致線粒體呼吸異常。
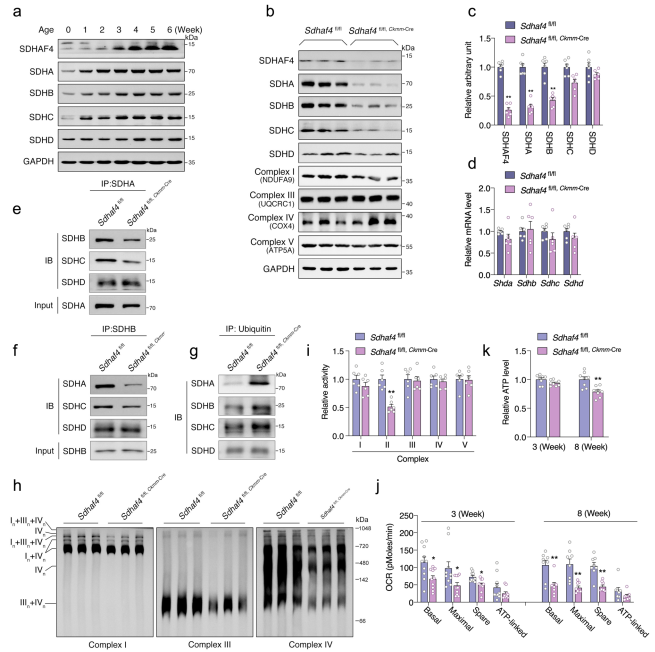
圖4敲除SDHAF4后阻斷復合體Ⅱ的組裝并促進線粒體功能異常
鑒于復合體II是耦合線粒體電子傳遞鏈和TCA循環的關鍵因素,所以作者接下來探究SDHAF4缺失是否會導致TCA循環相關關鍵酶和代謝物的豐度。突變體早期(出生后3周)心臟中TCA循環相關關鍵酶的蛋白質水平與對照組沒有區別,而在8周后,心臟中這些酶的水平整體下降(Fig. 5a, b)。此外,TCA循環相關代謝物水平在突變體小鼠中顯著下降,包括丙酮酸,檸檬酸,異檸檬酸,蘋果酸,富馬酸,只有琥珀酸的豐度增加了(Fig. 5c)。這些變化是SDH活性喪失所導致的主要影響,而SDH活性是催化琥珀酸氧化為富馬酸鹽所必需的,這是TCA循環的關鍵步驟。進一步的代謝組學分析顯示,SDHAF4缺失影響多個氨基酸代謝通路,其中精氨酸(Arg)生物合成通路改變最顯著(Fig. 5d, e)。TCA循環和精氨酸生物合成之間的關聯近來已有報道。精氨酸通過瓜氨酸-一氧化氮途徑再生,瓜氨酸和天門冬氨酸(Asp)通過精氨酸琥珀酸合成酶(ASS)和精氨酸琥珀酸裂解酶(ASL)轉化為精氨酸,富馬酸作為副產物,而富馬酸酶作用于富馬酸的產物蘋果酸轉化為草酰乙酸生成天門冬氨酸,加入精氨酸的生物合成循環(Fig. 5f)。因此,SDHAF4的缺失不僅主要改變了TCA循環相關代謝物的水平,還抑制了精氨酸的再生,進一步加劇了代謝應激。

圖5敲除SDHAF4后加速TCA循環相關代謝能力
5、阻斷復合體II的組裝改變心臟線粒體融合/裂變動力學
盡管3周齡Sdhaf4 Ckmm小鼠心臟的線粒體功能受損,但是細胞器的形態并未發生改變(Fig. 6a)。在TEM電鏡中,Sdhaf4 Ckmm小鼠和對照組線粒體數目及其亞細胞分布無差異(Fig. 6b–e)。然而,隨著病理性進展加劇,8周齡Sdhaf4 Ckmm小鼠心臟線粒體表現出明顯的形態異常,包括肌原纖維/肌節組織異常,線粒體內部結構異常,如嵴畸形,電子密集的包裹體和低密度的隔室(Fig. 6f, g);此外,線粒體總數顯著增加但線粒體大小顯著減小(Fig. 6h–j)。
接下來探究Sdhaf4 Ckmm小鼠心臟中線粒體數量增加但大小減小是否是由于線粒體生物發生和融合過程改變導致的。然而,qPCR分析顯示Sdhaf4 Ckmm小鼠心肌中mtDNA的相對豐度降低,而不是增加(Fig. 6k)。PGC-1α和其它線粒體生物發生調節基因的表達在Sdhaf4 Ckmm小鼠中也都下調表達(Fig. 6l, m)。因此,這些細胞器數量的增加不太可能是由于線粒體生物發生的改變造成的。所以接下來作者測定了調節線粒體融合和裂變的多種因子的蛋白質水平,但未檢測到對照組和突變心臟之間的顯著差異。但是,Drp1的轉錄后修飾在Sdhaf4 Ckmm小鼠中顯著改變,該基因是線粒體融合的關鍵基因。Drp1的激活高度依賴于兩個絲氨酸位點:絲氨酸616位點磷酸化(p-Drp1 s616)增強線粒體融合,絲氨酸637位點磷酸化(p-Drp1 s637)抑制線粒體融合活性。作者發現在3周大的Sdhaf4 Ckmm小鼠中p-Drp1 s616增加而p-Drp1 s637下降(Fig. 6n)。Drp1的激活在8周大的Sdhaf4 Ckmm小鼠中也觀察到了(Fig. 6n, p),提示在SDHAF4缺失的情況下,Drp1在早期且持續激活。綜上所述,這些結果表明SDHAF4缺乏可能會增強線粒體裂變,導致細胞器碎裂,因而可能是線粒體數量增加的原因。
線粒體自噬通常與線粒體融合/裂變動力學耦合,以使受損細胞器回收和清除。有趣的是,自噬激活的標志LC3-II的水平在8周齡的Sdhaf4 Ckmm小鼠心臟中顯著增加(Fig. 6o, p)。使用熒光報告基因(mt-Keima)方法評估H9C2大鼠心肌細胞線粒體自噬水平,證實了SDHAF4缺失導致線粒體自噬小體形成增加(Fig. 6q)。這些表明SDHAF4缺失導致了心肌細胞的線粒體自噬。

圖6阻斷復合體Ⅱ的組裝促進心臟線粒體自噬
6、線粒體靶向干預延長DCM小鼠的壽命
基于前面的觀察,作者猜想代謝能力受損和線粒體自噬加速可能是DCM的Sdhaf4Ckmm小鼠中的兩個主要線粒體事件,因此,靶向代謝或藥物干預可能會有所療效。為驗證該猜想,作者使用口服水富馬酸鈉或腹腔注射特異性Drp1抑制劑Mdivi-1處理小鼠。線粒體和肌纖維完整性通過補充富馬酸鹽或Mdivi-1得到改善(Fig. 7a)。線粒體數量和平均大小也基本恢復(Fig. 7b, c)。心臟肥厚和纖維相關基因,Anp的mRNA表達在兩個干預組中都顯著下降,Bnp和Myh7的上調也被Mdivi-1處理抑制(Fig. 7d)。心電圖顯示Mdivi-1處理顯著改善Sdhaf4Ckmm小鼠的心臟功能,表現為EF%和FS%上升(Fig. 7e–j)。重要的是,補充富馬酸鹽或Mdivi-1處理都顯著延長了小鼠的存活時間(Fig. 7k)。表明以TCA代謝或線粒體動力學為靶點的方法是治療心功能不全的有效方法。

圖7抑制Drp1或補充富馬酸可延長擴張型心肌病小鼠的壽命
由于富馬酸是SDH催化的直接產物,因此富馬酸丟失可能是Sdhaf4 Ckmm小鼠心臟的關鍵特征。值得注意的是富馬酸的下調和琥珀酸的上調都在MI小鼠中報道過,表明富馬酸鹽相關代謝異常可能是心臟發病的關鍵過程之一。為了驗證該猜想,對MI小鼠術前術后補充富馬酸,結果顯示,與MI小鼠比較,富馬酸補充的MI小鼠的心臟重量/體重比顯著下降,EF%和FS%顯著增加,心臟肥厚和纖維相關基因也顯著回復(圖8)。這些結果說明直接補充富馬酸可改善MI小鼠的心臟功能。綜上所述,這些觀察結果提示MI患者SDHAF4相關富馬酸缺失在心功能障礙的進展中起著至關重要的作用。
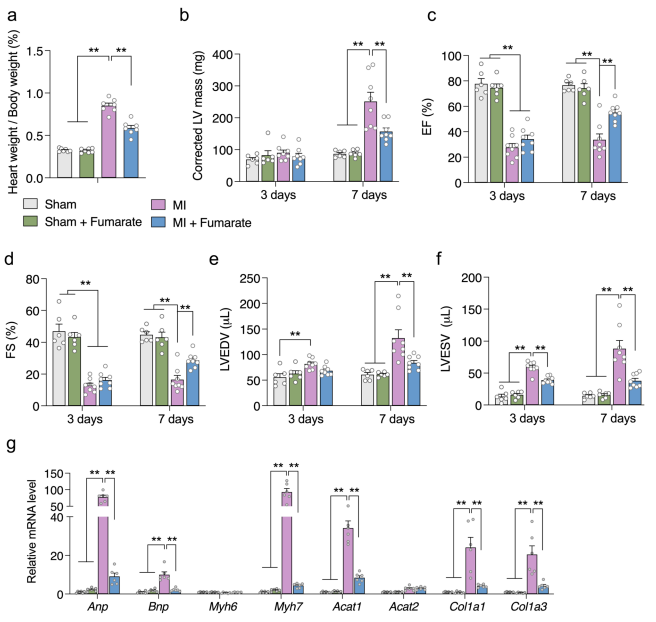
圖8 補充富馬酸可以改善MI小鼠的心功能
綜上所述,本文研究了SDHAF4在小鼠體內的病理參與,以確定其在維持心功能中的重要作用。SDHAF4是新近發現的復雜II組裝因子,其表達對應激敏感。SDHAF4的缺失破壞了復合物II的組裝,促進了SDH單位的降解,從而逐步導致代謝障礙和線粒體自噬過量,最終導致DCM和心力衰竭。此外,針對線粒體代謝和動力學的干預是改善心臟功能的有效策略。小鼠SDHAF4蛋白的生理評價為復雜II缺陷相關DCM的發展和臨床實踐提供了更多的見解。
參考文獻:
Wang Xueqiang., Zhang Xing., Cao Ke., Zeng Mengqi., Fu Xuyang., Zheng Adi., Zhang Feng., Gao Feng., Zou Xuan., Li Hao., Li Min., Lv Weiqiang., Xu Jie., Long Jiangang., Zang Weijin., Chen Jinghai., Ding Jian., Liu Jiankang., Feng Zhihui.(2022). Cardiac disruption of SDHAF4-mediated mitochondrial complex II assembly promotes dilated cardiomyopathy. Nat Commun, 13(1), 3947. doi:10.1038/s41467-022-31548-1






