設計巧妙的實驗思路,一起來發高分吧!- NCAPD3通過c-myc和E2F1增強Warburg效應,促進大腸癌的發生發展
NCAPD3是凝聚蛋白II復合物的三個非SMC亞基之一,在有絲分裂過程中對染色體的凝聚和分離起著重要作用。值得注意的是,在許多體細胞癌癥中發現NCAPD3水平升高。然而,NCAPD3在癌癥尤其是結直腸癌中的臨床作用、生物學功能和潛在的分子機制仍不清楚。目前,有研究發現NCAPD3在結直腸癌發生和結直腸癌進展中促進糖代謝重編程并增強Warburg效應,該文章發表在《JOURNAL OF EXPERIMENTAL & CLINICAL CANCER RESEARCH》,IF: 11.161。
技術路線:

主要研究結果:
1. NCAPD3在CRC細胞和臨床標本中過表達
對人類CRC組織及其對應的正常組織進行RNA-seq分析,數據分析顯示,與正常組織相比,腫瘤組織中NCAPD3的表達明顯升高(圖1A)。與正常組織相比,NCAPD3在腫瘤組織中顯著過表達(圖1B, C)。此外,Western blot檢測顯示,與人類正常結腸黏膜細胞系FHC相比,CRC細胞系中NCAPD3的蛋白水平顯著增加(圖1D上圖)。在臨床標本中,通過qRTPCR、Western blot和免疫化學分析,CRC組織中NCAPD3 mRNA和蛋白水平也明顯高于正常組織(圖1D下圖,1E, 1F)。這些結果表明,NCAPD3在CRC中過表達,提示NCAPD3與CRC關系密切。

圖1 NCAPD3在人CRC中表達較高
2. NCAPD3增強CRC細胞的糖代謝重編程
在之前的一項研究中,從HT-29(結腸上皮腺癌細胞)中免疫沉淀NCAPD3,并用液相色譜-質譜分析共沉淀蛋白。通過KOBAS在線平臺對文中發表的假定的NCAPD3相互作用體進行了功能富集分析,揭示了NCAPD3相互作用體在糖酵解和TCA循環中發揮作用(圖2A)。與陰性對照相比,HCT116細胞中NCAPD3過表達顯著增加了丙酮酸/乳酸/ATP的產生水平、乳酸脫氫酶的活性和2-NBDG的攝取,但降低了丙酮酸脫氫酶的活性,而在NCAPD3敲低的SW480細胞中,這一結果顯著逆轉(圖2B-G)。此外,NCAPD3過表達可上調GLUT1、HK2、ENO1、PKM2和LDHA蛋白水平,但不上調PGK1和PGAM1蛋白水平。相比之下,NCAPD3敲除PGK1和PGAM1外,降低了這些糖酵解基因的表達(圖2H)。如圖2I所示,NCAPD3敲低顯著降低了PDK1、PDK3和p-PDHE1α的表達水平,在NCAPD3過表達的細胞中得到了相反的結果,而PDHE1α的總蛋白水平保持不變。這些結果表明,NCAPD3增強了CRC細胞的有氧糖酵解,并減少了葡萄糖衍生碳到TCA循環的通量。

圖2 NCAPD3增強CRC細胞的糖代謝重編程
3. NCAPD3通過調控CRC細胞中的c-Myc及其下游代謝相關基因促進有氧糖酵解
為了確定c-Myc參與了NCAPD3調控的有氧糖酵解,首先分析了臨床標本的RNA-Seq數據。通過分析,發現CRC組織中的轉錄因子c-Myc水平明顯高于正常結直腸組織(圖3A)。如圖3B所示,過表達NCAPD3的HCT116細胞中c-Myc的蛋白和mRNA水平顯著升高,而敲低NCAPD3的SW480細胞中這一變化逆轉。為了驗證c-Myc對NCAPD3的糖酵解促進作用是必要的,在NCAPD3穩定過表達的HCT116細胞中使用siRNA和c-Myc抑制劑。數據顯示,c-Myc敲低和10058-F4 (c-Myc抑制劑)處理可逆轉NCAPD3誘導的GLUT1、HK2、ENO1、PKM2和LDHA的高表達 (圖3C)。丙酮酸、乳酸釋放和ATP產生分析的結果加強了這一結果(圖3D-F),這表明沉默或抑制c-Myc可以廢除NCAPD3在糖酵解調節中的功能。
此外,進行了免疫沉淀和western-blot分析,以探索NCAPD3和c-Myc在細胞核中的潛在相互作用。從數據中發現anti-NCAPD3抗體可以在HCT116細胞中共沉淀c-Myc。此外,在NCAPD3敲低的SW480細胞中,二者的相互作用也得到了支持(圖3G, H)。染色質免疫沉淀(ChIP)-PCR檢測進一步證實,HCT116細胞中過表達NCAPD3后,GLUT1、HK2、ENO1、PKM2和LDHA基因啟動子處c-Myc的結合富集顯著增加,而在NCAPD3敲低的SW480細胞中得到的結果相反(圖3I, J)。
這些結果表明c-Myc參與了CRC細胞中NCAPD3的糖酵解促進作用。NCAPD3通過增加糖酵解基因GLUT1、HK2、ENO1、PKM2和LDHA的啟動子中c-Myc的表達和招募更多的c-Myc來促進Warburg效應。
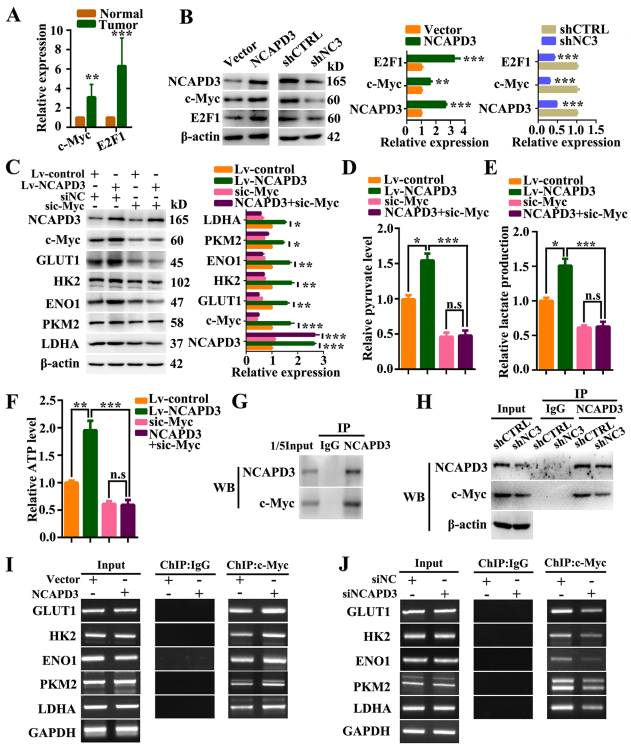
圖3 NCAPD3上調c-Myc并促進其下游代謝基因的表達
4. NCAPD3通過E2F1介導的丙酮酸脫氫酶抑制減弱CRC細胞中TCA循環通量
如圖4A和B所示,NCAPD3過表達上調E2F1及其靶基因PDK1和PDK3的水平,進而導致p-PDHE1α(但總PDHE1α)的增加和PDH活性的抑制,而用siRNA或抑制劑或抑制E2F1則逆轉了NCAPD3過表達誘導的結果。此外,免疫沉淀實驗顯示,抗NCAPD3抗體可以在HCT116細胞或NCAPD3敲除的SW480細胞中共沉淀E2F1(圖4C, D),這表明NCAPD3和E2F1在CRC細胞中相互作用。在HCT116細胞中,抗E2F1抗體不能共沉淀c-Myc,反之亦然,這表明NCAPD3、c-Myc和E2F1不能形成三聚體復合物(圖4E)。在HCT116細胞中,NCAPD3過表達增加了E2F1與PDK1和PDK3基因啟動子的結合富集,而在NCAPD3敲低SW480細胞中得到了相反的結果(圖4F, G)。

圖4 NCAPD3通過調節葡萄糖代謝切換器E2F1抑制TCA循環通量
5. NCAPD3具有促進CRC細胞增殖和轉移的作用
NCAPD3過表達促進了HCT116細胞的增殖和克隆形成(圖5A, B)。此外,劃傷愈合實驗數據顯示,與對照相比,NCAPD3異位表達顯著增加了HCT116細胞的遷移(圖5C)。在NCAPD3-敲低的SW480細胞中,細胞的增殖、集落形成和遷移都被大大削弱(圖5A-C)。此外,NCAPD3可以通過siRNA敲低(圖5D-F)來增強細胞增殖、集散形成和遷移。組織學分析顯示,與對照組相比,接受HCT116-NCAPD3亞群的小鼠形成了肺轉移灶(圖5G)。與對照組相比,過表達NCAPD3導致肺轉移瘤中Ki67染色更強(圖5H)。這些結果表明,c-Myc和E2F1參與了NCAPD3在體外促進CRC細胞增殖和遷移。此外,體內數據還表明,HCT116細胞中過表達NCAPD3可促進腫瘤肺轉移。
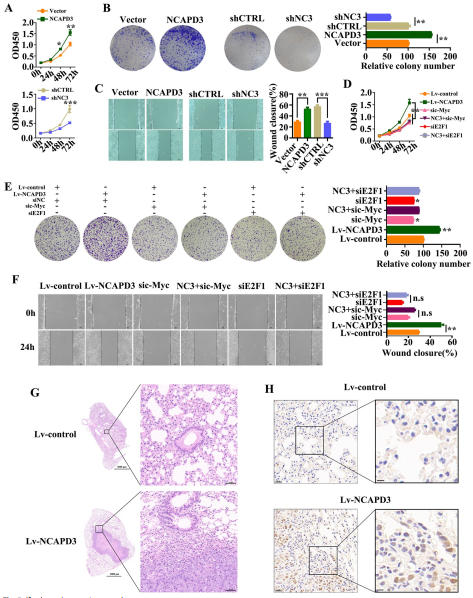
圖5 NCAPD3促進CRC細胞增殖、遷移和腫瘤轉移
6. NCAPD3通過增強CRC細胞有氧糖酵解在小鼠皮下移植瘤模型中促進腫瘤生長
過表達NCAPD3組中移植瘤的大小和重量較對照組明顯增大(圖6A, B),而2-DG組過表達NCAPD3組移植瘤的大小和重量較過表達NCAPD3組明顯減小(圖6A,B)。與對照細胞相比,HCT116-NCAPD3細胞形成的異種移植瘤的乳酸水平明顯升高,而2-DG處理后的HCT116-NCAPD3細胞形成的腫瘤的乳酸水平較僅HCT116-NCAPD3細胞形成的腫瘤降低(圖6C)。NCAPD3過表達對移植瘤中糖酵解相關蛋白水平的影響與乳酸釋放實驗得出的結論一致(圖6D)。
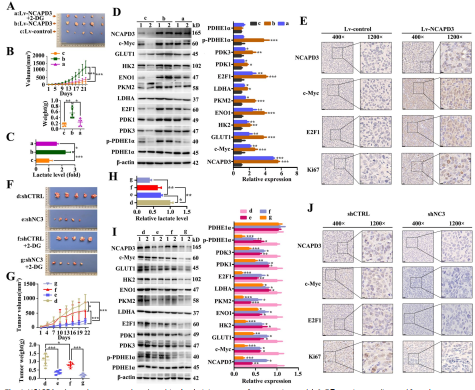
圖 6 NCAPD3 增強異種移植腫瘤小鼠模型中的腫瘤生長和有氧糖酵解
與野生型(WT)小鼠相比,NCAPD3小鼠在三次DSS處理中體重下降較少,實驗結束時體重增加,結腸長度變長(圖7A、B),表明NCAPD3缺陷小鼠對DSS誘導的結腸炎的易感性低于野生型小鼠。此外,NCAPD3小鼠的腫瘤數量和腫瘤大小均顯著低于WT同窩小鼠(圖7C)。Western blotting數據證實,敲除NCAPD3導致c-Myc、E2F1及其下游靶基因在蛋白水平顯著下調,而PDHE1α蛋白總表達量不變(圖7D)。組織學上,與NCAPD3±小鼠相比,WT小鼠呈現上皮完整性缺失和幾乎完全的隱窩缺失(圖7E)。此外,IHC分析還顯示,敲除NCAPD3導致c-Myc、E2F1和GLUT1的染色明顯減弱(圖7E),同樣NCAPD3±小鼠的結直腸腫瘤增殖率顯著降低,Ki-67細胞核染色比例較低(圖7E)。這些體內結果表明,NCAPD3缺乏可通過抑制糖代謝重編程和糖酵解來減輕AOM/DSS誘導的小鼠模型中結直腸腫瘤的發生。

圖7敲除NCAPD3可降低AOM/ DSS誘導的小鼠結直腸癌發生
8. CRC患者NCAPD3及其與代謝相關基因的相關性的臨床意義
NCAPD3分別與CRC組織中的c-Myc、ENO1、LDHA、E2F1、PDK1和PDK3呈強正相關,這進一步支持了我們的體外和體內實驗結果(圖8A)。如圖8B-D所示,NCAPD3-High/ PKM2-High、NCAPD3-High/LDHA-High和NCAPD3-High/ PDK1-High患者的總生存期較短。最后,使用Western blot方法評估了6對臨床CRC組織及其相應的相鄰正常組織中NCAPD3、c-Myc和E2F1的表達水平。與相鄰正常組織相比,CRC組織中NCAPD3、c-Myc和E2F1的表達量較高(圖8E)。這些結果表明NCAPD3及其誘導Warburg效應可能在結直腸腫瘤的發生和結直腸癌的發展過程中發揮重要作用,可能是結直腸癌的潛在標記物和臨床治療靶點。

圖8 CRC患者NCAPD3的臨床意義及其與代謝相關基因的相關性
結論:
在體內和體外,NCAPD3通過增加c-Myc和E2F1的表達并將這兩個轉錄因子招募到其靶基因的啟動子中,從而通過增強糖酵解過程和抑制TCA循環來重編碼糖代謝,提示NCAPD3在CRC的發生發展中調節糖代謝起著重要作用。






