新思路——鐵死亡依賴的巨噬細胞外泌體通過運載鐵蛋白促進間皮癌變
石棉誘導的相關疾病仍然是世界范圍內的社會負擔。作者之前的研究發現,石棉誘導的間皮細胞富含鐵,并有不斷的巨噬細胞鐵死亡。然而,這種誘變環境如何影響間皮細胞的分子機制尚未闡明。這里,作者提出了一個新的機制:鐵死亡的巨噬細胞產生的細胞外囊泡介導石棉相關的間皮細胞突變。隨后作者通過一系列體內外實驗證實了該猜想。本文于2021年10月發表在《Redox Biology》IF:11.799雜志上。
技術路線:

主要實驗結果:
1、鐵死亡依賴的細胞外囊泡(FedEVs)在石棉誘發的誘變環境中凝聚
首先進行組織學評估,使用小鼠腹膜注射青石棉注射模型來闡明FedEVs在石棉誘導的肉芽腫瘤中的組織定位。在石棉注射6個月后,觀察到慢性肉芽腫性腹膜炎是由于異物與過量的鐵的反應,類似于作者之前的報道(Fig. 1ad)。免疫熒光分析顯示,石棉纖維存在于CD68陽性的巨噬細胞內,而不存在于α- SMA陽性的肌成纖維細胞和間皮陽性的間皮細胞中(Fig. 1a)。值得注意的是,EV的標記物CD63在肉芽腫附近的間皮細胞和肌成纖維細胞中呈顆粒狀顯著富集(Fig. 1bc)。作者之前報道,在石棉誘導的巨噬細胞死亡在富鐵環境下鐵死亡是主要形式。因此,作者推測是否是鐵死亡導致巨噬細胞EV分泌增加。CD63的WB分析顯示,加入GPX4抑制劑RSL-3(即鐵死亡誘導劑)后,HT1080細胞分泌EV顯著增加(Fig. 1ef)。類似地,石棉暴露的富鐵環境下的THP1巨噬細胞,增加了EV的產生和分泌(Fig. 1gh)。此外,通過納米跟蹤分析(NTA)發現,在富鐵條件下,青石棉石暴露時EV數量增加最多(圖1kl),其直徑為150 nm,峰值在250 nm和350 nm處發生位移(圖1ij)。這些結果表明石棉依賴的巨噬細胞鐵死亡是和EV分泌直接相關的,石棉誘導的肉芽腫是FedEVs的一種輸出基質。

圖1 CD63陽性的FedEVs在石棉誘發的誘變環境中凝聚
2、間皮細胞內化FedEVs
接下來探究間皮細胞內化FedEVs的可能性。構建GFP-CD63穩定過表達的THP1和HT1080細胞系,作為FedEVs供體細胞(Fig. 2a)。將GFP標記的FedEVs加入MeT-5A間皮細胞后,在受體MeT-5A細胞的質膜上觀察到來自供體細胞的GFP-CD63,從0.5 h開始,持續到3 h,形成泡狀結構。在6 ~ 9小時后,FedEVs被受體間皮細胞完全內化,從GFP-CD63和內源性CD63共存的細胞質可以看出(Fig. 2bc)。然后,評估了在24小時內,間皮細胞中催化Fe(II)的含量,通過FACS分析顯示,細胞內催化Fe(II)的含量顯著增加(Fig. 2d-g)。這些結果表明,FedEVs可能將鐵從鐵死亡的巨噬細胞轉運到間皮細胞。
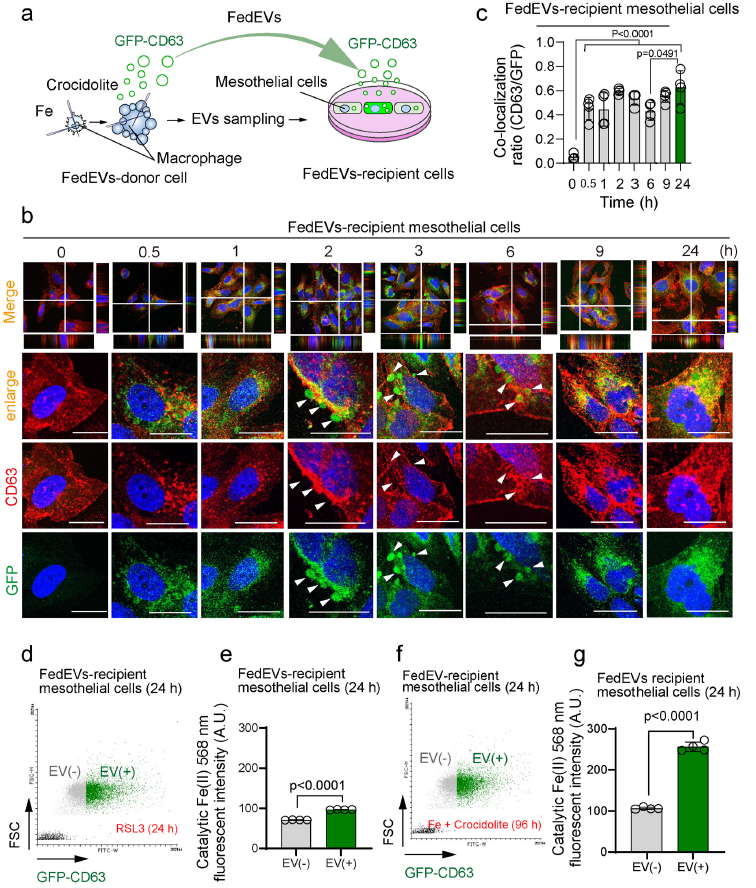
圖2間皮細胞內化FedEVs
3、FedEVs以鐵蛋白為主要成分
為了全面鑒定FedEVs中的蛋白質成分,使用LC-MS進行了蛋白質組學分析。從暴露于鐵和/或青石棉96小時的巨噬細胞分泌的FedEVs中提取蛋白質。將差異表達蛋白(未處理vs青石棉和鐵處理)整合為蛋白質圖譜圖像,涵蓋整個項目并列出前15個差異增加蛋白(Fig. 3ab)。鐵蛋白輕鏈和重鏈(FTL和FTH)是鐵在FedEVs中的儲存鐵的蛋白質。值得注意的是,只有鐵或鐵和青石棉處理組的FedEVs含有大量的FtL和FtH (Fig. 3cd),這與鐵過量有關。作者還證實了在體內,FtL和CD63在青石棉肉芽腫周圍的間皮細胞上的共定位(Fig. 3e)。這些結果表明,FedEVs可以通過鐵蛋白轉運鐵。
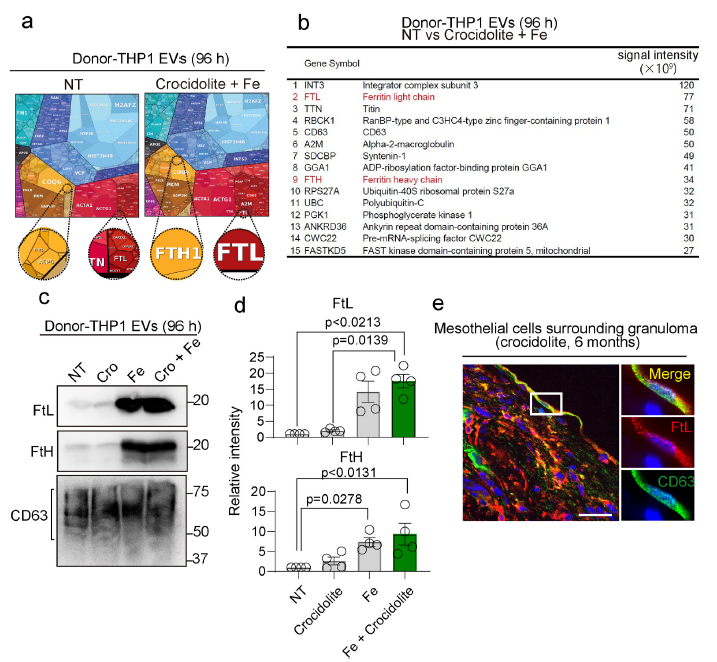
圖3非選擇性蛋白質組分析顯示鐵蛋白是石棉誘導的FedEVs的主要成分
為了進一步了解FedEVs的生物學意義,對FedEVs受體間皮細胞進行了RNA測序和轉錄分析。該分析在FedEVs暴露后的FedEVs-high或-low間皮細胞上進行了3個重復,該細胞通過鐵死亡的巨噬細胞來源的GFP-CD63分化,以未處理的間皮細胞為對照(Fig. 4a)。FDR校正的p值小于0.01和log2FC絕對值大于0.5為參數,鑒定出245個差異表達基因,其中163個表達上調,82個表達下調(Fig. 4bc)。GO分析將FedEVs受體細胞的基因表達變化與有絲分裂期的細胞周期聯系起來,而中體和著絲粒在細胞成分中占過多的比例(Fig. 4d)。上調基因的基因集富集分析(GSEA)也顯示在FedEVs-high受體間皮細胞中有絲分裂相關基因集顯著上調(Fig. 4e)。特別是,在FedEVs-high的受體間皮細胞中,Cyclin B1和Cyclin D1的表達增加(Fig. 4fg)。這些結果表明,FedEVs的攝取和有絲分裂過程在受體間皮細胞中是一致的。

圖4間皮細胞中FedEVs攝取與有絲分裂的一致性
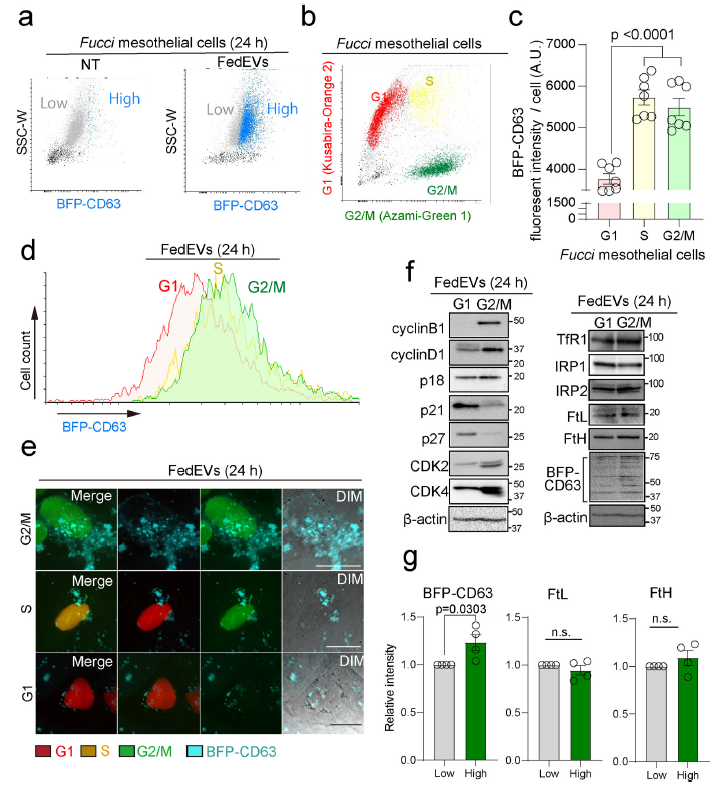
5、有絲分裂間皮細胞內化FedEVs導致鐵超載
為了確定有絲分裂間皮細胞是否確實內化了FedEVs,建立了FedEVs供體BFP-CD63巨噬細胞(THP1)和表達Fucci的受體間皮細胞,其中G1(紅色)、S(黃色)和G2/M(綠色)相位顯示不同的熒光(fMeT- 5A)。結合FACS和免疫印跡分析可以同時檢測具有BFP-CD63的FedEVs-high受體細胞(Fig. 5a)和間皮細胞的G1、S和G2/M期(Fig. 5be)。攝取FedEVs后,在S期和G2/M期fMeT-5A細胞中BFP-CD63增加(Fig. 5c-e)。此外,與未處理細胞相比,FedEVs受體間皮細胞中FtL和FtH蛋白水平升高,而TfR1和IRP2表達下降,表明處于鐵充足狀態(Fig. 4fg)。相反,鐵相關蛋白的表達在FedEVs受體間皮細胞的G1期和G2/M期之間沒有明顯變化(Fig. 5fg)。此外,細胞周期相關蛋白,包括細胞周期蛋白Cyclin B1和Cyclin D1,和CDKs,在未處理對照組和FedEVs受體間皮細胞之間也沒有表達變化(Fig. 5fg)。這些數據表明,FedEVs的攝入直接導致鐵過剩,而沒有明顯改變細胞周期。
6、內吞FedEVs增強間皮細胞DNA損傷
為了評估FedEVs受體間皮細胞中的DNA損傷,進行了氧化DNA堿基修飾和DNA雙鏈斷裂的FACS和成像分析。8-OHdG是由羥基自由基、單氧或過氧亞硝酸鹽引起的最豐富的DNA修飾之一。γH2AX被快速招募到DNA雙鏈斷裂處進行修復,從而作為DNA損傷標志物。間皮細胞被暴露在石棉誘導的TPH1來源的FedEVs中,24小時后進行γH2AX評估。結果觀察到FedEVs的受體細胞核中8-OHdG和γH2AX水平均顯著增加(Fig. 6a–e),該結果在腹膜注射的小鼠模型中得到證實,肉芽腫周圍間皮細胞中γH2AX,CD63和FtL增加(Fig. 6fg)。
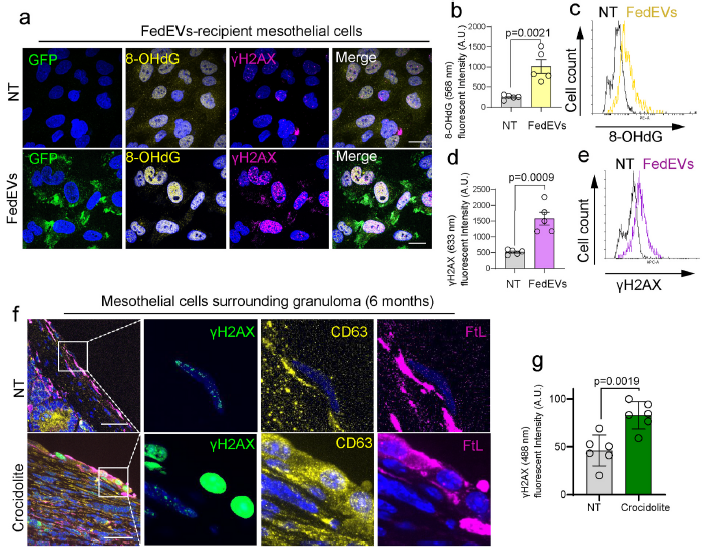
圖6內吞FedEVs導致受體間皮細胞的氧化DNA堿基修飾和DNA雙鏈斷裂
參考文獻:
Ito Fumiya., Kato Katsuhiro., Yanatori Izumi., Murohara Toyoaki., Toyokuni Shinya.(2021). Ferroptosis-dependent extracellular vesicles from macrophage contribute to asbestos-induced mesothelial carcinogenesis through loading ferritin. Redox Biol, 47(undefined), 102174. doi:10.1016/j.redox.2021.102174






