外傷性損傷損害核漿運輸,導致TDP-43病理

創(chuàng)傷性腦損傷(TBI)是世界范圍內最常見的死亡和殘疾原因之一。事實上,創(chuàng)傷性腦損傷導致的繼發(fā)性損傷可導致長期的神經和神經精神后遺癥,包括神經退行性疾病,如肌萎縮性脊髓側索硬化癥(ALS)、阿爾茨海默病(AD)和帕金森病。TBI還與慢性創(chuàng)傷性腦病(CTE)的發(fā)展有關,CTE是一種與反復頭部創(chuàng)傷相關的進行性神經退行性綜合征。反復創(chuàng)傷患者(如CTE)的死后腦組織以及創(chuàng)傷性腦損傷動物模型顯示微管相關蛋白(TAU)和TAR DNA/RNA結合蛋白(TDP-43)病理變化。TDP-43病理是神經退行性變的標志,在~ 97%的ALS病例、~ 45%的額顳葉癡呆(FTD)病例和~ 60%的AD病例中均有TDP-43表現(xiàn)。盡管有證據(jù)表明TDP-43病理作為神經退行性變的生物標志物,但仍不清楚重復創(chuàng)傷如何促進TDP-43蛋白病。
TDP-43是一種主要的核DNA/RNA結合蛋白,穿梭于細胞核和細胞質之間。TDP-43調控RNA處理,如基因轉錄、mRNA剪接、mRNA穩(wěn)定性、mRNA運輸和定位,病理突變破壞RNA代謝。在許多神經退行性疾病中,TDP-43偏離細胞核并聚集在細胞質中。細胞質TDP-43聚集體被認為是神經退行性變的重要機制,因為這些聚集體被異常磷酸化和泛素化。有多種機制被提出來解釋神經退行性疾病中TDP-43異常的細胞質積累和TDP-43病理的進行性擴散。
TDP-43包含一個類似朊病毒的低復雜度域,并具有一個本質上的無序區(qū)域(IDR),使TDP-43易于聚集。RNA結合蛋白(rbp)中的IDRs被認為在核糖體蛋白顆粒(如p -小體、應激顆粒和神經元顆粒)的組裝中起關鍵作用,提示rbp的突變或異常聚集可能會破壞這些顆粒的動力學。此外,rbp中的IDRs如TDP-43經歷了液-液相分離,TDP-43的病理突變改變了液-液相分離,這可能有助于疾病進程。因此,rbp如TDP-43的改變可能是神經退行性變的重要指標。然而,盡管這些機制可能解釋了TDP-43病理突變在神經退行性疾病中的作用,但TDP-43如何在無突變的情況下聚集形成并導致神經退行性疾病,如反復創(chuàng)傷患者的大腦,目前尚不清楚。
最近有報道稱,ALS/FTD中TDP-43的聚集可以隔離核孔蛋白、轉運蛋白和其他因子,表明TDP-43的聚集強烈破壞核質轉運(NCT)和核孔復合體。此外,在AD、ALS和亨廷頓氏病(HD)中NCT也被破壞,提示在這些神經退行性疾病中有一個共同的功能失調途徑。然而,TDP-43在反復顱腦損傷致神經退行性變中的病理機制尚不清楚。此報道之前曾證明,重復的創(chuàng)傷導致果蠅大腦中的泛素、p62和TDP-43包涵體以及應激顆粒病理。在這里,我們對果蠅的大腦進行了蛋白質組學分析,以確定創(chuàng)傷損傷后改變的分子通路。
2021年5月,在Elife 雜志上發(fā)表了文章“Traumatic injury compromises nucleocytoplasmic transport and leads to TDP-43 pathology.”。此報道在體內,反復的創(chuàng)傷會上調核孔蛋白,改變核孔蛋白的穩(wěn)定性,改變NCT蛋白,改變RanGAP1和核孔蛋白的分布,改變NCT。此外,核輸出的藥理抑制可以防止tbi介導的致命性和NCT缺陷。有趣的是,在體內和體外,核孔蛋白的上調導致TDP-43定位錯誤、聚集、磷酸化和溶解性改變,并降低運動功能和壽命。對NUP62病理和CTE患者腦組織中NUP62濃度升高的研究結果表明NCT缺陷與創(chuàng)傷損傷有關,這可能介導了TDP-43的病理變化。
技術路線
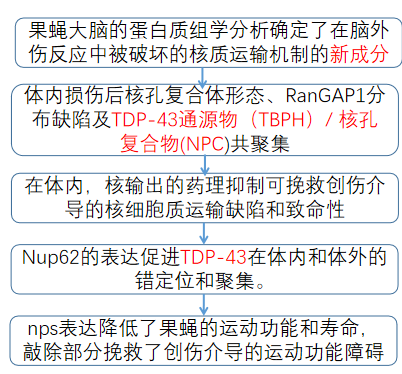
一、腦損傷改變了果蠅的大腦蛋白質組,擾亂了NCT蛋白和Nup蛋白水平
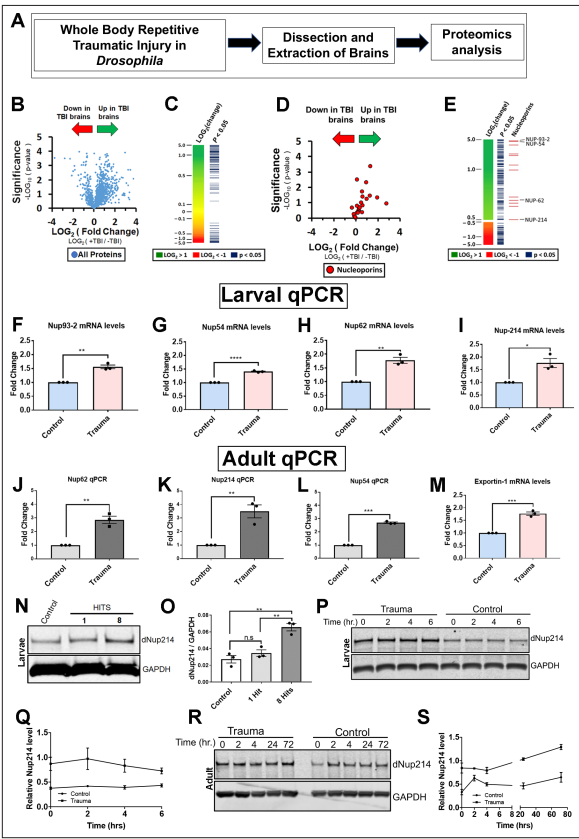
為了研究創(chuàng)傷性腦損傷的機制,我們使用了一個具有良好特征的創(chuàng)傷性腦損傷果蠅模型,該模型顯示了強大的表型,如TDP-43同源物(Tbph)、p62、應激顆粒和泛素病理,以識別和研究創(chuàng)傷性腦損傷后大腦蛋白質組的變化(圖1A)。對暴露于重復TBI的三齡果蠅幼蟲大腦中的2000個蛋白質進行了無偏性蛋白質組學分析(w1118),發(fā)現(xiàn)361個蛋白質在創(chuàng)傷損傷后發(fā)生了顯著變化(p 0.05,學生t檢驗)。基于基因本體論(GO)的復雜網絡分析在BiNGO (Cytoscape 3)中對tbi相關腦蛋白質組與非tbi對照進行了關聯(lián)分析,確定了不同類別的改變蛋白,其中大多數(shù)上調(圖1B和C;圖1圖補充1A-E;補充文件1和3)。TBI后上調的最高類別是微管細胞骨架、蛋白質折疊和蛋白酶體。此外,我們還鑒定了涉及核蛋白復合體和剪接體的蛋白質。核孔復合體(NPC)和NCT通路的組成部分是tbi后上調的主要蛋白子集(圖1圖補充1F)。鼻咽癌通路此前尚未被認為與創(chuàng)傷介導的神經退行性變有關,但據(jù)報道,在ALS/FTD、AD、HD和其他神經退行性疾病中,鼻咽癌通路被破壞。因此,我們決定進一步研究鼻咽癌改變介導TDP-43在TBI中的病理變化。蛋白質組學分析顯示,一些Nups在腦損傷時被上調(圖1D和E)。對這些Nups的定量逆轉錄酶聚合酶鏈反應(qRT-PCR)分析證實,TBI顯著上調Nup93-2、Nup54、Nup62、Nup44A,和Nup214 mRNA水平的果蠅幼蟲(圖1F I和圖1圖Supplement 1G)和成年大腦(圖1J L)。此外,核輸出基因Emb (Exportin)的mRNA水平在tbi后顯著增加(圖1M),而與對照組相比,微管相關蛋白Futsch的mRNA水平沒有變化(圖1圖Supplement 1H),這與蛋白質組學分析一致。Western blotting進一步證實了tbi依賴性的果蠅幼蟲腦內Nup214蛋白水平的升高(圖1N和O)。Western blot分析了損傷后幼蟲(0、2、4和6小時)和成蟲(0、2、4、24和72小時)的時間過程,以評估Nup214蛋白的水平。在檢測的時間點上,不管是幼蟲還是成人的大腦中,Nup214蛋白的水平都是上調的(圖1P,Q,R,S),這表明創(chuàng)傷可能會破壞Nup214的水平和體內的轉換。
二、TBI破壞了NPC和RanGAP1的分布,導致TBPH/NPC共聚集

使用鼻咽癌標記Mab414,它可以識別包括Nup62在內的幾個Nups的FG結構域,我們發(fā)現(xiàn)在非tbi控制的果蠅大腦中,核膜上有一個主要的同質的環(huán)狀標記。非腦外傷對照組的腹神經索(VNC)鼻咽癌染色呈均勻分布。相比之下,暴露于TBI的vnc核膜NPC染色不規(guī)則,顯示核形態(tài)紊亂。我們在腦外傷后觀察到核膜間隙和聚集(Mab414團塊)的出現(xiàn)(圖2A)。TBI腦中Mab414染色異常的細胞百分比明顯高于非TBI對照(圖2B)。tbi暴露的vnc中Tbph和Mab414的核周和細胞質共聚集,而對照大腦顯示很少或沒有共聚集(圖2C)。定量結果顯示,與對照組相比,tbi暴露的vnc中具有共聚集的Mab414 tbph陽性細胞百分比顯著升高(圖2D)。RanGAP1對Ran-GTP的水解對于核出口過程中貨物進入細胞質至關重要。RanGAP1維持核/細胞質Ran梯度,其丟失會導致細胞死亡。在非tbi對照組大腦中,RanGAP1在核膜內分布均勻,少數(shù)細胞表現(xiàn)出強烈的核信號。但tbi暴露后,RanGAP1染色分布異常,細胞核和細胞質強度高(圖2E)。與對照組相比,腦外傷后RanGAP1分布異常的細胞百分比明顯增高(圖2F)。反復的創(chuàng)傷損傷會干擾RanGAP1在大腦中的定位。TBI大鼠損傷皮質(同側半球)下海馬區(qū)域的腦細胞表現(xiàn)出錯誤定位和/或聚集(箭頭)或強烈的RanGAP1核染色(箭頭),而假手術對照組主要是光滑的核周染色(圖2H)。與假對照相比,創(chuàng)傷性腦損傷大鼠的NUP62顯示了明顯的胞質(箭頭)和核(箭頭)錯位,假對照顯示了很少的胞質(而沒有核)錯位(圖2J)。創(chuàng)傷性腦損傷腦組織中NUP62病理細胞的百分比明顯高于假手術對照組(圖2K).
三、在體內,tbi介導的NCT缺陷和致死率被核輸出抑制劑抑制
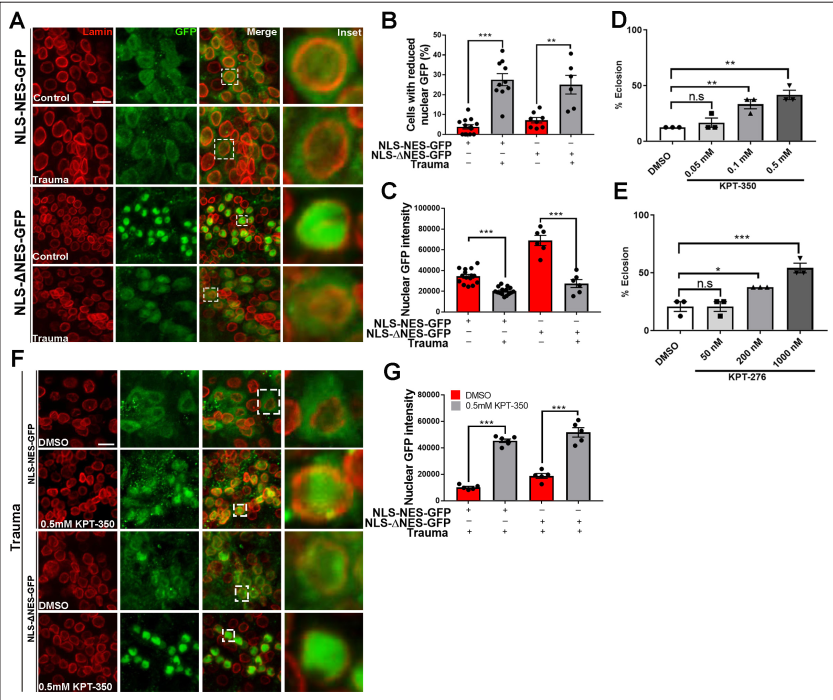
為了確定TBI是否會損害體內的核質運輸,我們在果蠅運動神經元中過表達了一個帶有核定位序列(NLS)和核輸出序列(NES)標記的GFP蛋白(OK371-gal4)。在表達nlsnes -GFP的大腦中,GFP信號分布在細胞核和細胞質中(圖3A)。然而,定量分析顯示,在nls - nes -GFP表達的vnc暴露于TBI中,核GFP信號減少的細胞百分比顯著增加,而核GFP強度顯著降低(圖3B和C),說明GFP核進口受到抑制和/或GFP核出口增加。接下來,我們在運動神經元中表達了一種用NLS和突變的NES (ΔNES)標記的沒有核輸出活性的GFP蛋白。表達NLS的非創(chuàng)傷性腦損傷動物的腦細胞-ΔNES-GFP顯示了GFP在細胞核的強大定位(圖3A),而創(chuàng)傷性腦損傷動物的vnc顯示了核GFP減少的細胞數(shù)量顯著增加,核GFP強度降低((圖3B和C)。果蠅幼蟲暴露于TBI,并在DMSO單獨、KPT-350(0.05、0.1或0.5 mM)或KPT-276(50、200或1000 nM)上飼養(yǎng)。對經歷過TBI的果蠅幼蟲的羽化試驗顯示,KPT-350處理的動物(圖3D)或KPT-276處理的動物(圖3E)具有顯著的劑量依賴性的致死抑制。kpt -350處理的果蠅核GFP信號顯著高于dmso處理的對照組(圖3G)。
四、在體內和體外,NUPs的上調導致TDP-43/TBPH定位錯誤和聚集
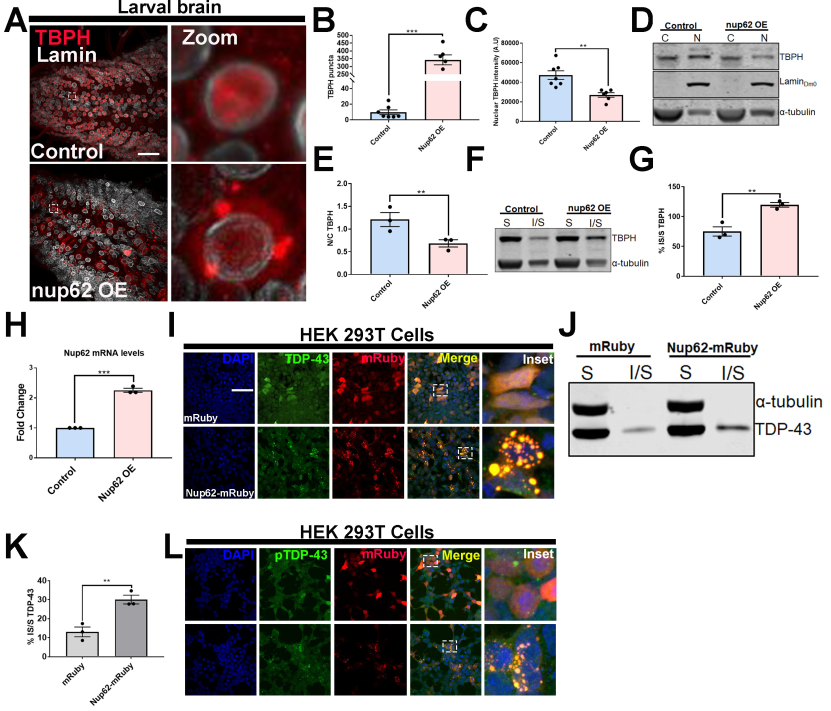
為了檢測Nup上調對Tbph (Drosophila TDP-43)病理的影響,我們建立了一個位點特異性Nup62過表達(Nup62 OE)蠅線,并對內源性Tbph進行染色。在eGFP對照(以下稱為對照)表達的果蠅幼蟲VNC中,Tbph的分布以細胞核為主,而Nup62 OE幼蟲VNC顯著改變了Tbph的定位,出現(xiàn)細胞質聚集(圖4A)。定量分析顯示,與對照組相比,Nup62 OE果蠅幼蟲或成年大腦中斑點Tbph顯著增加(圖4B)。與對照組相比,Nup62 OE vnc的核Tbph強度顯著降低(圖4C)。此外,核細胞質(N/C)分割進一步證實,與對照組相比,Nup62 OE動物的Tbph N/C比值顯著降低(圖4D和E),表明Nup62的上調改變了Tbph在體內的亞細胞定位。Nup62表達引起的Tbph的錯位和聚集也讓我們檢測了Nup62表達是否影響Tbph的溶解度。Nup62 OE或對照果蠅大腦的可溶性-不可溶性分選顯示,與對照相比,Nup62在運動神經元中表達的上調顯著增加了不溶性,從而改變了Tbph的可溶性(圖4F和G),表明Nup62水平是Tbph溶解度的重要決定因素。qPCR證實了Nup62的過表達(圖4H)。NUP62與內源性TDP-43共聚合(圖4I)。與單獨mRuby相比,NUP62在HEK293T細胞中的表達導致TDP-43的溶解性顯著改變(圖4J和K)。檢測了nup62介導的TDP-43聚集物在HEK293T細胞中是否被磷酸化。內源性與NUP62-mRuby共定位的TDP-43聚集體被磷酸化(圖4L)。
五、敲除核孔蛋白來挽救核孔蛋白的表達導致果蠅的運動功能障礙和壽命縮短
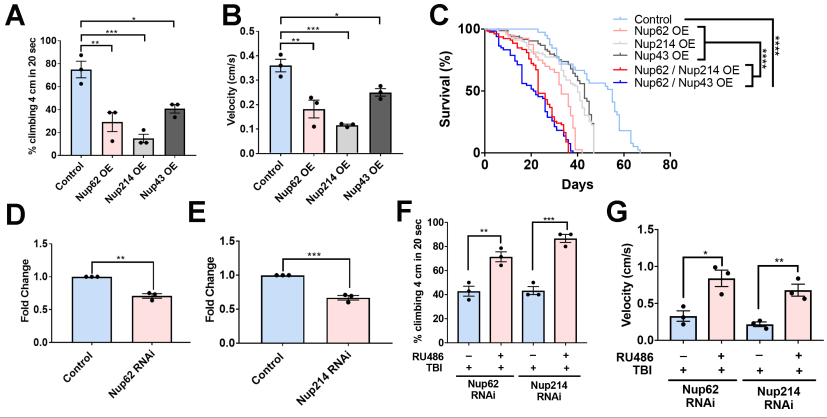
Nup62、Nup214、Nup43在運動神經元中過表達顯著降低了運動功能和攀爬速度(圖5A和B)。與各自的Nup對照或對照組動物相比,過表達Nup62和Nup214或Nup62和Nup43的動物的壽命明顯縮短——Nup62/ Nup214 OE和Nup62/Nup43 OE的中位存活時間分別為23天和21天(圖5C)。用RNAi成蟲(Nup62或Nup214)多次暴露于創(chuàng)傷后,檢測其運動功能和壽命。Nup62 mRNA (p <0.01)和Nup214 mRNA (p <0.001)與對照組相比,Nup62和Nup214 RNAi處理組的攀爬水平顯著降低(圖5D和E)。有趣的是,Nup62 RNAi和Nup214 RNAi處理組創(chuàng)傷后攀爬水平顯著提高(圖5E, )和速度(圖5F)。
六、核孔病理存在于重復性TBI患者腦組織中,并與TDP-43病理共同聚集
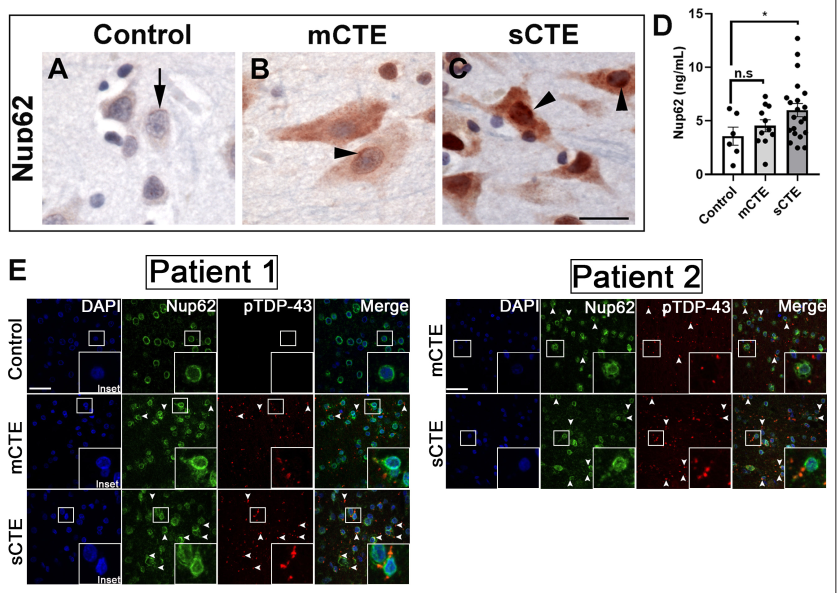
輕度和重度CTE的組織,但年齡不匹配的對照組顯示廣泛和強烈的NUP62免疫反應性(圖6A,B,C)。21例嚴重CTE患者腦組織的NUP62水平明顯高于對照組(圖6D)。輕度CTE病例中NUP62與pTDP-43的共聚集程度有限,而重度CTE病例中NUP62和pTDP-43陽性包體在額葉皮質的共聚集(箭頭)更為明顯(圖6E)。






