TEA-seq——同時測定轉(zhuǎn)錄本、表位和染色質(zhì)可及性的三峰式單細胞的新工具

2021年,美國華盛頓大學生物醫(yī)學信息學與醫(yī)學教育系和華盛頓大學兒科等團隊合作在Elife(IF=7.08) 雜志上發(fā)表了文章“Simultaneous trimodal single-cell measurement of transcripts, epitopes, and chromatin accessibility using TEA-seq.”。此報道開發(fā)了一種新的scATAC-seq工作流程,增加了信噪比,并允許對細胞表面標記物和染色質(zhì)可及性進行配對測量:染色質(zhì)環(huán)境和表位的整合細胞索引,稱為ICICLE-seq。用基于液滴的多組學平臺擴展了這種方法,開發(fā)了一種三峰分析方法,可以同時測量數(shù)千個單細胞的轉(zhuǎn)錄組學(scRNA-seq)、表位和染色質(zhì)可及性(scATAC-seq),并稱之為TEA-seq。這些多模式單細胞檢測提供了一個新的工具箱來識別基于表型定義的細胞類型的類型特異性基因調(diào)控和表達。
外周血單個核細胞(PBMCs)梯度離心純化是研究人體免疫健康和疾病的臨床相關(guān)細胞的主要來源。像大多數(shù)其他人體組織一樣,PBMC是一種復雜的、異構(gòu)的細胞類型混合物,來源于共同的干細胞祖細胞。盡管不同的PBMC細胞類型之間的基因組大部分是不變的,但每種免疫細胞類型執(zhí)行重要的和不同的功能。理解控制細胞系規(guī)范、細胞成熟、激活狀態(tài)和響應(yīng)細胞內(nèi)外信號的功能多樣性的基因組調(diào)控景觀,是理解健康和疾病中的免疫系統(tǒng)的關(guān)鍵。
最近單細胞基因組方法的改進使復雜細胞類型混合物的調(diào)控染色質(zhì)景觀的輪廓成為可能。特別是,基于液滴的單核或單細胞轉(zhuǎn)座酶可及染色質(zhì)分析(snATAC-seq, scATAC-seq, dscATAC-seq, mtscATAC-seq)允許在單細胞分辨率下分析開放染色質(zhì)。有前景的新方法將scATAC-seq與同時測量核mRNA或與細胞表面表位結(jié)合。
然而,在單細胞方法中,尚未出現(xiàn)一種適用于所有三種模式的統(tǒng)一方法,這種方法可以應(yīng)用于高度特定的功能免疫細胞類型。我們系統(tǒng)地測試了PBMCs的全細胞和核純化和制備方法,以克服以往的分析只限于測量細胞表面的核成分(ATAC和核rna)或蛋白質(zhì)的局限性。我們發(fā)現(xiàn)完整的透性細胞的scATAC-seq表現(xiàn)非常好,在某些測量中超過了傳統(tǒng)的細胞核scATAC-seq(圖1b)。這一發(fā)現(xiàn)使得一種類似于轉(zhuǎn)錄組和表位的細胞索引(CITE-seq)的新方案能夠測量表面蛋白豐度和染色質(zhì)可及性:染色質(zhì)景觀和表位的整合細胞索引(ICICLE-seq,圖1a和3)。最后,我們證明了我們優(yōu)化的可滲透細胞方法可以與基于液滴的多組學平臺相結(jié)合,從而能夠同時測量細胞的三個不同的分子隔間:mRNA(通過scRNA-seq),蛋白質(zhì)(使用寡聚標記抗體)和DNA(通過scATAC-seq),我們根據(jù)轉(zhuǎn)錄、表位和可及性將其稱為TEA-seq(圖4)。總之,對單細胞水平上基因調(diào)控和表達的分子基礎(chǔ)有了新的、更統(tǒng)一的看法。
一、PBMC單核、單細胞ATAC序列優(yōu)化
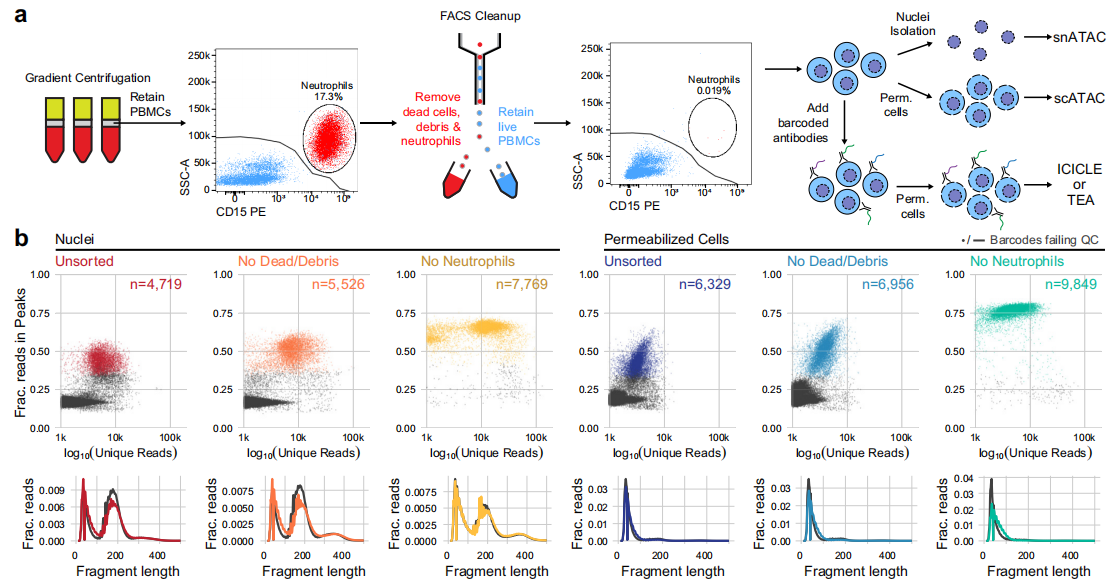
A. snATAC、scATAC和ICICLE-seq方法的主要步驟概要。ficoll純化的PBMCs和白細胞分離純化的PBMCs之間的一個主要區(qū)別是ficoll純化樣品中存在殘留的中性粒細胞。我們使用熒光激活細胞分選(FACS)從高中性粒細胞含量的PBMC樣本中檢測去除死細胞和碎片的方法,包括去除中性粒細胞和不去除中性粒細胞。
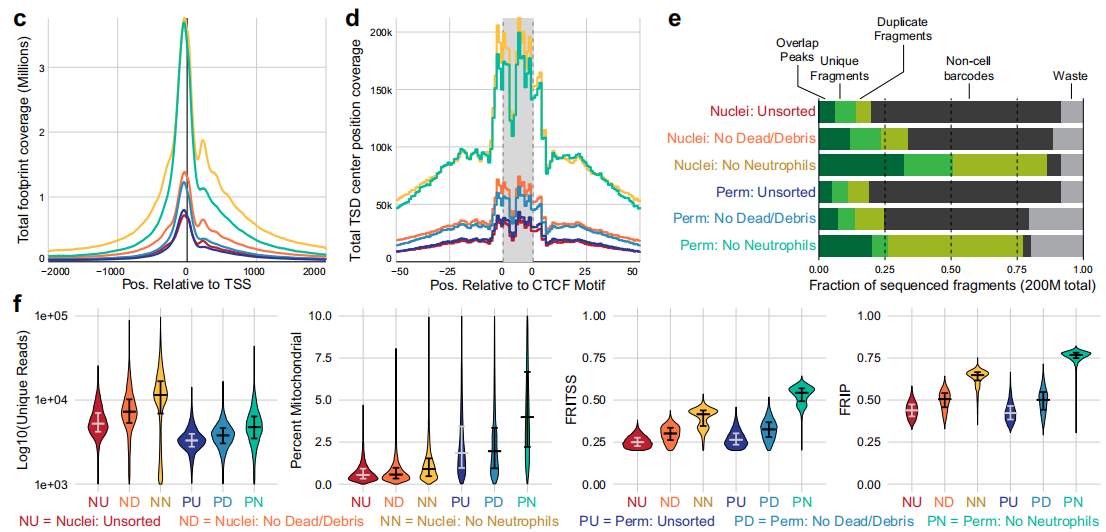
B. 這種單核分析利用低滲裂解、洗滌劑和皂苷的組合來分離細胞核,而不保留線粒體DNA。使用這種方法進行snATAC-seq,測序,并將數(shù)據(jù)質(zhì)量指標(材料和方法)制成表格后,鑒定了兩個主要的細胞條碼群體。細胞核制備的scATAC-seq文庫包含更多來自核小體DNA片段的reads,而來自細胞核的非細胞條形碼(灰線)包含的這些片段比細胞條形碼更多。
C. 為了評估這種差異對每種方法獲得的數(shù)據(jù)的影響,在TSS和CTCF轉(zhuǎn)錄因子結(jié)合位點附近覆蓋了Tn5足跡。在透性細胞中,TSS的信號被保留,但是與孤立的核相比,TSS的側(cè)翼位置(被鄰近的核小體占據(jù))的信號減少了
D. 用白細胞分離純化的pbmc比用Ficoll梯度離心純化的pbmc始終具有更高的FRIP評分和更少的非細胞條形碼。
E. F. FACS獲得的完整通透細胞具有最高的frp和FRITSS評分,最少的非細胞條形碼和最大的細胞捕獲效率,線粒體閱讀量僅略有增加.
二、改進標簽轉(zhuǎn)移和差異分析
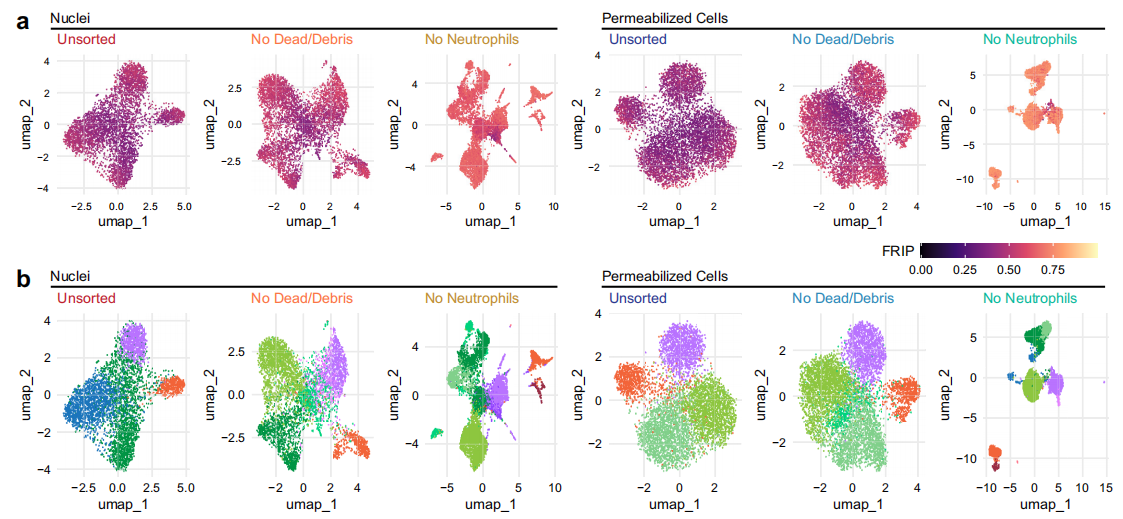
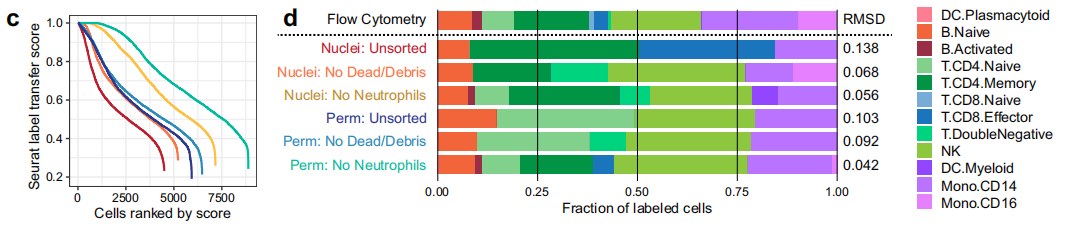
研究了方法差異對下游生物學分析的影響
A. B.去除中性粒細胞大大提高了在細胞核和細胞的均勻流形近似和投影(UMAP)投影中分離各種細胞類型的能力.
C使用這些工具,中性粒細胞的去除提高了標記轉(zhuǎn)移評分,與核基方法相比,滲透性細胞產(chǎn)生了更多具有高標記轉(zhuǎn)移評分的細胞.
D所有方法產(chǎn)生的CD16+單核細胞均少于流式細胞術(shù)觀察到的CD16+單核細胞,這表明無論是使用核或通透細胞的scATAC-seq過程中,CD16+單核細胞可能丟失,或者標簽轉(zhuǎn)移方法不利于識別這種細胞類型.
三、ICICLE-seq聯(lián)合測量可及性和表位
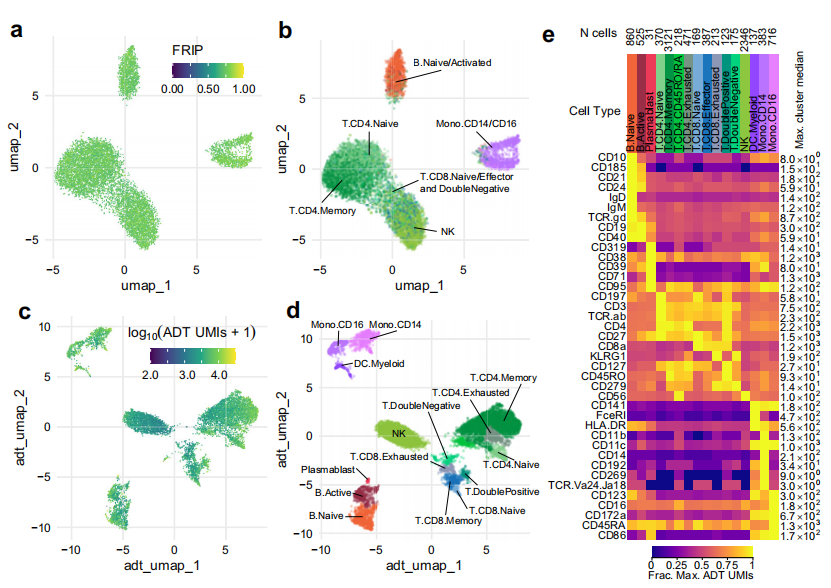
A. 在標準的scATAC-seq協(xié)議下,細胞膜的去除切斷了細胞表面和細胞染色質(zhì)狀態(tài)之間的連接。為了測試我們在通透性細胞上同時測量細胞表面蛋白和染色質(zhì)狀態(tài)的能力,我們修改了我們優(yōu)化的通透性細胞scATAC-seq方法,將其納入使用商用條形碼抗體試劑的測量,我們將這種新方法稱為ICICLE-seq. ICICLE-seq協(xié)議利用定制的Tn5轉(zhuǎn)座復合體,其捕獲序列與基因組公司的10x scRNA-seq凝膠珠捕獲反應(yīng)兼容,可同時捕獲ATAC片段和多聚腺苷化抗體條形碼序列.
B. UMAP投影和ATAC標記轉(zhuǎn)移在ICICLE-seq數(shù)據(jù)上的分辨率與scATAC-seq在死亡細胞和清除碎片后的完整通透細胞上的分辨率相似.
C. 然而,基于poly- based的捕獲方法和置換片段的單端讀出限制了數(shù)據(jù)質(zhì)量。盡管如此,ICICLE-seq結(jié)果表明,通透細胞能夠同時捕獲細胞核染色質(zhì)可達性和高質(zhì)量的細胞表面表位定量。我們能夠利用額外的ADT數(shù)據(jù)聚集并根據(jù)細胞表面抗原識別細胞類型.
D. E. 基于ADT數(shù)據(jù)的UMAP和Jaccard Louvain聚類可以根據(jù)細胞類型特異性標記與聚類的明確關(guān)聯(lián)識別細胞類型特異性聚類。
四、TEA-seq轉(zhuǎn)錄本、表位和可及性的三峰測量
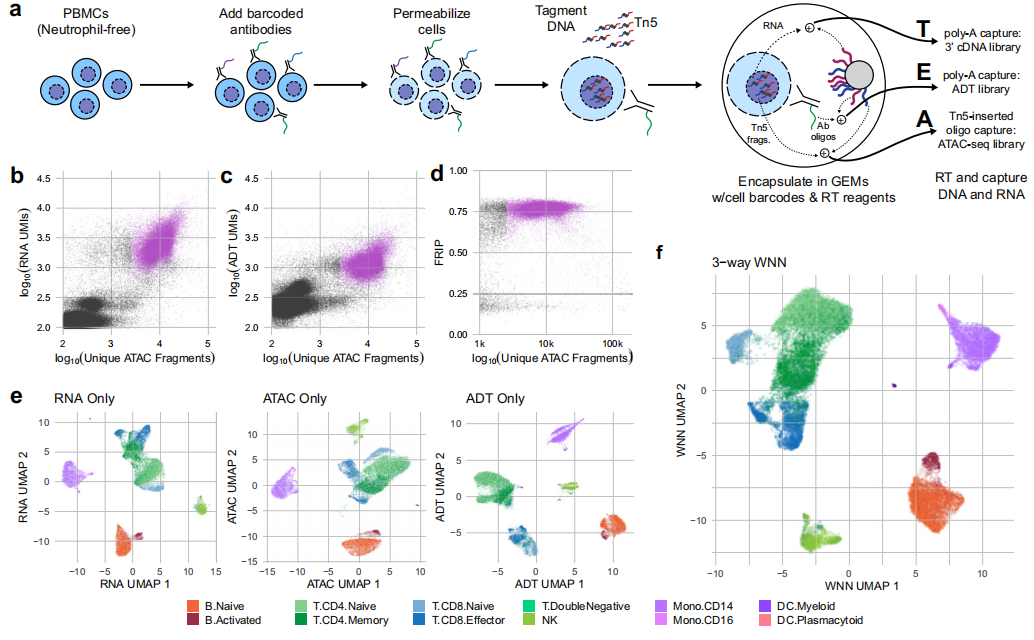
A. 隨著從單個核中同時捕獲RNA-seq和ATAC-seq的商業(yè)平臺的發(fā)布,我們推斷通透細胞可以用于同時捕獲三個主要的分子隔間:DNA可以用scATAC-seq捕獲,RNA可以用scRNA-seq捕獲,蛋白質(zhì)表位豐度可以用聚腺苷化抗體條形碼捕獲,我們根據(jù)轉(zhuǎn)錄本、表位表位和可及性將其稱為TEA-seq。經(jīng)過試驗和關(guān)鍵步驟的優(yōu)化后,我們能夠在10倍基因組Multiome ATAC +基因表達平臺上獲得文庫,該平臺使用46個低聚標記抗體組合了數(shù)千個單細胞的所有三種測量結(jié)果.
B. D.在對裝入4孔的細胞進行初始數(shù)據(jù)處理后,我們鑒定出29264個通過上述scATAC-seq QC標準的細胞條形碼,有2,500,500個獨特的ATAC-seq片段(中值= 8762個獨特的ATAC片段),有>500個基因被scRNA-seq檢測到(中值= 2399個RNA UMIs;中位數(shù)=檢測到129,249個基因),500個ADT UMIs.
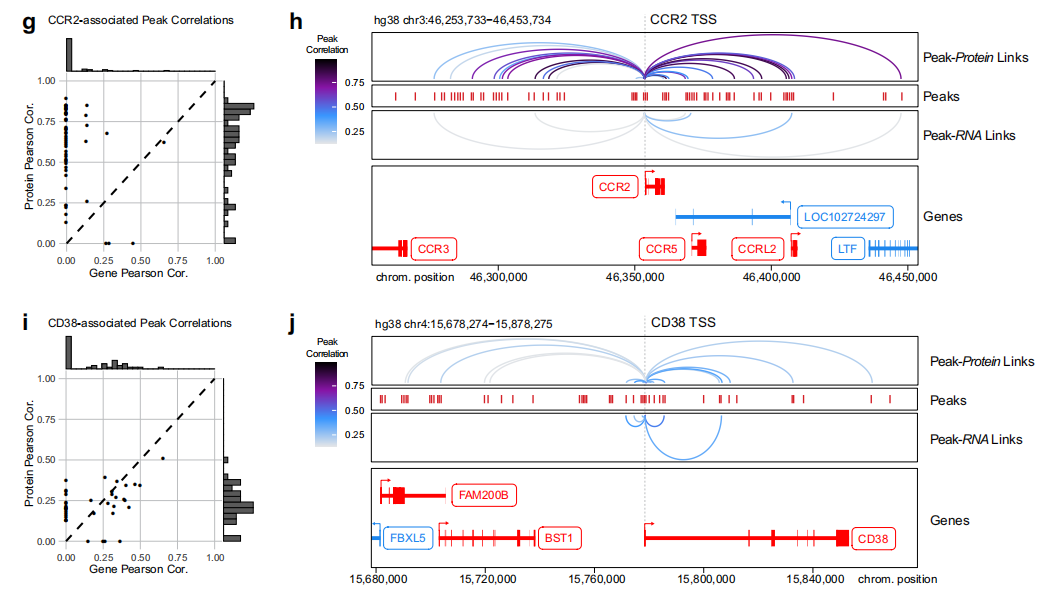
G.H.更敏感的蛋白質(zhì)豐度測量允許檢測許多附加的相關(guān)標準物質(zhì),例如CCR2/CD192.
I.J. 一種單核細胞上表達的趨化因子受體和CD38,一種表達于多種免疫細胞表面的糖蛋白.






