circSDHC-腎細胞癌的治療靶點
越來越多的證據表明,circRNAs在癌癥的發展和進展中發揮著重要的調控作用;然而,circRNAs在腎細胞癌(RCC)中的表達模式和生物學功能在很大程度上仍不清楚。小編今天給大家帶來發表于影響因子為15.302的雜志“Molecular Cancer”上的文章“Circular RNA circSDHC serves as a sponge for miR-127-3p to promote the proliferation and metastasis of renal cell carcinoma via the CDKN3/E2F1 axis”。

在本研究中,我們對GEO數據庫中已發表的circRNA芯片數據進行了生物信息學分析,確定circSDHC可能在RCC的發展和進展中起致癌作用。通過體外和體內實驗,我們證明circSDHC作為miRNA-127-3p的海綿,從而調控CDKN3/E2F1軸。因此,circSDHC是一個很有前景的RCC患者潛在的預后生物標志物和治療靶點。
技術路線
結果
1)RCC中致癌circRNA的發現和circSDHC的表征
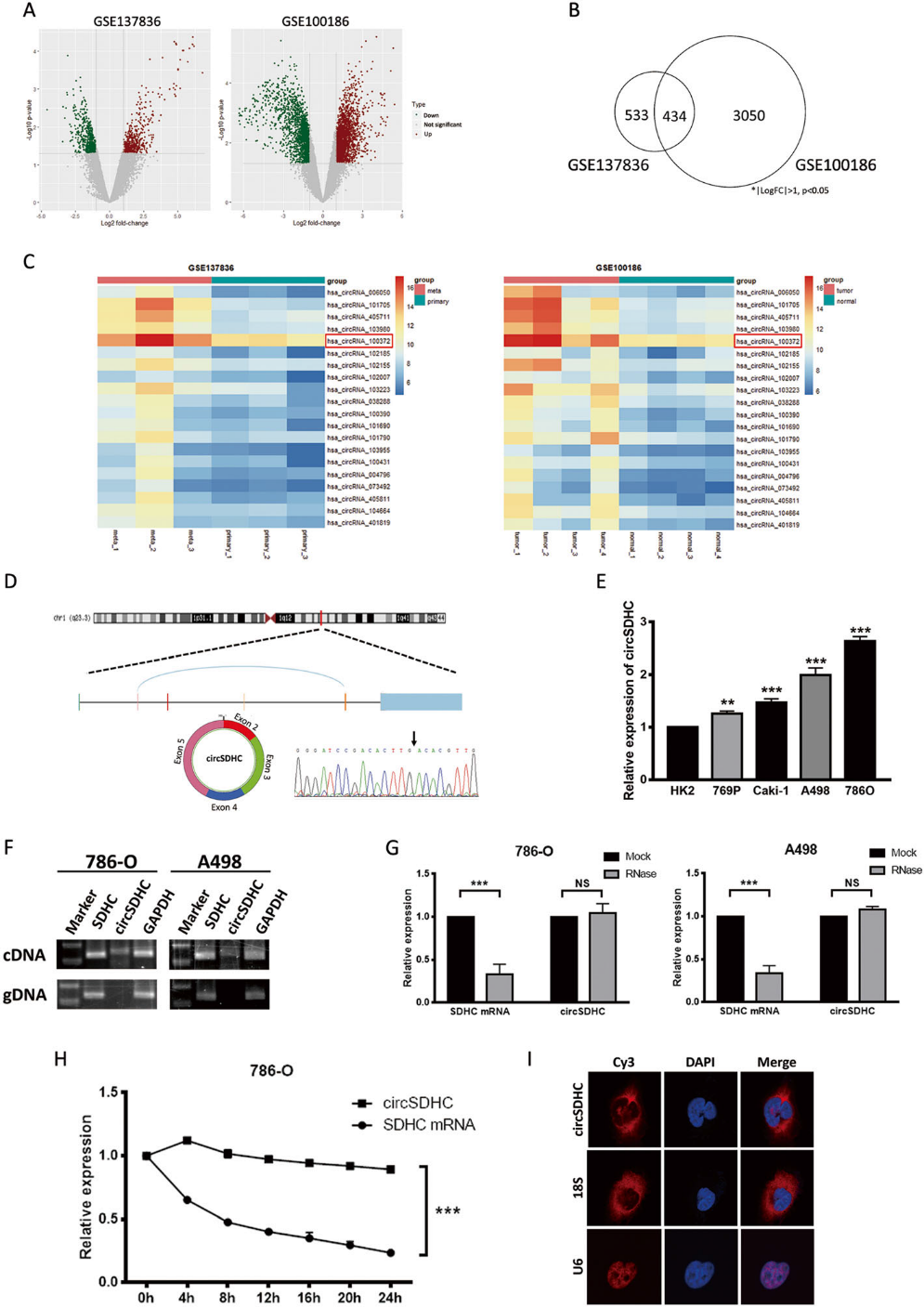
我們利用circRNA芯片分析人體組織樣本的兩個GEO數據集(GSE137836和GSE100186),研究了circRNA在RCC發展和進展中的作用。我們選擇了log2 foldchange > 1或<?1,p < 0.05的circRNA,如圖1a所示。我們提取了兩個數據集重疊的circRNA,這些circRNA代表了RCC中一致的調節模式,產生了434個circRNA子集(圖1b)。我們選擇了20個最顯著上調的circRNA,繪制了熱圖(圖1c)。相關分析表明,circSDHC表達與臨床病理參數TNM分期相關。此外,單因素和多因素Cox分析均表明,較高的circSDHC表達與不良生存結局相關。circSDHC來源于第1染色體上的SDHC基因,由外顯子2、3、4和5的反剪接產生(385 bp)。我們通過Sanger測序確認了circSDHC的反剪接連接(圖1d)。與正常腎上皮細胞系HK2相比,4個RCC細胞系(Caki-1, A498, 786-O, 769P)的circSDHC表達升高(圖1e)。PCR分析證實,不同的引物可以從cDNA中擴增circSDHC,但不能從gDNA中擴增(圖1f)。此外,circSDHC對RNase R處理更耐藥,而SDHC mRNA在此處理下顯著降解(圖1g)。CircSDHC的半衰期也比SDHC mRNA長,放線菌素D處理證實了這一點(圖1h)。此外,通過FISH實驗分析了circSDHC在786-O細胞中的亞細胞定位,表明大部分circSDHC定位于細胞質(圖1i)。
2)CircSDHC促進RCC增殖和侵襲性
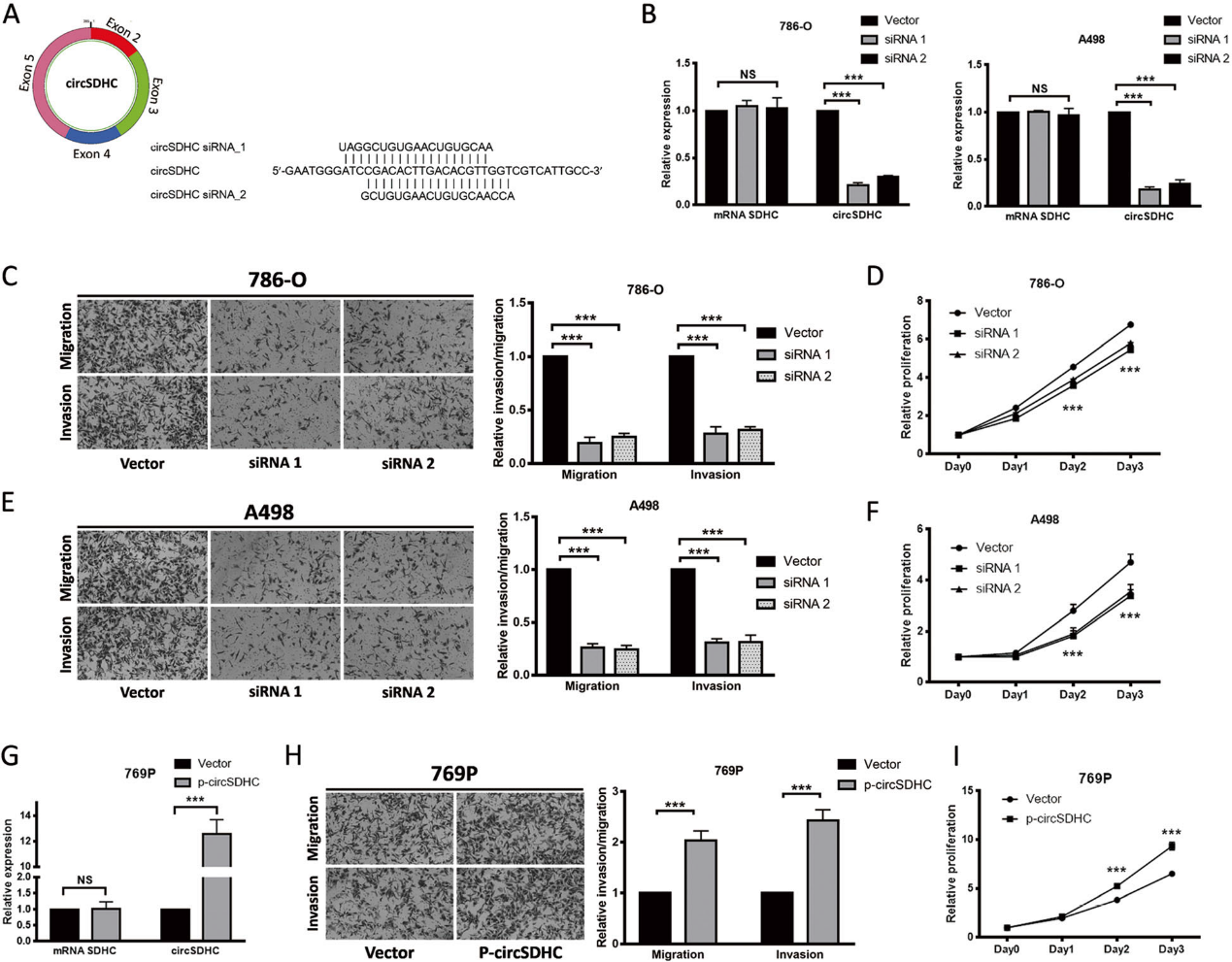
為了評估CircSDHC在RCC中的生物學作用,我們進行了功能測定。為了操縱circSDHC的表達,我們構建了針對反剪接連接的siRNA(圖2a)。在circSDHC水平最高的兩株RCC細胞系(786-O和A498)中,利用sirna成功敲低了circSDHC的表達,且不改變SDHC mRNA的線性表達(圖2b)。敲低circSDHC顯著減少了786-O和A498細胞遷移和入侵的能力 (圖2 c, e)。此外,敲除circSDHC后,這些細胞的增殖也受到抑制(圖2 d, f)。為了進一步研究其功能,我們構建了一個circSDHC過表達載體,該載體在另一個RCC細胞系769P中顯著上調了circSDHC的水平(圖2 g)。與敲除實驗結果一致的是,circSDHC過表達可增加769P細的遷移、侵襲和增殖率(圖2h, i)。
3)腫瘤抑制因子miR-127-3p是circSDHC在RCC中的一個靶點
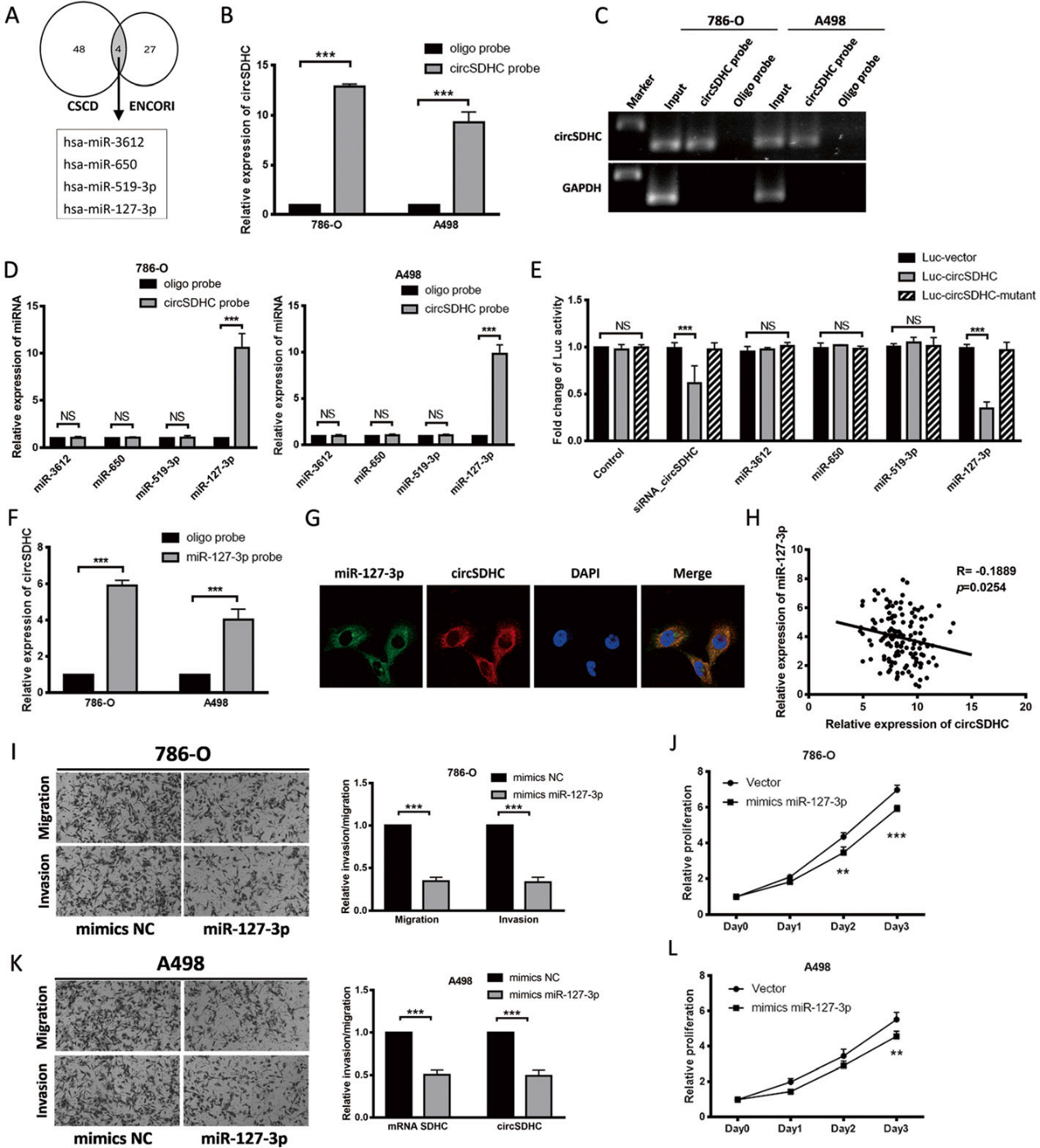
由于我們的數據表明circSDHC定位于細胞質,我們試圖確定它是否可以作為miRNA海綿。首先,我們利用兩個數據庫預測了可能受circSDHC調控的下游miRNAs。四個miRNAs,包括miR-3612、miR650、miR-519a-3p和miR-127-3p,在兩個數據庫中都被鑒定為circSDHC的潛在靶標(圖3a)。為了進一步評估circSDHC與miRNAs之間的關系,我們構建了生物素標記的circSDHC探針,qRT-PCR證實了該探針可以特異性下拉circSDHC(圖3b, c)。接下來,使用該探針下拉786-O和A498細胞中與circSDHC結合的miRNAs。隨后的qRT-PCR證實miR-127-3p可以在786-O和A498細胞中與circSDHC結合(圖3d)。接下來,我們進行了熒光素酶報告基因檢測,結果證實了之前的研究結果(圖3e)。此外,生物素標記的miR-127-3p比陰性對照探針捕獲的circSDHC更多(圖3f),在786-O細胞中的FISH分析顯示,circSDHC和miR-127-3p共定位于細胞質中(圖3g)。此外,我們對ccRCC患者數據的分析顯示,miR-127-3p與circSDHC呈負相關(圖3h)。這些結果表明,circSDHC可以與miR-127-3p結合,充當miR-127-3p的海綿。最后,在786-O和A498細胞中過表達miR-127-3p可降低攻擊性和增殖(圖3i-l)。
4)miR-127-3p通過下調CDKN3/E2F1軸抑制RCC進程
我們利用ENCORI數據庫確定miR-127-3p調控的靶基因和下游通路。Cyclin依賴性激酶抑制劑3 (CDKN3)被鑒定為miR-127-3p調控的潛在候選基因 (圖4a)。此外,我們進行了雙熒光素酶報告基因檢測,其中含有野生型CDKN3序列的載體與miR-127-3p模擬物共轉染,導致熒光素酶活性降低50%以上。相比之下,轉染含有突變CDKN3序列的載體對熒光素酶活性沒有影響(圖4b)。Western blot檢測證實了這一調控(圖4c)。這些結果表明,miR-127-3p可通過下調CDKN3抑制RCC進程。此外,RCC細胞中CDKN3基因敲除導致細胞增殖率降低,遷移和侵襲能力減弱(圖4d-g)。為了預測涉及CDKN3下游的通路,我們使用了基因集富集分析。結果表明E2F1是一個潛在的參與途徑(圖4h)。E2F1是一種有效的轉錄調控因子,參與多種不同類型癌癥的發展。GEPIA預測顯示CDKN3與E2F1水平呈正相關(圖4i),在786-O和A498細胞中CDKN3敲除后的western blot分析證實了這一關系(圖4 -k)。

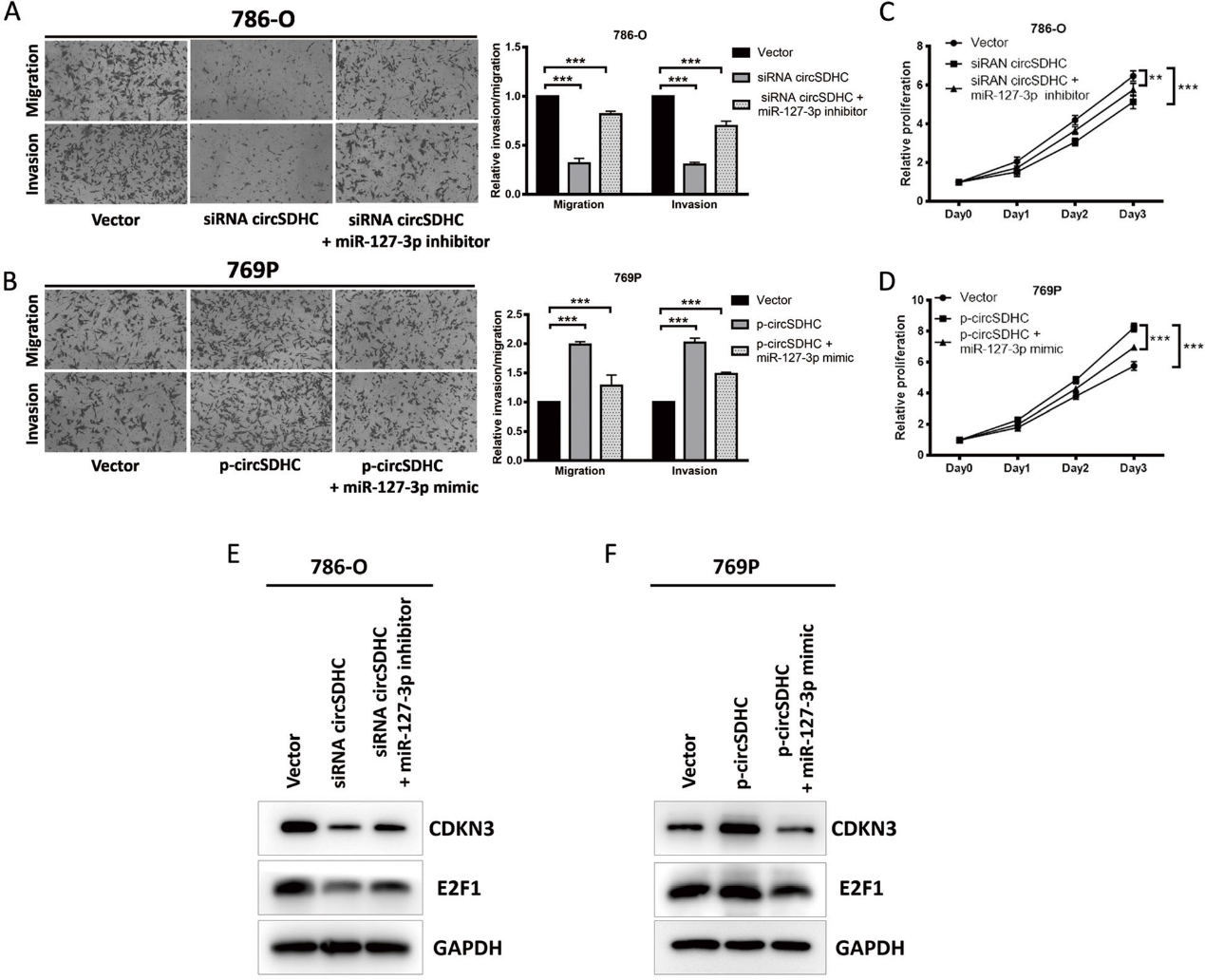
5)circSDHC作為miR-127-3p的海綿,調節CDKN3/E2F1,促進RCC進展
為了研究circSDHC是否通過對miR-127-3p的海綿作用促進RCC進展,我們使用miR-127-3p抑制劑和模擬物在circSDHC缺失或過表達后進行拯救實驗。敲低circSDHC抑制786-O細胞的侵襲和增殖;然而,miR- 127-3p抑制劑可以挽救這種抑制作用(圖5 a, c)。在過表達circSDHC的769P細胞中也觀察到類似的效果,這些細胞表現出更強的攻擊性和增殖能力,而miR-127-3p mimic可減弱這些能力(圖5 b, d)。Western blot檢測結果也與觀察到的功能變化一致,轉染circSDHC siRNA后,CDKN3和E2F1通路被激活較少,而miR-127-3p抑制劑可以挽救這一過程(圖5e)。相比之下,轉染circSDHC過表達載體可激活CDKN3/E2F1通路,而在769P細胞中引入miR127-3p mimic可降低這一效應(圖5f)。
6)敲除circSDHC可抑制RCC的體內腫瘤進展
為了評估circSDHC在體內的致癌作用,在786-O細胞中穩定轉染靶向circSDHC的shRNA(圖6a)。注射circSDHC敲低癌細胞的小鼠比對照組表現出更少的惡病質,表現為小鼠體重的變化(圖6b)。8周后對實驗組和對照組小鼠實施安樂死,收集肺組織。注射了circSDHC敲除癌細胞的小鼠肺的轉移灶比對照組少(圖6c)。皮下腫瘤形成評估表明,circSDHC敲除組的總體平均腫瘤體積(圖6d)和腫瘤重量(圖6e)明顯低于對照組。對這些皮下腫瘤的免疫組化分析顯示,circSDHC敲低組CDKN3和E2F1表達水平降低(圖6f),兩組間CDKN3和E2F1的免疫組化評分顯著(圖6g)。這些結果表明,敲除circSDHC可在體內抑制RCC腫瘤進展。

結論
綜上所述,circSDHC在ccRCC中過表達,且其過表達與低存活率相關。此外,circSDHC通過充當miR-127-3p的海綿,促進ccRCC的進展和轉移。miR-127-3p是一種腫瘤抑制因子,可下調CDKN3/E2F1軸的活性。






