外泌體miR92a-3p-肝癌治療的靶點
外泌體在肝細胞癌(HCC)的細胞間通訊和轉移過程中起著重要作用。然而,不同轉移潛能的異質性肝癌細胞之間的細胞通訊以及由此導致的癌癥進展在HCC中尚不完全清楚。今天小編為大家介紹發表于影響因子為7.97的“Oncogene”上的文章“High-metastatic cancer cells derived exosomal miR92a-3p promotes epithelial-mesenchymal transition and metastasis of low-metastatic cancer cells by regulating PTEN/Akt pathway in hepatocellular carcinoma”,帶大家了解這其中的奧秘。

在本文研究中,我們通過對具有不同轉移潛能的肝癌細胞(MHCC-97H和97hm)進行外泌體miRNA測序,確定了miR-92a-3p為肝癌進展的潛在標志物。外源性miR-92a-3p通過靶向PTEN并調節其下游Akt/Snail信號,促進受體癌細胞上皮間充質轉化(EMT)。此外,通過對不同轉移潛能的肝癌細胞的mRNA測序,預測miR92a-3p的潛在轉錄因子,發現轉錄因子E2F1和c-Myc通過直接結合其宿主基因miR17HG的啟動子促進細胞和外泌體miR-92a-3p的表達。最后臨床資料顯示,高血漿miR92a-3p水平與肝癌患者總生存率和無病生存率相關,提示HCC患者預后不良。
技術路線:

結果:
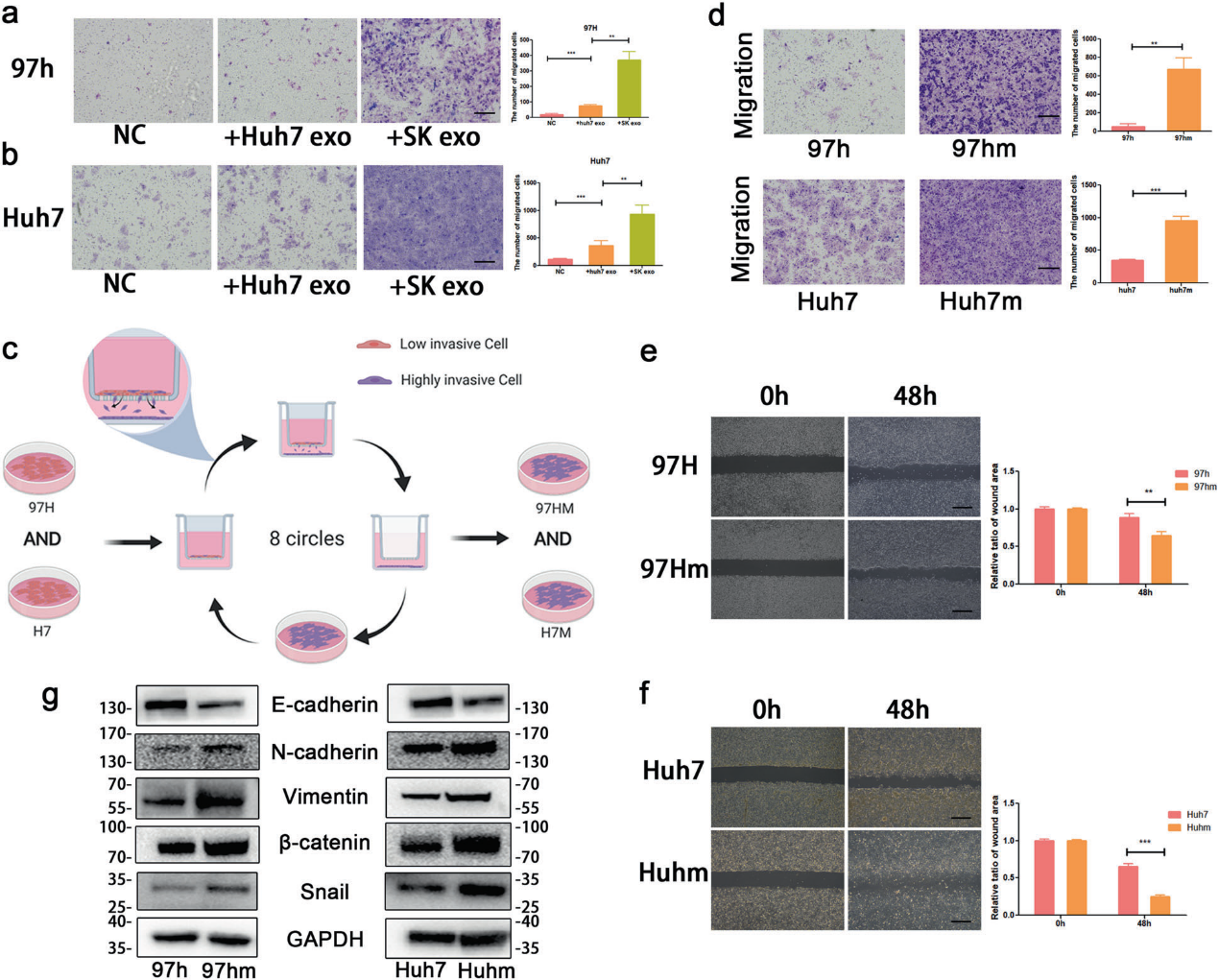
1)高轉移能力肝癌細胞系(97hm和Huh7)的構建
異質性普遍存在于癌癥的許多方面,包括增殖、轉移和耐藥性。首先,為了確定肝癌細胞的轉移異質性,用遷移實驗檢測了5種肝癌細胞的遷移能力,確定了Huh7和SK-Hep-1肝癌細胞具有較強的遷移能力。為了確定EVs是否能將轉移的優點傳遞給癌細胞,我們分離了Huh7和SK細胞來源的外泌體,并分別用于治療97h和Huh7細胞。用外泌體處理的細胞,尤其是高轉移癌細胞,遷移比陰性對照細胞更具侵略性(圖1a,b)接著,通過對97 h和Huh7細胞持續施加選擇性進化壓力,從原代細胞中獲得高轉移性肝癌細胞(97 hm和Huhm)(圖1c)。與親代細胞相比,97hm和Huhm的遷移能力顯著增強(圖1d-f)。從western blot的結果來看,高轉移性肝癌細胞(97hm和Huhm)的間充質相關蛋白(N-鈣粘蛋白、波形蛋白、β-連環蛋白和Snail)的表達高于其親代低轉移肝癌細胞(97h和Huh7)(圖1g)。
2)miR92a-3p促進肝癌的侵襲性和惡性程度
miR92a-3p促進肝癌的體內外轉移。然而,miR92a-3p在肝癌中的確切作用尚不清楚。我們發現當miR92a-3p下調時,腫瘤生長和進展在體內被顯著抑制(圖4a-c)。此外,上調miR92a-3p促進了97h和Huh7細胞的遷移和侵襲能力(圖4d,e)。增加細胞活動性是腫瘤侵襲的基本步驟,伴隨著細胞骨架的調節。在肝癌細胞中,miR92a-3p過表達組中觀察到更多的微管和微絲(圖4f)。然后,為了確定miR-92a-3p在肝癌演變中的作用,我們轉染miR-92a-3p抑制劑降低miR-92a-3p的表達(圖4k)。如圖4g所示,97hm和Huhm比97h和Huh7細胞具有更高的遷移和侵襲能力,并且增強的轉移能力由于97hm和Huhm細胞中miR-92a-3p的下調而降低(圖4g)。接下來,我們想探討miR92a-3p是否影響肝癌的體內轉移。為了達到這個目的,我們用高轉移性肝癌細胞系(97hm)構建肝轉移模型。同時,經尾靜脈注射抗miR92a-3p抗原。我們的結果顯示miR92a-3p的下調抑制了HCC的轉移(圖4h-j)。
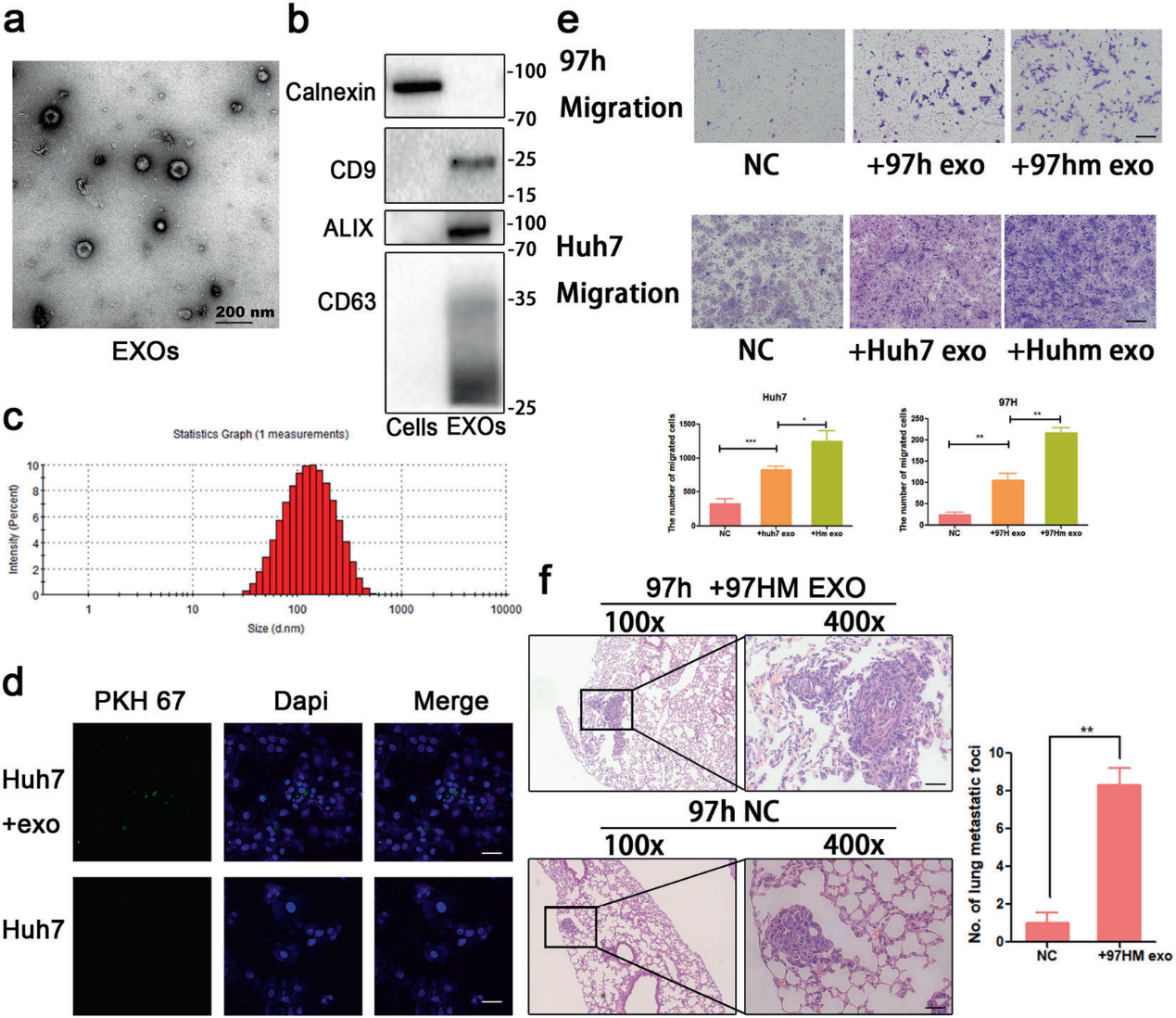
3)在高轉移性肝癌的外泌體中檢測到高水平的miR-92a-3p
為了確定外泌體中哪些RNA作為主要的惡性信息,我們對來自97h細胞及其進化的97hm細胞的外泌體RNA樣品進行miRNA測序。結果表明,與97h外泌體相比,97hm外泌體中627個miRNA上調。圖3a描繪了差異表達最多的miRNA的熱圖。其中,miR92a-3p是差異表達最豐富的miRNA(圖3b)。此外,通過qRT-PCR,我們發現兩個高轉移性肝癌細胞系(97hm和Huhm)中細胞和外泌體miR92a-3p水平高于兩個“正常”HCC細胞系(97h和Huh7)(圖3d)。與陰性對照組相比,97h和Huh7細胞的miR92a-3p表達顯著增加(圖3e)。
為了確定這些miRNAs作為預后標志物的潛在作用,我們檢測了這些miRNA在HCC患者血漿外泌體中的表達。HCC患者源性異種移植(PDX)小鼠模型的血漿外泌體miR92a-3p顯著高于正常小鼠(圖3f-h)。接下來,為了闡明miR92a-3p在轉移中的潛在作用,建立了三種肝癌小鼠模型:第1組;陰性對照組,第2組;皮下HCC異種移植(無肺轉移)和第3組;原位HCC異種移植(有肺轉移)(圖3i,j)。與第1組相比,皮下肝癌小鼠血漿中的外泌體miR92a-3p略有增加,而轉移瘤小鼠(第3組)血漿中miR92a-3p顯著增加(圖3k)。這些結果表明,在體外和體內,miR92-3p的表達隨著肝癌的發展而增加,因此,miR92a-3p可能是肝癌進展的有效標志。

4)miR92a-3p促進肝癌的侵襲性和惡性程度
miR92a-3p促進肝癌的體內外轉移。然而,miR92a-3p在肝癌中的確切作用尚不清楚。我們發現當miR92a-3p下調時,腫瘤生長和進展在體內被顯著抑制(圖4a-c)。此外,上調miR92a-3p促進了97h和Huh7細胞的遷移和侵襲能力(圖4d,e)。增加細胞活動性是腫瘤侵襲的基本步驟,伴隨著細胞骨架的調節。在肝癌細胞中,miR92a-3p過表達組中觀察到更多的微管和微絲(圖4f)。然后,為了確定miR-92a-3p在肝癌演變中的作用,我們轉染miR-92a-3p抑制劑降低miR-92a-3p的表達(圖4k)。如圖4g所示,97hm和Huhm比97h和Huh7細胞具有更高的遷移和侵襲能力,并且增強的轉移能力由于97hm和Huhm細胞中miR-92a-3p的下調而降低(圖4g)。接下來,我們想探討miR92a-3p是否影響肝癌的體內轉移。為了達到這個目的,我們用高轉移性肝癌細胞系(97hm)構建肝轉移模型。同時,經尾靜脈注射抗miR92a-3p抗原。我們的結果顯示miR92a-3p的下調抑制了HCC的轉移(圖4h-j)。

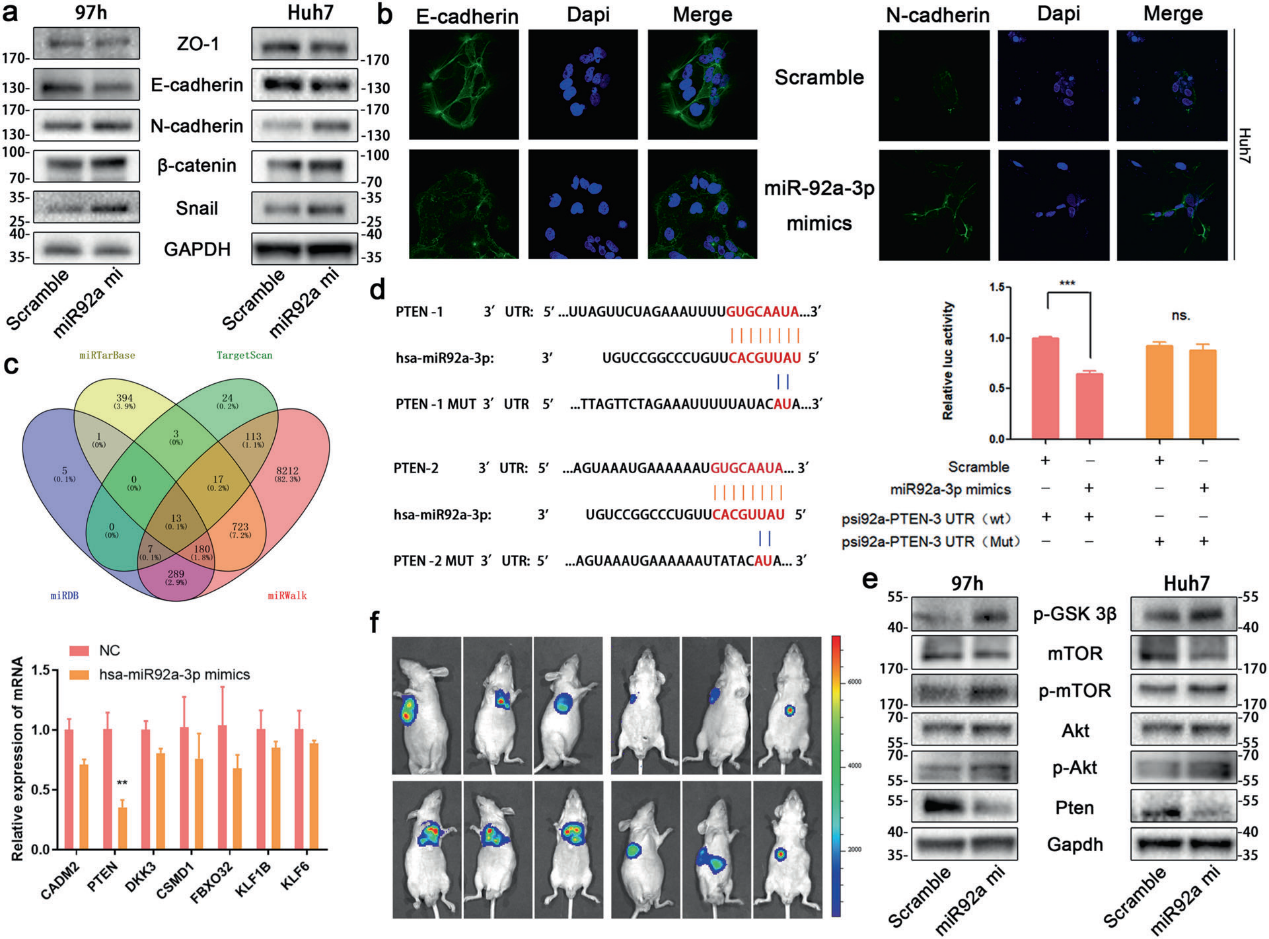
5)miR92a-3p通過靶向PTEN調節Akt/Snail途徑促進EMT
腫瘤轉移的發生與癌細胞內的EMT密切相關。我們想探討miR92a-3p是否參與了肝癌EMT的調控。正如預期的那樣,miR92a-3p的過表達增加了間充質生物標記物(N-cadherin、β-catenin、Snail)的表達,同時降低了E-cadherin的蛋白質水平(圖5a,b)。為了確定miR92a-3p的靶點,利用miRDB、miRWalk、TargetScan和miRTarBase四個數據庫對miR92a-3p的潛在靶點進行預測,并用qRT-PCR進行驗證,PTEN下降最明顯(圖5c)。western blot檢測發現PTEN蛋白的表達在miR92a-3p過表達后顯著降低。因此,可以推斷miR-92-3p下調了肝癌中PTEN的表達。然后,我們構建了含有3’-UTRd的PTEN mRNA的雙熒光素酶報告質粒系統(圖5d)。結果顯示miR92a-3p直接與PTEN 3’UTR相互作用,降低PTEN的表達(圖5d)。通過Western blot,我們發現miR92a-3p抑制PTEN的表達,然后上調磷酸化Akt、磷酸化mTOR和磷酸化GSK-3β(圖5e)。最后,我們發現AntigomiR-92a-3p減少了由外泌體引起的肝癌轉移(圖5f)。
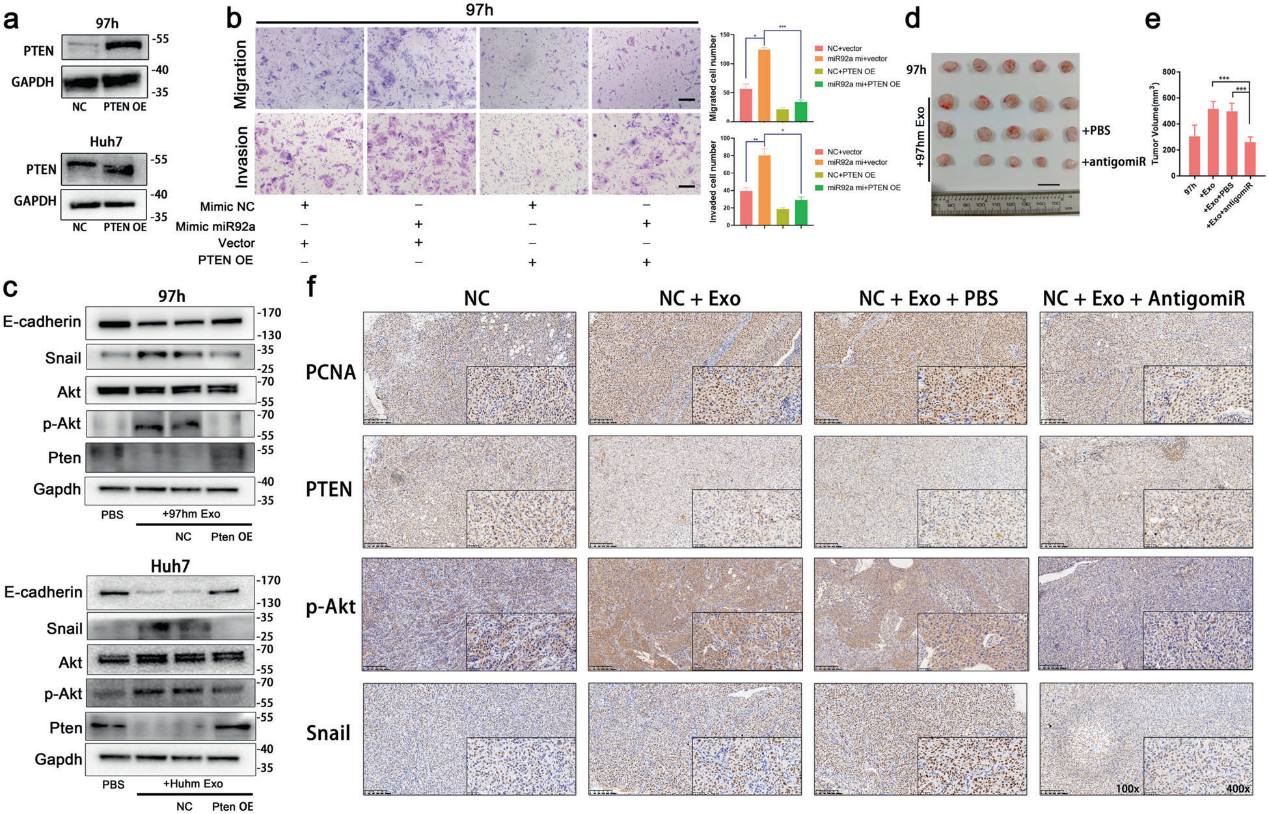
6)miR92a-3p抑制和PTEN過表達可中和高轉移性HCC源性外泌體介導的EMT
我們發現一旦PTEN被質粒過表達(圖6a),miR92a-3p過表達引起的HCC中增強的遷移和侵襲能力會恢復到正常水平(圖6b)。western blot結果顯示,體外轉染PTEN高表達質粒后,PTEN和Ecadherin的下調和磷酸化Akt和Snail的上調恢復到基礎水平(圖6c)。其次,為了闡明miR-92a3p在體內是否影響PTEN/Akt通路,采用皮下腫瘤異種移植模型。結果表明97hm外泌體治療促進腫瘤生長,這種促進作用被AntigomiR-92a-3p的治療中和(圖6d,e)。免疫組化結果顯示在高轉移性肝癌源性外泌體治療后,PTEN表達降低,磷酸化Akt和Snail蛋白水平上調。然而,一旦腫瘤移植物中的miR92a-3p被antigomiR92a-3p中和,PTEN、p-Akt和Snail水平則在體內恢復到基礎水平(圖6f)。提示miR92a-3p通過調節PTEN/Akt通路促進EMT,在HCC的轉移中起重要作用。
7)轉錄因子E2F1和c-Myc促進miR-92a-3p的表達
為了確定可能導致miR92a-3p上調的TFs,在97h細胞和97hm細胞之間進行mRNA測序(圖7a)。結合mRNA測序結果與JASPAR數據庫,發現37個候選基因可能直接促進miR92a-3p的表達(圖7b)。經GSEA分析后,發現與97h細胞相比,在97hm細胞中E2F1和c-Myc相關的途徑顯著富集(圖7c)。此外,與97H和Huh7相比,97H和Huhm中這兩種TFs的mRNA和蛋白質表達也增加(圖7d,e)。E2F1和c-Myc的過表達促進了肝癌細胞中miR17-92簇中miR92a-3p和其他成員的表達(圖7f,g)。為了驗證miR-92a-3p的宿主基因miR17HG啟動子中c-Myc結合位點(cbs)和E2F1結合位點(EBSs),我們進行了染色質免疫沉淀(ChIP)分析。如圖7h所示,有三個cbs和兩個ebs;CBS1和EBS1通過Southern blot試驗進一步證實(圖7i)。然后,我們構建miR92啟動子熒光素酶報告質粒系統,并與E2F1和c-Myc高表達質粒共轉染97h細胞。轉染后檢測熒光素酶活性。如圖7j所示,E2F1和c-Myc都能激活miR92a-3p的表達,說明E2F1和c-Myc直接結合miR17HG的特異性DNA序列,促進miR92a-3p在肝癌細胞中的表達。

8)miR-92a-3p水平與HCC肺轉移和腫瘤進展相關
為探討miR92a-3p在HCC患者中的作用,采用原位雜交技術檢測miR92a3p在肝癌組織及癌周組織中的表達。如圖8a所示,與癌周組織相比,在肝癌組織中miR92a-3p升高,這與來自GEPIA數據庫的數據一致(圖8b)。更重要的是,與無血管侵犯的肝癌組織相比,有血管侵犯的肝癌組織中miR-92a-3p水平更高(圖8a)。其次,我們檢測了42例HCC患者(21例無轉移,21例有轉移)血漿中miR-92a-3p的表達。有轉移的肝癌患者血漿中miR-92a-3p的水平顯著高于無轉移的HCC患者(圖8c)。為了進一步了解miR92a-3p表達與疾病進展之間的關系,我們收集了原發性肝癌患者術前和術后血漿樣本,并用其檢測外泌體miR92a-3p的表達。如圖8d所示,通過手術切除腫瘤后,外泌體miR92a-3p水平降低。根據血漿miR92a-3p的水平將肝癌患者分為兩組(miR92a-3p高表達組和miR92a-3p低表達組),miR92a-3p高表達與總生存率低、無病生存率差相關,提示HCC患者預后差(圖8e)。此外,無轉移的肝癌患者與有轉移的肝癌患者相比,外泌體miR92a-3p的AUCROC為0.8534(圖8f)。綜上所述,miR-92a-3p在高轉移能力的肝癌細胞和有轉移的肝癌患者中過表達。HCC來源的外泌體miR-92a-3p通過介導PTEN的降低和激活Akt/Snail信號通路來促進EMT和HCC的轉移,將“正常”的HCC細胞轉化為更具侵襲性的HCC細胞(圖8g)。

結論:肝源外泌體miR92a-3p通過抑制PTEN和激活Akt/Snail信號通路,在EMT進展和促進轉移過程中發揮關鍵作用。外泌體miR92a-3p是一種潛在的預測HCC轉移的生物標志物。這一認識可能會促進針對肝癌轉移的新的治療和預防策略的發展。






