不同尋常的思路——miR455-3p聯合m6A修飾發高分
已經知道熱休克轉錄因子1(HSF1)過表達會促進谷氨酰胺分解并激活結直腸癌(CRC)中的mTOR。然而,HSF1的癌癥特異性過表達的機制仍不清楚。本文在此背景下對該機制進行了解答,發現了β-catenin抑制miR455-3p表達隨后刺激HSF1 mRNA的m6A修飾并促進其在結直腸癌中的翻譯過程。本文于2020年8月24發表在《Molecular Cancer》IF:15.302雜志上。

研究結果:
1、β-catenin在CRC中激活HSF1
為了探究HSF1的潛在調控,篩選了具有敲除HSF1后類似效果的藥物,如圖1A所示,其中有文獻報道pyrvinium可以抑制HSF表達達到類似敲除的效果。此外,WNT/β-catenin信號通路特征與HSF1正相關(圖1B)。事實證明,pyrvinium減弱了HSF1結合驅動的熒光素酶的活性,并降低了已知由HSF1靶向調控的基因的表達和結合,如HSP90AA1, HSPA4,HSPB1, and HSPH1 (圖1D和E)。與pyrvinium一致,敲除β-catenin降低了HSF1的活性和其靶向的基因的表達,以及減弱HSF1與靶基因的結合能力(圖1F, G, I)。在結直腸癌細胞系RKO中,β-catenin表達水平較低,且GSK3抑制劑LiCl可以上調HSF1靶基因表達(圖1h)。
為了探討HSF1激活與β-catenin信號通路的生物學相關性,分析了LiCl處理前后野生型小鼠胚胎成纖維細胞(WT MEF)和HSF1敲除MEF (HSF1 KO MEF)的基因表達(NCBI GEO: GSE151119)。LiCl處理的HSF1 KO MEF中只有750個基因上調,而LiCl處理后WT MEF中有1435個基因顯著上調(圖1j)。其中,有875個基因表現出對HSF1的依賴,一旦HSF1缺失,LiCl處理后其表達水平沒有上調(圖1k)。事實上,它們的表達水平與先前報道的HSF1的表達水平有高度相關性(圖1l)。綜上所述,這些結果表明,β-catenin可以正向調控HSF1。
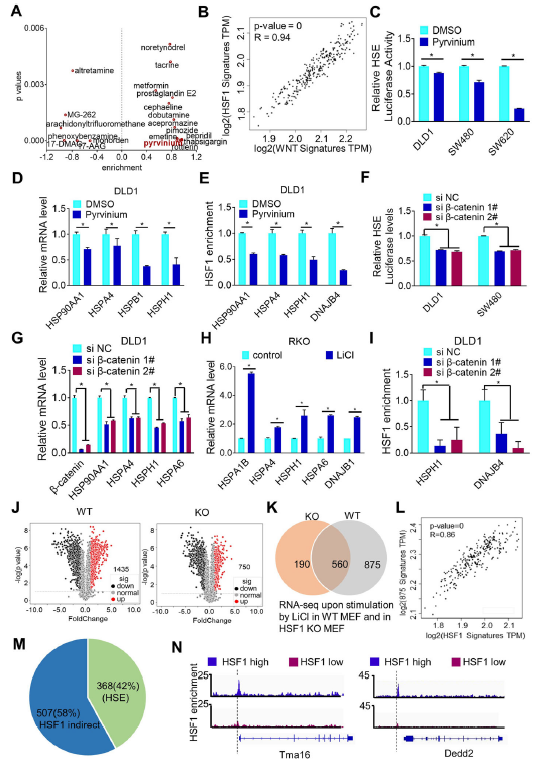
圖1 WNT/β-catenin信號通路激活HSF1
2、β-catenin促進HSF1蛋白的翻譯
如圖2a和b所示,pyrvinium and β-catenin敲除均降低了HSF1蛋白水平。相反,外源性的過表達β-catenin增加了HSF1蛋白水平(圖2c)。此外,在RKO和MEF細胞中,LiCl處理激活WNT/ catenin信號后,HSF1蛋白水平均升高(圖2d)。HSF1的表達與原代組織中的β-catenin表達有很好的相關性(圖2e和f)。這些數據表明,β-catenin上調HSF1蛋白表達。嘌呤霉素標記法監測新生HSF1蛋白的合成,結果顯示缺失降低了HSF1的嘌呤霉素標記(圖2g),蔗糖梯度離心法的結果顯示β-catenin缺失顯著減少了多聚體部分HSF1 mRNA的存在,但增加了非翻譯核糖體部分(圖2h)。綜上所述,β-catenin是通過刺激HSF1蛋白翻譯上調HSF1表達。
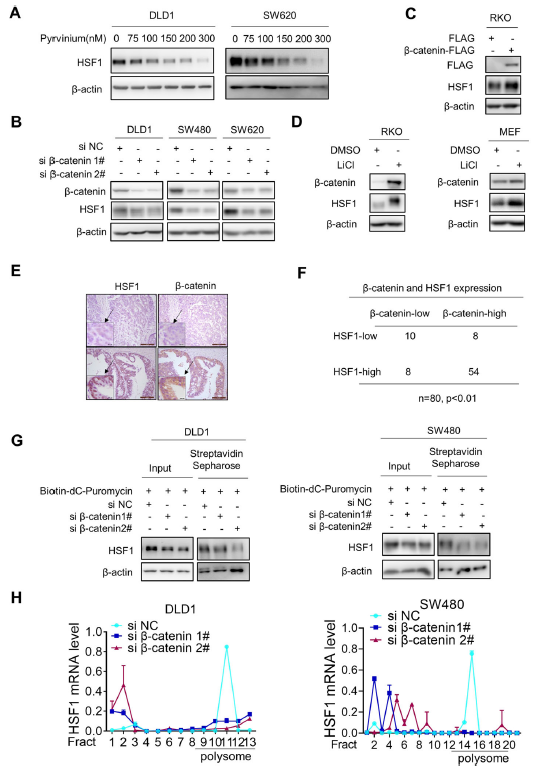
圖2 β-catenin促進HSF1蛋白的翻譯
3、HSF1蛋白翻譯受miR455-3p調控
數據庫分析挖掘到兩個潛在的可以與HSF1結合的miRNA,miR455-3p和miR214-5p(圖3A)。此外,它兩都可以降低HSF1的蛋白表達,更重要的是,miR455-3p的抑制劑而不是miR214-5p挽救了由β-catenin敲低引起的HSF1蛋白的下調(圖3B-C)。一致的,miR455-3p抑制了HSF1驅動的熒光素酶活性,并且HSF1在miR455-3p標記的探針中顯著富集,提示兩者之間的結合關系(圖3D-E)。miR455-3p在腫瘤中下調表達,其表達與HSF1呈負相關(圖3F-G)。此外,miR455-3p過表達抑制了CRC細胞的增殖,促進其凋亡(圖3H-J)總之,上述結果表明miR455-3p靶向HSF1 mRNA 3 ' -UTR抑制其翻譯。
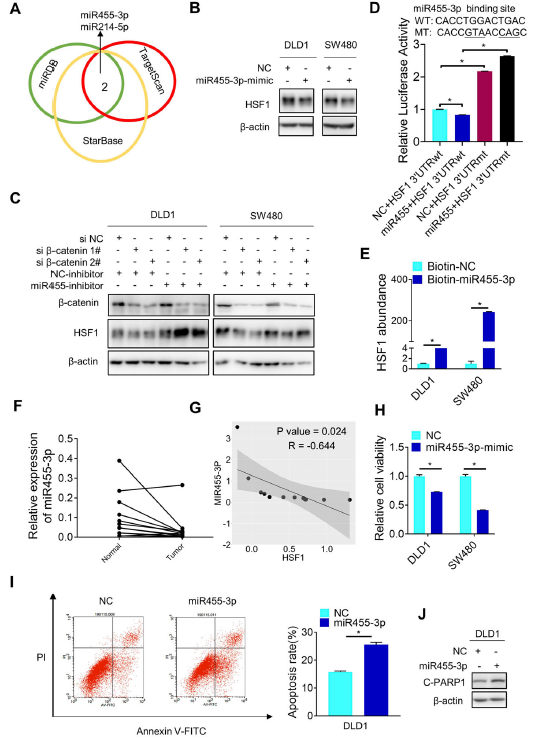
圖3 HSF1蛋白翻譯受miR455-3p調控
4、HSF1 mRNA m6A修飾刺激其蛋白翻譯
除microRNA外,mRNA修飾(例如N6-甲基腺苷(m6A))在HSF1翻譯調控中也起著重要作用。作者注意到HSF1 mRNA 3'-UTR中miR455-3p種子序列的匹配位點包含m6A修飾的典型基序(圖4a),這得到了生物信息學分析的支持(圖4b)。meRIP后的PCR分析(m6A RNA免疫沉淀)進一步證實了m6A修飾的HSF1 mRNA(圖4c)。更重要的是,在HSF1 mRNA 3 -UTR突變體不能結合miR455-3p,但保留了m6A修飾位點DRACH的載體的熒光素酶活性均高于野生型 (圖3d),說明METTL3也與HSF1 mRNA結,并且m6A修飾對HSF1表達很重要性。抑制METTL3,HSF1 mRNA的m6A修飾就會減少,HSF1 mRNA m6A修飾的這種減少降低了HSF1蛋白的表達和新生的HSF1蛋白的合成(圖4e-g)。此外,METTL3耗竭顯著減少了多核糖體部分中HSF1 mRNA的存在,但在非翻譯核糖體部分中增加了(圖4h),而HSF1 mRNA或HSF1蛋白的穩定性沒有改變。YTHDF1是HSF1 m6A修飾的讀取蛋白,隨著YTHDF1的敲低,HSF1蛋白降低,(圖4i)。綜上所述,HSF1 mRNA的m6A修飾與刺激其翻譯有關。
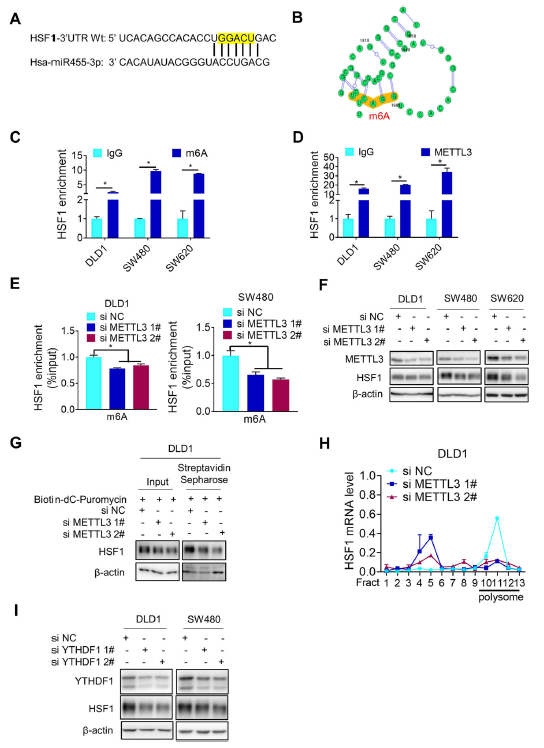
圖4 HSF1 mRNA m6A修飾刺激其蛋白翻譯
5、β-catenin抑制miR455-3p從而增加HSF1 mRNA的m6A修飾
隨后,作者探究了miR455-3p與HSF1 mRNA m6A修飾的相互作用,野生型miR455-3p的過表達降低了HSF1 mRNA m6A修飾及其與METTL3的結合,但miR455-3p突變體不能與HSF1 mRNA結合(圖5a)。METTL3缺失不僅降低了m6A對HSF1 mRNA的修飾(圖4e),而且增強了miR455-3p與HSF1 mRNA的相互作用(圖5b),這些結果表明miR455-3p可能與METTL3競爭HSF1 mRNA的m6A修飾,從而抑制HSF1蛋白的翻譯。
miR455-3p抑制劑挽救了由β-catenin缺失引起的HSF1 mRNA m6A修飾的減少,同時METTL3與HSF1 mRNA的相互作用也因β-catenin缺失而廢除,伴隨的是miR455-3p與HSF1 mRNA的相互作用增強,以及成熟前體和初級miR455-3p表達上調(圖5C-F)。相比之下,當過表達或LiCl處理上調后,成熟miR455-3p和初級miR455-3p均下調(圖5F-G)。
初級miR455-3p來源于COL27A1內含子10中編碼的一個pre-miRNA發夾結構,并且COL27A1的表達與miR455-3p的表達顯著正相關(圖5h)。敲除β-catenin后COL27A1的表達顯著上調,此外β-catenin/TCF7L2復合物可以與COL27A1的啟動子相互作用,同時β-catenin的表達與COL27A1呈負相關(圖I-K)。因此,β-catenin通過抑制miR455-3p的表達,促進HSF1 mRNA由miR455-3p結合向m6A修飾的轉變,最終促進HSF1蛋白的翻譯。
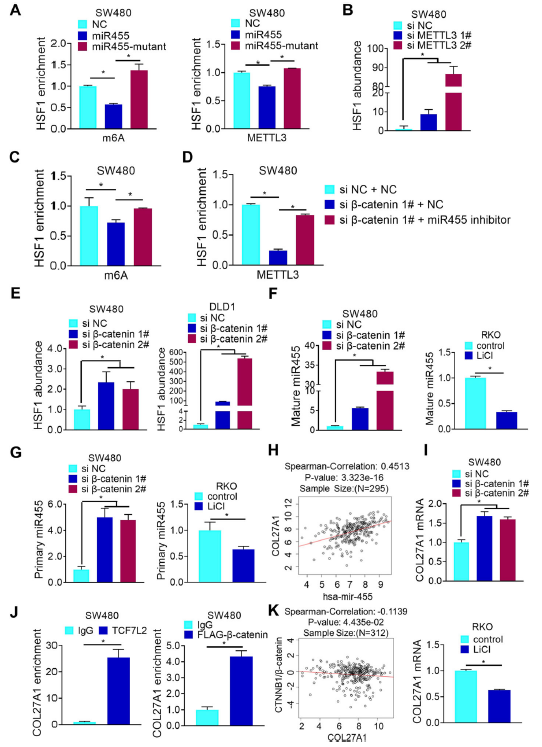
圖5 β-catenin抑制miR455-3p從而增加HSF1 mRNA的m6A修飾
6、HSF1基因和化學抑制均可減輕小鼠的結直腸癌
根據體外研究結果,鑒于小鼠中miR455-3p和HSF1 mRNA的相互作用似乎是非常保守的(小鼠miR455-3p種子序列:CAGUCCA;小鼠HSF1 mRNA 3'-UTR中的結合位點:tggactg),進一步探討了HSF1在Apcmin / +和Apcmin / + 和HSF1 +/-小鼠結直腸癌發生的作用。與正常C57BL / 6相比,Apcmin / +小鼠腸道組織中HSF1及其下游靶標GLS1的表達增加,而miR455-3p的表達減少(圖6a和b)。用高脂飲食喂養3個月后,這些Apcmin / +小鼠的腸內出現了多個腫瘤(圖6c)。然而,用HSF1的化學抑制劑KNK437處理的Apcmin / +小鼠中和和Apcmin / + HSF1 +/-的小鼠腫瘤大小和數量均顯著減少(圖6d),同時伴隨著HSF1靶點的表達下調(圖6e)。這些結果證實,HSF1是WNT /β-catenin信號傳導的新型下游靶標,對促進CRC的發展具有重要意義。

圖6 通過激活Wnt信號通路,基因和化學抑制HSF1均可減少結直腸癌的發生
總之,本文揭示:當Wnt /β-catenin失活時,miR455-3p(miR455HG)的宿主基因COL27A1的轉錄增加,從而產生更多的miR455-3p來占據HSF1 mRNA 3'-UTR并阻止其受METTL3介導 m6A修飾,因此抑制了HSF1翻譯。相反,在Wnt /β-catenin激活后,miR455-3p的生成受到抑制,因此HSF1 mRNA可用于METTL3結合和m6A修飾,最終刺激HSF1翻譯以促進結直腸癌發生(圖6F)。
參考文獻:
Song Ping., Feng Lifeng., Li Jiaqiu., Dai Dongjun., Zhu Liyuan., Wang Chaoqun., Li Jingyi., Li Ling., Zhou Qiyin., Shi Rongkai., Wang Xian., Jin Hongchuan.(2020). β-catenin represses miR455-3p to stimulate m6A modification of HSF1 mRNA and promote its translation in colorectal cancer. Mol. Cancer, 19(1), 129. doi:10.1186/s12943-020-01244-z






