microRNA的一種非典型分子機制——維持血管完整性
MicroRNAs (miRNAs)是多種基因表達的調控因子,對包括動脈粥樣硬化在內的人類疾病有著深遠的影響,但它們是否能夠發揮翻譯后功能來控制細胞適應,以及這些非典型特征是否具有病理生理相關性尚不清楚。近期,來自慕尼黑大學心血管預防研究所的Donato Santovito團隊發表在Science Translational Medicin上的研究證明miR- 126-5p在高剪切應力和自噬環境下維持內皮完整性。在自噬小泡表面,miR-126-5p結合argonaute-2 (Ago2)后與Mex3a形成復合物,被引導轉運至細胞核。在細胞核中,miR-126-5p與Ago2分離,并通過其種子序列與caspase-3結合,阻止caspase二聚并抑制其活性,從而限制細胞凋亡。

技術路線:
研究結果:
1.高剪切應力(HSS)和自噬促進細胞核miR-126-5p的富集
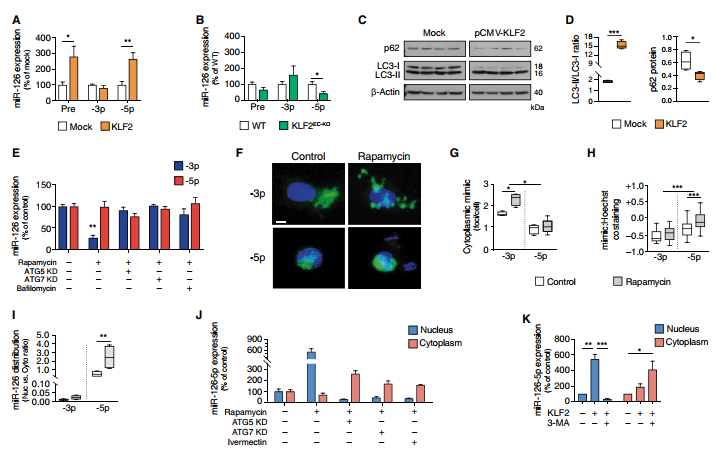
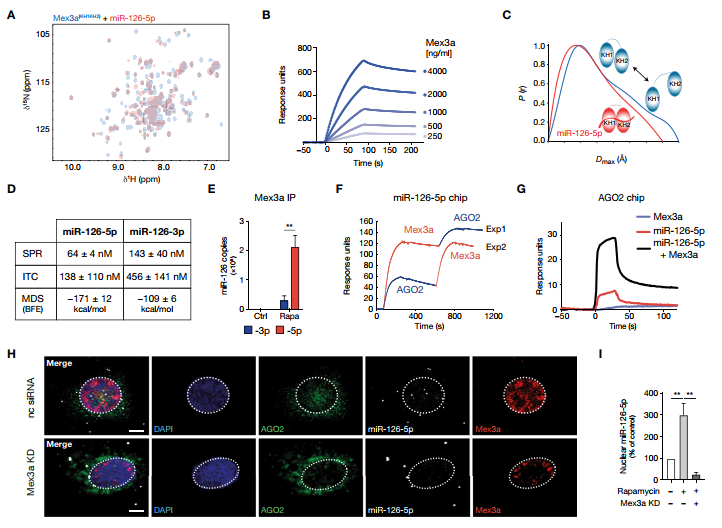
在人臍靜脈內皮細胞(HUVEC)中過表達KLF2(KLF2在動脈內皮細胞中協調大部分由剪切應力誘發的轉錄程序),顯示出pre-miR-126和miR-126-5p表達量增加(圖1A)。在具有EC特異性Klf2缺失的Cdh5CreKlf2fl / fl小鼠的主動脈內膜中檢測到了較低的miR-126-5p(圖1B)。 KLF2過表達和HSS(12 dyne/cm2)增加自噬相關基因(ATG)的轉錄并促進自噬通量,通過蛋白質而不是轉錄本水平如微管相關蛋白LC3-I轉化為自噬體相關蛋白LC3-II和自噬底物p62的減少來實現(圖1C和D)。雷帕霉素對miR-126-5p具有顯著的核定位作用(圖1F-H)。qPCR證實了雷帕霉素誘導的內源性miR-126-5p的核富集(圖1I)。使ATG5和ATG7沉默或使用a/b 輸入蛋白抑制劑伊維菌素可防止miR-126-5p核積累(圖1J)。用3-甲基腺嘌呤限制自噬降低了KLF2驅動的核miR-126-5p的積累(圖1K)。總之,由KLF2或mTOR抑制觸發的自噬控制著miR-126鏈的運輸,并通過核轉移保留了miR-126-5p。
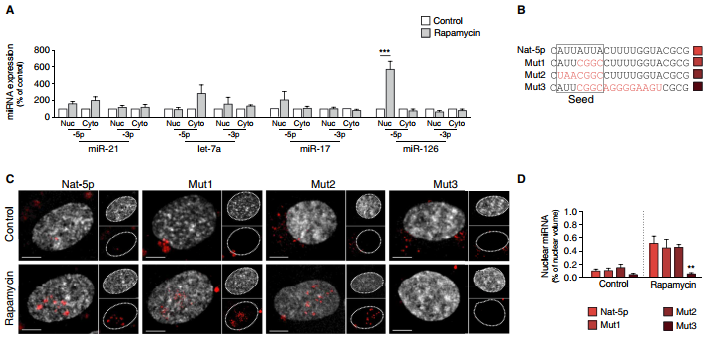
2.miR-126-5p的核轉移需要RNA結合蛋白Mex3a
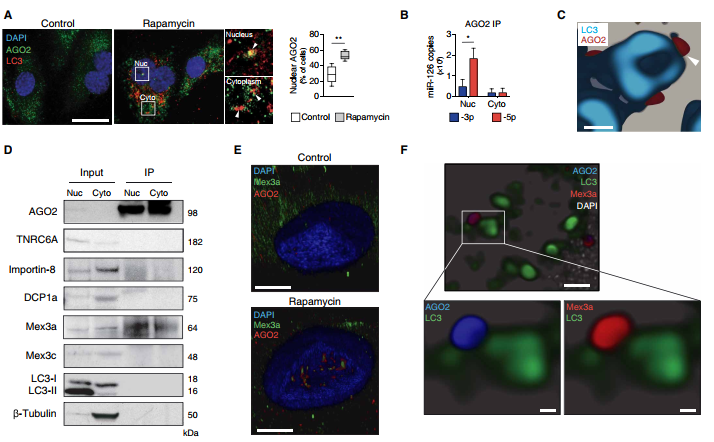
雷帕霉素引起AGO2和LC3的核積累,這被伊維菌素阻斷(圖3A)。 RNA免疫沉淀(IP)證實了miR-126-5p與核AGO2的優先結合(圖3B)。在納米水平上,在雷帕霉素處理的EC中,在外表面而不是在LC3標界的囊腔中可檢測到AGO2(圖3C)。用胰蛋白酶孵育分離的自噬體可劑量依賴性地降低AGO2的量,但不會降低LC3-II的量,因此進一步支持了AGO2在膜外表面的定位。總之,我們的數據支持這樣的概念,即在自噬體表面上AGO2:miR-126-5p復合物會促進核易位。進行了AGO2-IP識別相互作用的蛋白質。盡管兩者相鄰,在雷帕霉素處理過的細胞的AGO2免疫沉淀物中未檢測到LC3,核AGO2導航因子TNRC6A和importin-8也未檢測到(圖3D),因此排除他們的參與。Co-IP揭示了細胞質和細胞核中AGO2和Mex3a的相互作用,這通過自噬EC的共聚焦顯微鏡得到了證實(圖3D和E)。使用受激發射損耗(STED)納米顯微鏡來觀察該復合物,證實了AGO2和Mex3a的共定位信號,而LC3信號僅顯示鄰近性(圖3F)。
3.Mex3a優先與miR-126-5p結合
接下來,證明了Mex3a的RNA結合,這是由兩個K同源(KH)域賦予的。核磁共振(NMR)滴定表明異質串聯KH結構域與miR-126-5p結合,符合亞微摩爾親和力(圖4A)。表面等離子體共振(SPR)證實全長Mex3a與固定的miR-126-5p具有高親和力結合(圖4B)。為了驗證兩個KH域如何發生miR-126-5p結合的結構調節,進行了小角度X射線散射(SAXS),以顯示自由的KH1和KH2串聯域是靈活連接的,類似于線上的珍珠,然而,當它們與miR-126-5p結合時,它們形成了緊湊的結構(圖4C)。使用計算機模型估計的結合自由能(BFE)表明5p鏈比3p鏈優先結合(圖4D),這與NMR滴定的光譜變化減少一致。通過固定的Mex3a上的SPR,等溫滴定量熱法(ITC)和暴露于核裂解液后miR-126鏈的pulldown實驗證實miR-126-5p的優先結合(圖4D)。同樣雷帕霉素處理的內皮細胞中核Mex3a的RNA-IP揭示了miR-126-5p的優先富集(圖4E)。 SPR顯示AGO2:Mex3a相互作用僅在存在miR-126-5p時發生,在固定化或溶液中都表明復合物中三元相互作用的特異結合(圖4F和G)。沉默Mex3a消除了雷帕霉素誘導的AGO2和LC3積累(圖4H)和EC細胞核中miR-126-5p的富集(圖4I)。總之,確定了miR-126-5p:AGO2復合物的核穿梭作用是由Mex3a依賴性過程介導的。
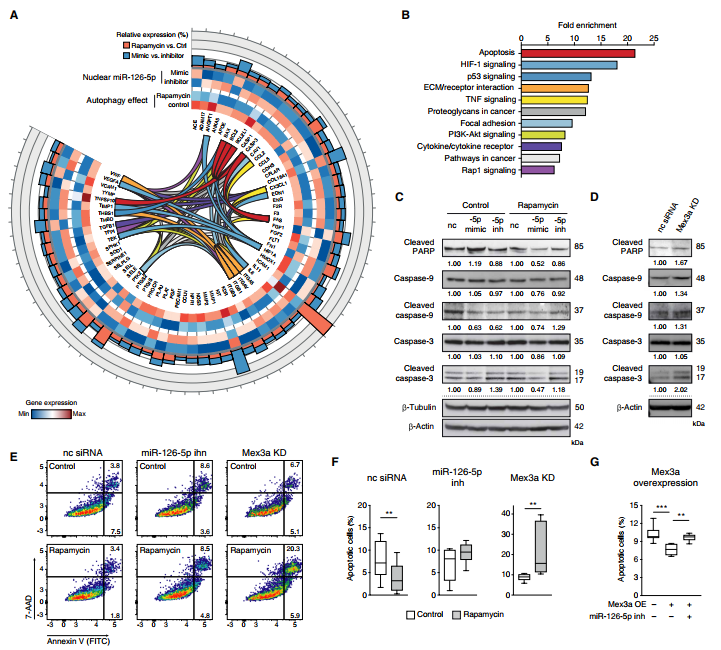
4.核miR-126-5p具有抗凋亡特性
通過研究短期接觸雷帕霉素后miR-126-5p的基因表達變化以及miR-126-5p的功能得失來研究核miR-126-5p轉移的轉錄效應。涉及EC生物學的多個轉錄物的表達發生了變化,分析了雷帕霉素和miR-126-5p模擬物進行一致調節的那些功能注釋(圖5A)。對KEGG途徑富集的分析揭示了對凋亡相關途徑轉錄譜的主要影響(圖5B),所以在蛋白質水平上研究了凋亡介體。 miR-126-5p的過表達僅略微減弱了caspase-3 / 9的表達,但顯著降低了caspase-3的活性形式及其底物的裂解,這一作用需要雷帕霉素的存在來誘導miR-126-5p的核轉移,并且在miR-126-5p抑制后未觀察到(圖5C)。通過Mex3a下調阻止miR-126-5p的核富集會增加caspase-3的裂解物(圖5D)。通過使miR-126-5p或Mex3a沉默可以防止雷帕霉素處理后EC細胞凋亡的減少(圖5E和F)。同樣,miR-126-5p沉默會削弱Mex3a過表達介導的抗凋亡作用(圖5G)。
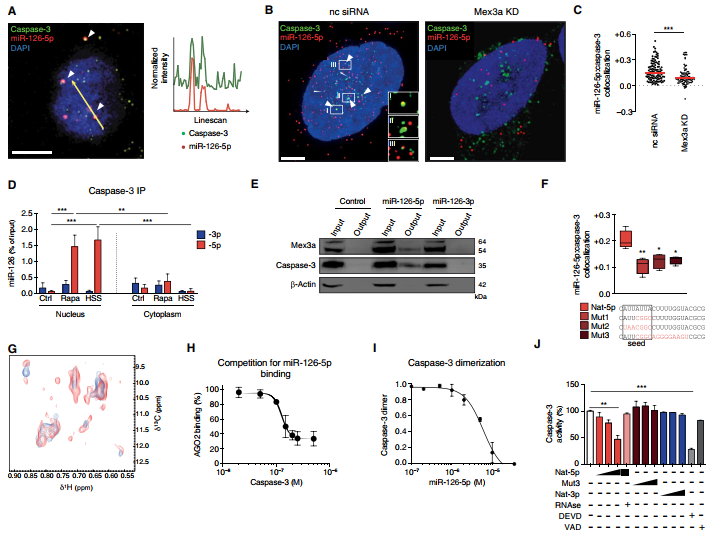
5.與caspase-3的直接相互作用傳達了miR-126-5p的抗凋亡作用
抗凋亡作用在雷帕霉素處理后迅速發生,并且在相關介體中發生轉錄變化,從而推測了miR-126-5p具有抗凋亡特性。因此,測試了與miR-126-5p復合物的潛在相互作用。通過共聚焦顯微鏡獲得的FISH顯示了miR-126-5p和caspase-3的共定位信號,特別是在核和核周區域,并且通過Mex3a下調降低了這種共定位(圖6A-C)。在雷帕霉素處理或HSS條件下RNA-IP顯示出與核caspase-3相關的miR-126-5p顯著富集(圖6D)。使用雷帕霉素處理的EC核提取物中miR-126-5p的pulldown檢測到caspase-3和Mex3a(圖6E)。caspase-3與熒光標記的合成miR-126-5p的共定位可通過部分或完全破壞種子序列(Mut1和Mut2)或更廣泛的突變(Mut3)來降低(圖6F)。加入miR-126-5p后caspase-3甲基信號的實質光譜變化以及加入caspase-3后的RNA信號均表現出兩者直接結合(圖6G)。為了驗證miR-126-5p可以與AGO2解離而與caspase-3結合,對固定的miR-126-5p進行了競爭分析,結果表明caspase-3取代了AGO2與miR-126-5p的結合(圖6H)。SPR揭示了miR-126-5p劑量依賴性地破壞了caspase-3p17亞基的二聚化(圖6I)。在無細胞試驗中,miR-126-5p劑量依賴性地減少重組caspase-3的裂解物,其最大抑制濃度(IC50)與VAD或DEVD的抑制作用相當(圖6J),支持miR-126-5p干擾結合口袋和異二聚體的活性位點形成的觀點。種子序列突變的miR-126-5p(從Mut1到Mut3),miR-126-3p,let-7a-5p,miR-17-5p和miR-21-5p的計量改變對caspase-3無效(圖6J)。總的來說,這些數據表明,在Mex3a引導下的核miR-126-5p與AGO2分離后,可以通過直接抑制caspase-3保護EC不受凋亡的影響。
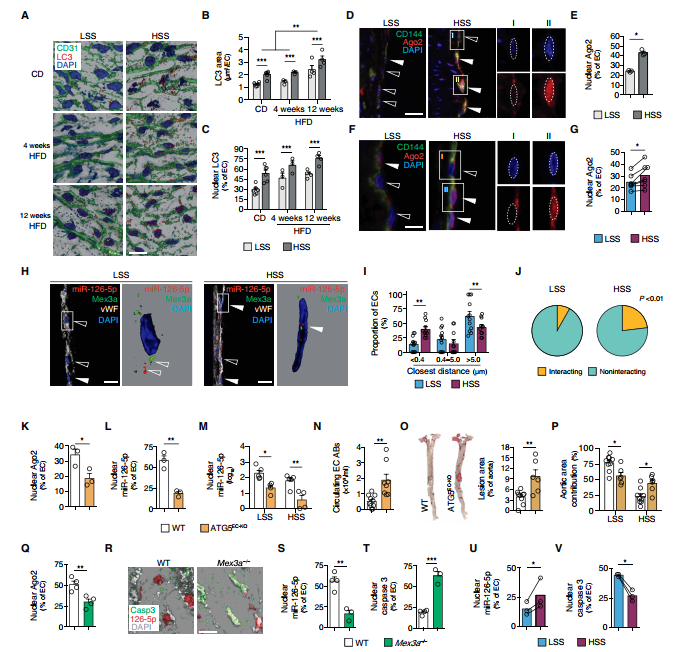
6.miR-126-5p:Mex3a通路在體內和人類疾病中起作用
為了研究自噬驅動途徑與血管疾病相關的體內證據,通過三維(3D)反褶積免疫熒光分析了易患動脈粥樣硬化的Apoe-/-小鼠主動脈中LC3內皮細胞染色模式。 LC3染色在暴露于HSS的區域比LSS的情況更為普遍(圖7A和B)。由于脂蛋白會在體外觸發EC的自噬,因此分析了高脂飲食(HFD)的作用。HFD持續12周即可顯著增加內皮LC3染色(圖7A和B)。此外,在LSS區域,相比于在HSS區域中,LC3的核定位并不普遍并且核Ago2 + EC的百分比則較低(圖7C-E)。非病變的人頸動脈分叉上游(暴露于HSS)的內皮細胞比分叉下游的動脈粥樣硬化區表現出更明顯的核AGO2定位(圖7F和G)。此外,共聚焦反褶積顯微鏡揭示了EC核中Mex3a和miR-126-5p的緊密定位信號(圖7H)。發現在未患病血管區域的EC中,Mex3a和miR-126-5p之間的相互作用距離比覆蓋動脈粥樣硬化病變的EC中的距離低,因此反映了更高的相互作用可能性(圖7I和J)。
使用了內皮自噬缺陷的Apoe-/-Cdh5Cre + Atg5fl / fl(ATG5EC-KO)小鼠進行研究。 HFD 12周后,ATG5EC-KO小鼠的LSS和HSS區域胸主動脈中帶有核Ago2和miR-126-5p信號的EC的百分比和核miR-126-5p含量均低于對照組(圖7K-M)。循環中CD31 +膜聯蛋白V + ABs和miR-126-3p濃度增加表明ATG5EC-KO小鼠EC凋亡增加(圖7N)。由于凋亡破壞了內皮的完整性以促進動脈粥樣硬化的進展,HFD持續12周后,ATG5EC-KO小鼠的動脈粥樣硬化負擔相應增加(圖7O),這是由于HSS區域顯著加重所致(圖7P)。與ATG5EC-KO小鼠相似,具有Mex3a遺傳缺陷的Mex3a-/-小鼠的胸主動脈顯示較少的帶有核Ago2染色的EC(圖7Q),并且原位RNA雜交顯示出miR-126-5p + EC的顯著減少(圖7R和S)。相反,在Mex3a-/-小鼠中,活性形式的caspase-3的核染色增加(圖7T)。在人的頸動脈樣本中,在非患病區域與動脈粥樣硬化區域相比,miR-126-5p和caspase-3的緊密定位信號檢出率更高(圖7U和V)。總體而言,這些數據支持由內皮自噬驅動的核Ago2:Mex-3a:miR-126-5p途徑可在體內發生,以賦予剪切應力依賴性動脈粥樣硬化保護作用。
參考文獻:
Santovito Donato., Egea Virginia., Bidzhekov Kiril., Natarelli Lucia., Mour?o André., Blanchet Xavier., Wichapong Kanin., Aslani Maria., Brun?en Coy., Horckmans Michael., Hristov Michael., Geerlof Arie., Lutgens Esther., Daemen Mat J A P., Hackeng Tilman., Ries Christian., Chavakis Triantafyllos., Morawietz Henning., Naumann Ronald., von Hundelshausen Philipp., Steffens Sabine., Duchêne Johan., Megens Remco T A., Sattler Michael., Weber Christian.(2020). Noncanonical inhibition of caspase-3 by a nuclear microRNA confers endothelial protection by autophagy in atherosclerosis. Sci Transl Med, 12(546), undefined. doi:10.1126/scitranslmed.aaz2294






