強大的青蒿素 新興的鐵死亡 強強聯合發高分
抗瘧藥物Artemisinin及其衍生物已被開發為潛在的抗癌藥物,但其抗癌的潛在機制仍存在爭議。本文旨在探究Artemisinin抗癌的新機制——鐵死亡。本文于2020年1月發表在《Cell death and differentiation》IF:10.717期刊上。
思路流程:
結 果:
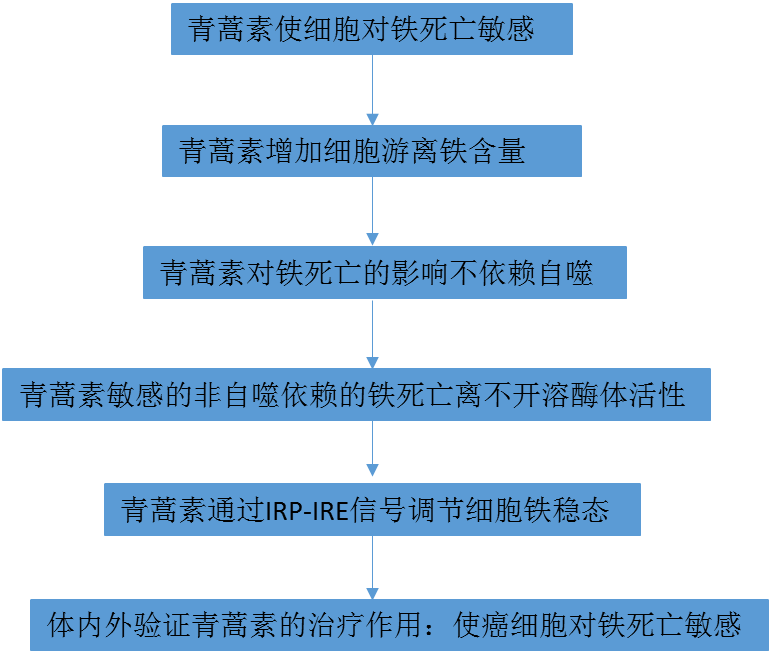
1、ART及其衍生物使細胞對鐵死亡敏感
ART化合物中內過氧化物與生物鐵的反應性使作者開始研究這些化合物是否能調節鐵死亡,一種鐵依賴的細胞死亡方式。在小鼠胚胎成纖維細胞(MEFs)和人類骨肉瘤HT1080細胞中,作者發現多種ART化合物(圖1A)。并且所有ART化合物均以時間和劑量依賴的方式使細胞對半胱氨酸饑餓(STV)誘導的鐵死亡敏感(圖1B,C)。作為所有ART化合物的活性代謝物,DAT對STV誘導的鐵蛋白作用最敏感。因此,作者著重探究DAT對鐵死亡的作用。對于erastin和RSL3,細胞死亡的強度與脂質過氧化物的產生相關(圖1E),證實了觀察到的細胞死亡是鐵死亡。隨后,我們研究了DAT致敏鐵蛋白作用的分子基礎。
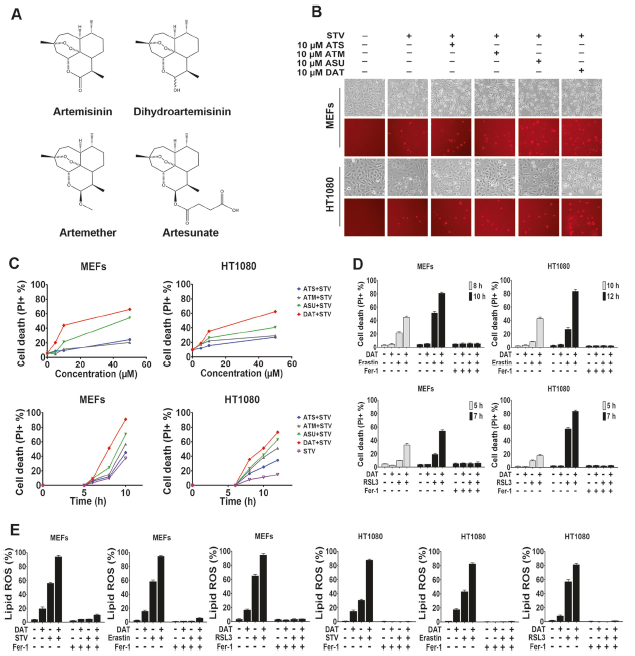
圖1Artemisinin及其衍生物使細胞對鐵死亡敏感
2、DAT增加細胞游離鐵含量,但對細胞谷胱甘肽無影響
鐵死亡是鐵依賴的細胞死亡方式,因此探究了DAT是否影響細胞內GSH和鐵的水平。如所示,Erastin誘導導致細胞GSH水平顯著下降(圖2a),然而,DAT本身或存在erastin時對細胞GSH水平沒有影響(圖2a)。另一方面,無論是單獨使用還是與erastin結合,DAT都導致了細胞中游離鐵含量的增加,鐵含量被量化為細胞LIP(圖2b)。如預期的,鐵螯合劑去鐵胺(DFO)完全抑制了由erastin單獨或與DAT聯合引起的鐵螯作用(圖2c)。這表明,DAT對鐵死亡致敏作用的影響是由于細胞內不穩定鐵含量的增加,而不是細胞內谷胱甘肽水平的增加。
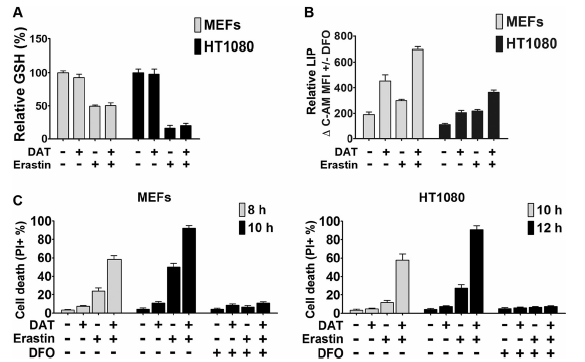
圖2 DAT增加細胞游離鐵含量,但對細胞谷胱甘肽無影響
3、DAT對鐵死亡的影響不依賴自噬
此前有報道,自噬通過降解細胞內鐵儲存蛋白的鐵蛋白,增加細胞內不穩定鐵的含量,從而促進鐵死亡。有趣的是,ART已經被證明可以刺激自噬,鑒于這些研究以及上述結果中DAT可以促進細胞對鐵死亡的敏感,因此,作者進一步探究DAT是否通過自噬依賴的方式促進鐵死亡。
結果發現,溶酶體抑制劑巴弗洛霉素A1(bafA1)進一步增加了LC3-II的產量和GFP-LC3斑點的形成,但阻止了p62的降解(圖3a, b)。然而,無論是單獨使用還是與erastin聯合使用(圖3a, b),當濃度為10μM時,DAT均未引起自噬通量的增加,而該濃度下DAT可以顯著增加細胞對鐵死亡的敏感(圖1)。隨后在自噬必需基因Atg5基因敲除(Atg5- ko)實驗中得出了類似的結果。因此,上述表明DAT對鐵死亡的影響是一種非自噬依賴的方式。
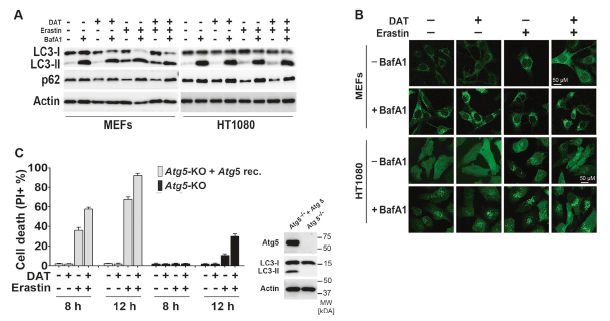
圖3 DAT不影響自噬通量,并通過一種不依賴自噬的機制使細胞對鐵死亡敏感
4、溶酶體活性對于DAT敏感的非自噬依賴的鐵死亡是必需的
與DAT在鐵死亡中的自噬獨立作用一致的是,在自噬缺陷MEFs (Atg5-KO)中,DAT增加了Atg5-KO 的LIP,而erastin僅增加了自噬補充MEFs的LIP (圖4a)。有趣的是,在自噬狀態和自噬缺陷狀態下,溶酶體抑制劑BafA1抑制了由erastin和DAT引起的LIP的增加(圖4a)。此外,無論是自噬狀態的MEFs還是自噬缺陷的MEFs, BafA1都抑制了erastin單獨或與DAT聯合誘導的鐵蛋白作用(圖4b)。
隨后,作者研究了erastin和DAT單獨或聯合作用對細胞鐵蛋白水平及其自噬貨物受體Ncoa4的影響。在自噬補充的MEFs中,erastin刺激了Ncoa4水平的溶酶體降解,而BafA1阻止了Ncoa4水平的降解,而細胞中的鐵蛋白水平沒有被erastin顯著改變(圖4c)。另一方面,DAT誘導溶酶體降解的鐵蛋白同時發生在自噬補充和自噬缺陷的MEF中,而DAT對鐵蛋白的影響與溶酶體的Ncoa4降解無關(圖4 c),表明DAT可以誘導鐵蛋白溶酶體降解,使細胞游離鐵濃度增加,從而使細胞對鐵死亡敏感,以自噬和Ncoa4非依賴的方式。
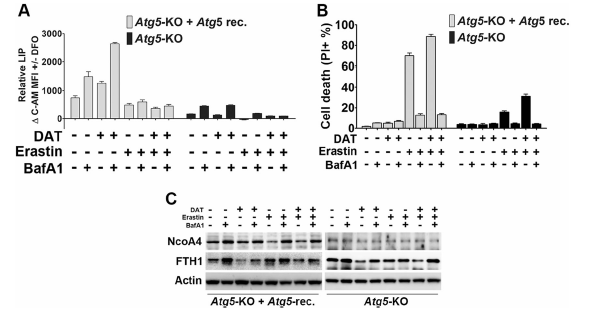
圖4溶酶體活性對于DAT敏感的非自噬依賴的鐵死亡是必需的
5、DAT通過IRP-IRE信號調節細胞鐵穩態
據文獻報道,IRP和IRE是調控細胞內鐵含量的重要蛋白,因此,為了定量測量DAT和erastin對IRP-IRE信號通路的潛在影響,使用了兩個報告質粒,如圖5a所示,探究IRE/IRP相互作用和erastin或DAT對鐵蛋白翻譯調控。其中一個質粒以熒光素酶為讀出器(5 IRE-Luc- IRES-GFP),另一個質粒以mCherry為讀出器(5 IRE-mCherry-IRES-GFP)。
如圖5b所示,在具有穩定熒光素酶報告基因的MEFs中,DAT處理降低了熒光素酶/GFP比率,而erastin處理提高了Luc/GFP比率;DAT處理后mCherry的熒光比率也有一致地變化趨勢。觀察到的erastin對IRP-IRE信號傳導的影響的分子基礎(圖5b, c)大體如下:通過刺激自噬溶酶體降解鐵蛋白,erastin導致LIP的增加,進而降低IRP-IRE的親和力,導致鐵蛋白合成的增加。隨后體外監測MDA生成過程,這是一種由亞鐵離子和抗壞血酸催化的脂質過氧化反應(圖5d)。如圖5e所示,DAT雖然足以與反應體系中的所有亞鐵離子復合,但并不抑制脂質過氧化。因此,與DAT相關的鐵維持催化超氧化反應的能力,就像自由亞鐵離子一樣。
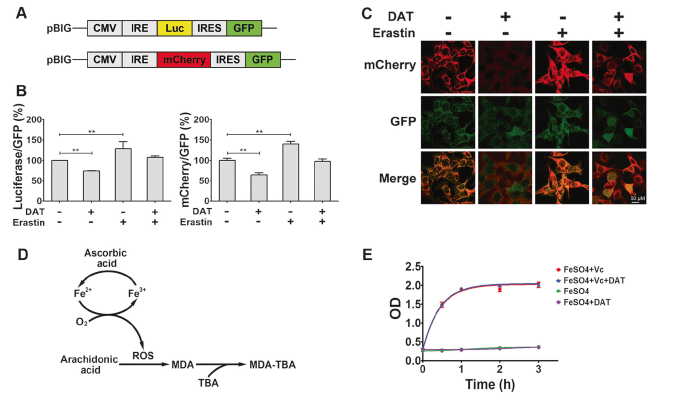
圖5 DAT通過IRP-IRE信號調節細胞鐵穩態
6、DAT使癌細胞對鐵死亡敏感,具有治療作用
考慮到DAT能使細胞對GPX4抑制劑RSL3誘導的鐵死亡敏感,作者進一步測試DAT是否能使這些原本對鐵死亡耐藥的癌細胞對GPX4的抑制更敏感。如圖6a所示,使用不同濃度的RSL3處理不同類型腫瘤來源的細胞系。結果發現,與對RSL3敏感的MEFs和HT1080細胞相比,本試驗中RSL濃度最高時,誘導這些癌細胞的鐵死亡和脂質過氧化作用也大大降低(圖6a)。重要的是,DAT以鐵死亡敏感的方式顯著提高了這些細胞對RSL3誘導的細胞死亡和脂質過氧化的敏感性(圖6b, c)。
為了進一步研究該結論,進行小鼠體內模型實驗。人H292肺癌細胞,對GPX4抑制抵抗,以Dox誘導的方式介導CRISPR/Cas9-介導的H292肺癌細胞GPX4敲除(圖6a)。Western blot證實Dox處理后H292細胞中GPX4敲除的效率(圖6d)。如預期的,當GPX4被敲除時,細胞死亡和脂質ROS生成水平較低,而這兩者都被DAT以鐵死亡敏感的方式增強(圖6d)。隨后,通過皮下接種含有可誘導GPX4敲除的H292細胞的裸鼠進行了體內異種移植實驗。如圖6e g所示,喂食Dox飼料的小鼠腫瘤中GPX4的表達顯著降低。與對照組小鼠(-Dox-DAT)相比,服用Dox或單獨服用DAT的小鼠腫瘤生長略有下降。綜上所述,這些結果表明DAT可用于提高GPX4靶向治療的效果,特別是對GPX4抑制耐藥的腫瘤。

圖6在體內和體外,DAT增加脂質ROS,使癌細胞對鐵死亡作用敏感
總之,相對低劑量的鐵死亡誘導劑,有望能被正常組織接受,并可能對這些癌癥的治療有效。施用DAT使癌細胞對鐵死亡進一步敏感,可縮短治療時間,提高療效。上述發現可用于臨床,以增強未來鐵死亡誘導癌癥治療的效果,為今后腫瘤臨床治療提供新的策略。
參考文獻:
Chen Guo-Qing., Benthani Fahad A., Wu Jiao., Liang Deguang., Bian Zhao-Xiang., Jiang Xuejun.(2020). Artemisinin compounds sensitize cancer cells to ferroptosis by regulating iron homeostasis. Cell Death Differ., 27(1), 242-254. doi:10.1038/s41418-019-0352-3






