DNA甲基化通過激活lncRNA SNHG12促進成膠質細胞瘤的替莫唑胺耐藥性
替莫唑胺(temozolomide, TMZ)是目前腦膠質瘤臨床一線化療藥物,結合放療可部分延長新診斷膠質瘤患者的生存時間。美國國立綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)指南已把手術、放療和替莫唑胺化療作為新診斷膠質瘤患者的標準治療方案,此方案使得患者的平均生存時間從單獨放療的12.1 個月提高到14.6 個月,五年的存活率為9.8%。腦膠質瘤的化療效果受限于替莫唑胺化療耐藥,腫瘤經常治療后迅速復發,使得腦膠質瘤的治療成為目前醫學難題之一。
長鏈非編碼RNA(long noncoding RNA,lncRNA)是一類轉錄本長度大于200nt,不具有蛋白編碼功能的非編碼RNA。近年研究發現,lncRNA 可在染色體修飾、轉錄及轉錄后水平參與基因的表達調控,影響細胞的增殖、分化和凋亡,介導腫瘤的發生、發展、侵襲遷移等生物學行為。LncRNA與腦膠質瘤的發生發展密切相關,參與腦膠質瘤的起源、生長、侵襲等,影響腦膠質瘤患者預后,并通過多種途徑調節DNA 甲基化、組蛋白修飾和染色質重構等,在腦膠質瘤惡性進展過程中發揮重要作用。ceRNA網絡參與某些癌癥術后抗藥性的介導,但很少報道其在TMZ抗藥性中的作用。
近日,來自南京醫科大學附屬第一醫院神經外科南京醫科大學江蘇省癌癥個性化醫學協同創新中心江蘇省癌癥生物標志物,預防與治療重點實驗室,南京醫科大學江蘇省腫瘤生物標志物,預防與治療重點實驗室,江蘇省腫瘤個人醫學協同創新中心魏艷&游永平課題組在Mol Cancer 發表題為DNA-methylation-mediated activating of lncRNA SNHG12 promotes temozolomide resistance in glioblastoma的研究,報道了lncRNA SNHG12(小核仁RNA宿主基因12)在GBM中獲得性TMZ抗性中的作用以及表觀遺傳調控對其異常表達的影響。
研究人員通過qRT-PCR和原位雜交法檢測在TMZ敏感和TMZ耐藥的GBM細胞和組織中的檢測SNHG12的表達水平。通過體外實驗(western blots,菌落形成,流式細胞術和TUNEL實驗)檢測SNHG12對TMZ耐藥性的影響。通過生物信息學分析,BSAS測序以及甲基化特異性PCR,雙熒光素酶報告基因,染色質免疫沉淀測定,RNA免疫沉淀測定,免疫熒光,qRT-PCR和Western blots實驗確定SNHG12在TMZ耐藥細胞中高表達的機制及其與miR-129-5p,MAPK1和E2F轉錄因子7(E2F7)的關系。然后研究人員利用顱內移植瘤小鼠模型來研究SNHG12的功能。
研究人員發現在TMZ耐藥細胞和組織中,SNHG12表達上調。過表達SNHG12可使細胞TMZ耐藥,而抑制SNHG12恢復了TMZ敏感性。研究人員進一步發現在SNHG12啟動子區域DNA甲基化水平異常低,DNA甲基化缺失使該區域易被Sp1轉錄因子(Sp1)控制; 這表明DNA甲基化和SP1共同調控SNHG12的表達。在細胞質中,SNHG12充當miR-129-5p的海綿,導致MAPK1和E2F7上調,使GBM細胞具有TMZ抗性。MAPK1的去抑制作用通過激活MAPK/ERK通路來調節TMZ誘導的細胞凋亡和G1/S細胞周期轉變,而E2F7的失調主要與G1/S細胞周期轉變有關。在臨床上,SNHG12過表達與GBM患者TMZ治療后生存期差有關。
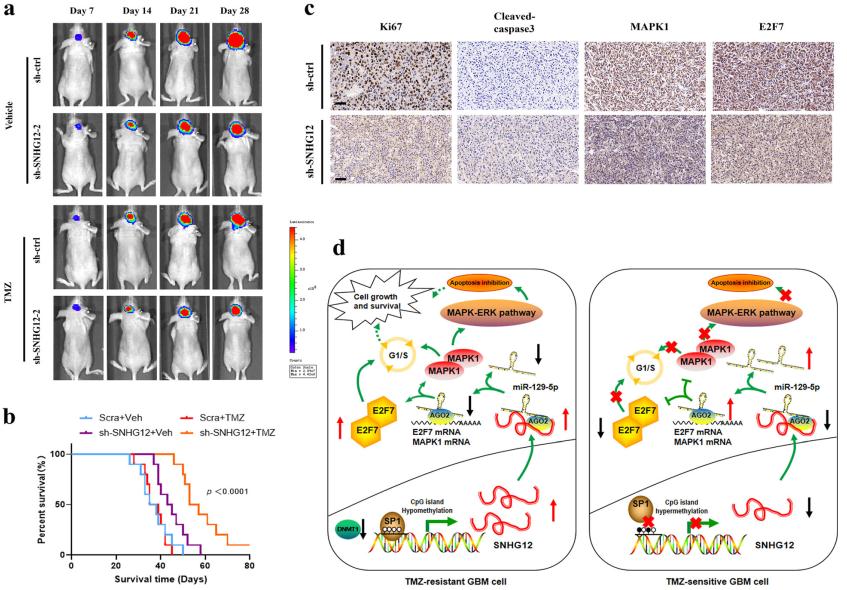
總的來說,研究人員發現SNHG12在TMZ耐藥GBM細胞系和組織中高表達;SNHG12基因敲除可在體外恢復TMZ耐藥GBM細胞的TMZ敏感性;SNHG12過表達可抵抗TMZ;DNA甲基化和SP1共同調控SNHG12的表達;SNHG12充當miR-129-5p的海綿;在促進細胞增殖和抑制細胞凋亡中發揮重要作用,從而增加MAPK1和E2F7的表達,激活MAPK-ERK通路;MAPK1和E2F7在SNHG12介導的替莫唑胺抗性中發揮不同的作用;敲除SNHG12可在體內恢復TMZ敏感性。此外,研究人員還發現SNHG12在臨床中與較差的總生存率和藥物敏感性相關。因此,SNHG12是一種有前途的預后生物標志物,是治療GBM耐藥的潛在治療靶點。






