神經(jīng)母細(xì)胞瘤的有效療法——靶向抑制circ-CUX1
好氧糖酵解是腫瘤進(jìn)展中代謝重編程的一個(gè)標(biāo)志。然而,調(diào)節(jié)糖酵解基因表達(dá)的機(jī)制在兒童最常見的顱外惡性腫瘤神經(jīng)母細(xì)胞瘤(NB)中仍不清楚。從此研究背景出發(fā),本文作者發(fā)現(xiàn)CUT-like homeobox 1 (CUX1) 和CUX1-generated circular (circ-CUX1)有助于有氧糖酵解和NB的進(jìn)展。而阻斷circ-CUX1級聯(lián)可以有效抑制NB的體內(nèi)體外進(jìn)展。本文于2019年12月新近發(fā)表在EMBO Mol Med (IF: 10.624)期刊上。
結(jié)果如下:
1、CUX1促進(jìn)好氧糖酵解和腫瘤進(jìn)展
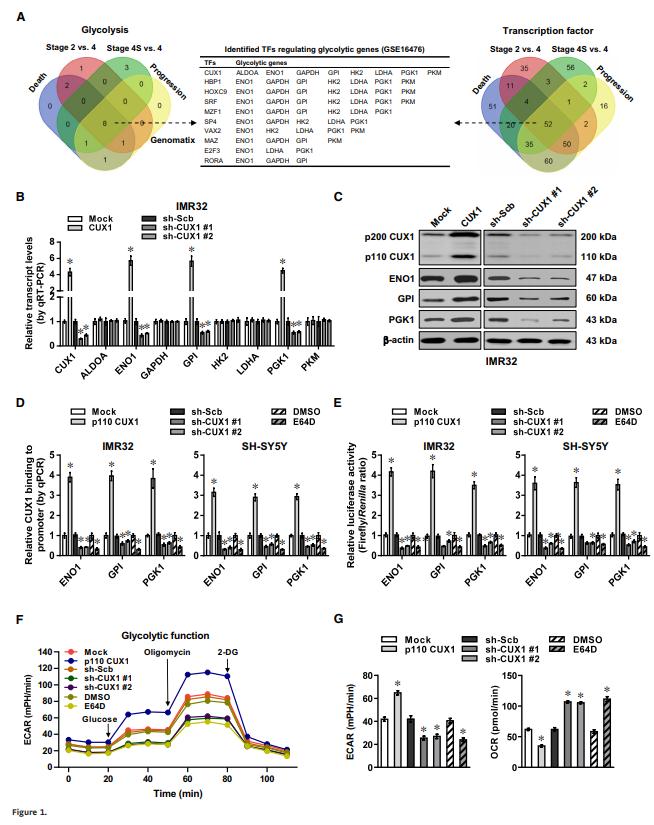
對88例NB患者的微陣列數(shù)據(jù)進(jìn)行綜合分析獲得了8個(gè)差異表達(dá)的糖酵解基因,并發(fā)現(xiàn)了52個(gè)與NB臨床表現(xiàn)相關(guān)的轉(zhuǎn)錄因子,這52個(gè)轉(zhuǎn)錄因子與這8個(gè)糖酵解基因的轉(zhuǎn)錄因子存在重疊,其中CUX1是潛在靶點(diǎn)數(shù)量最多的轉(zhuǎn)錄因子(Fig 1A)。異位表達(dá)CUX1可以相應(yīng)的增減或減少糖酵解相關(guān)基因的表達(dá),如ENO1、GP1和PGK1,其他基因的表達(dá)則不受影響(Fig 1B-E)。過表達(dá)p110 CUX1增加了細(xì)胞的胞外酸化率(ECAR),降低了細(xì)胞的耗氧率(OCR),而CUX1敲低或E64D處理顯著減弱了糖酵解過程(圖1F和G)。以上結(jié)果說明CUX1是一種促進(jìn)好氧糖酵解和腫瘤進(jìn)展的轉(zhuǎn)錄因子。
2、Circ-CUX1在NB組織和細(xì)胞系中表達(dá)上調(diào)
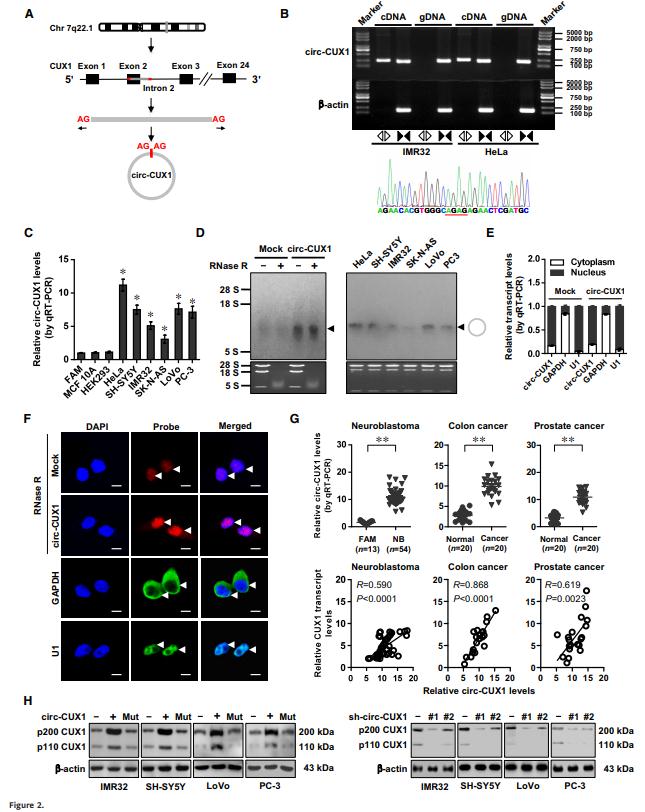
如圖2所示,circ-CUX1是由CUX1的外顯子2和部分內(nèi)含子2組成的393-nt環(huán)狀CUX1,定位于細(xì)胞核,并在NB和其細(xì)胞系中均高表達(dá)。此后,作者經(jīng)實(shí)驗(yàn)證實(shí)circ-CUX1在轉(zhuǎn)錄水平上增強(qiáng)CUX1的表達(dá)。
3、Circ-CUX1在腫瘤進(jìn)展中發(fā)揮致癌作用
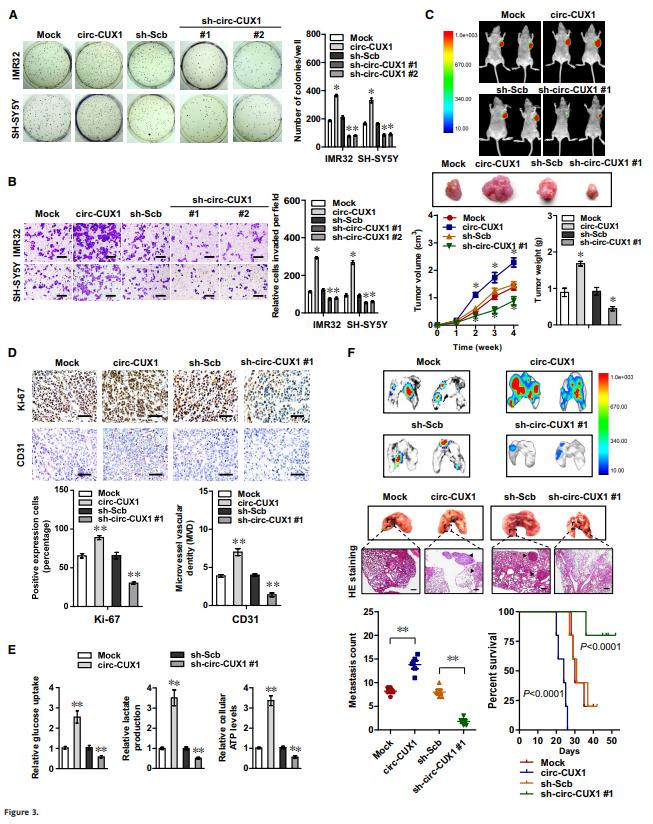
如圖3所示,過表達(dá)circ-CUX1促進(jìn)了體外腫瘤細(xì)胞的集落形成、遷移和侵襲,促進(jìn)體內(nèi)腫瘤的生長,肺部轉(zhuǎn)移以及腫瘤Ki-67和CD31表達(dá)、葡萄糖攝取、乳酸產(chǎn)生、ATP水平。這些結(jié)果表明circ-CUX1在腫瘤的發(fā)生和侵襲性中發(fā)揮著致癌作用。
4、Circ-CUX1與NB細(xì)胞中的EWSR1蛋白直接相互作用
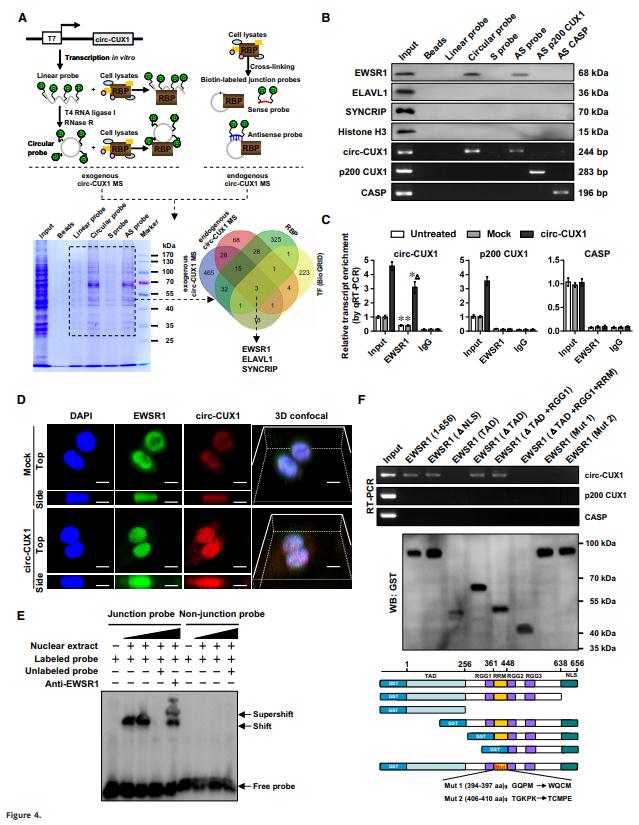
圖4A是作者尋找circ-CUX1相互作用蛋白的方法示意圖,據(jù)此找到3個(gè)潛在蛋白:EWSR1,ELAVL1和SYNCRIP。pull-down實(shí)驗(yàn)在未轉(zhuǎn)染的細(xì)胞中只能檢測到內(nèi)源性和外源性circ-CUX1,以及EWSR1與circ-CUX1復(fù)合物,而另外兩個(gè)蛋白或者相互作用均未能檢測到(Fig 4B)。
進(jìn)一步證實(shí)circ-CUX1和EWSR1存在相互作用及共定位(Fig 4C-D),以及RNA電泳遷移率檢測和GST標(biāo)記證實(shí)EWSR1蛋白與circ-CUX1相互作用,且是與的RNA識別基序(RRM)域而不是與p200 CUX1或CASP轉(zhuǎn)錄本相互作用(Fig 4E-F)。以上結(jié)果表明circ-CUX1與EWSR1蛋白在NB細(xì)胞直接相互作用。
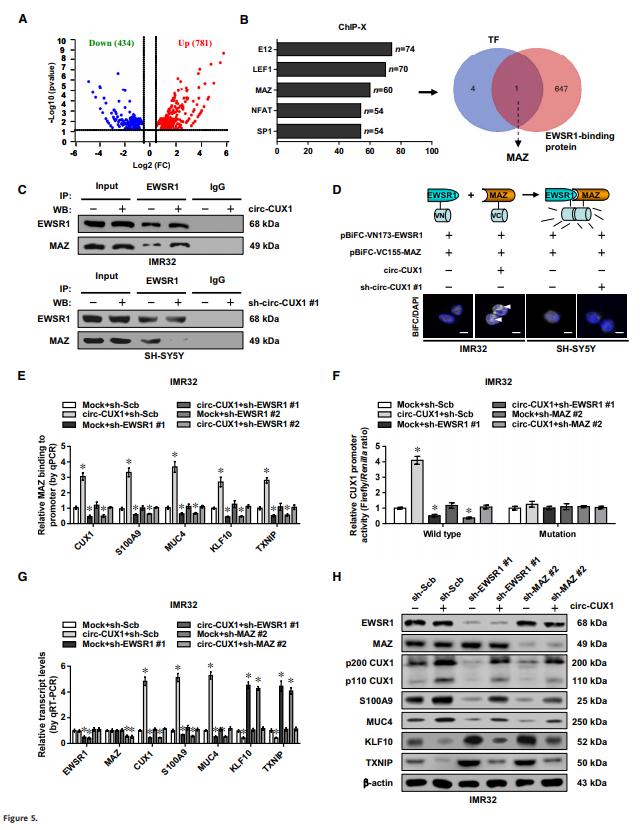
5、Circ-CUX1促進(jìn)了EWSR1介導(dǎo)的MAZ活化
為進(jìn)一步研究circ-CUX1的靶基因,作者進(jìn)行了RNA-seq,發(fā)現(xiàn)過表達(dá)circ-CUX1后,IMR32細(xì)胞中有781個(gè)上調(diào)基因和434個(gè)下調(diào)基因(Fig 5A)。從中篩選到5個(gè)差異顯著的轉(zhuǎn)錄因子,然后從BioGRID數(shù)據(jù)庫中提取的與EWSR1相互作用的蛋白做進(jìn)一步的重疊分析,發(fā)現(xiàn)MAZ蛋白是參與這一過程的唯一轉(zhuǎn)錄因子(Fig 5B)。此外,標(biāo)記MAZ的鋅指結(jié)構(gòu)域與EWSR1的相互作用是必需的,但不是N端或C端。實(shí)驗(yàn)發(fā)現(xiàn),circ-CUX1的過表達(dá)或敲除相應(yīng)增加或減少了IMR32和SH-SY5Y細(xì)胞中EWSR1和MAZ的相互作用(Fig 5C和D)。
在IMR32和SH-SY5Y細(xì)胞中,circ-CUX1的過表達(dá)或敲除相應(yīng)增強(qiáng)和減少了MAZ與這5個(gè)靶基因啟動(dòng)子的結(jié)合,而當(dāng)EWSR1的沉默或過表達(dá)則可以消除這些作用(Fig 5E)。熒光素酶實(shí)驗(yàn)顯示野生型CUX1,MAZ結(jié)合位點(diǎn)的啟動(dòng)子活性受circ- CUX1異位表達(dá)或敲低的影響而升高或降低,而突變型則不受影響(Fig 5F)。此外,穩(wěn)定轉(zhuǎn)染circ-CUX1或shcirc-CUX1#1的IMR32和SH-SY5Y細(xì)胞中CUX1,S100A9,MUC4,KLF10或TXNIP的水平發(fā)生了顯著變化(Fig 5G和H)。敲除或過表達(dá)EWSR1或MAZ可挽救腫瘤細(xì)胞的這些變化(Fig 5F-H)。這些數(shù)據(jù)表明,circ-CUX1促進(jìn)了NB細(xì)胞中EWSR1介導(dǎo)的MAZ反式激活和靶基因的轉(zhuǎn)錄改變。
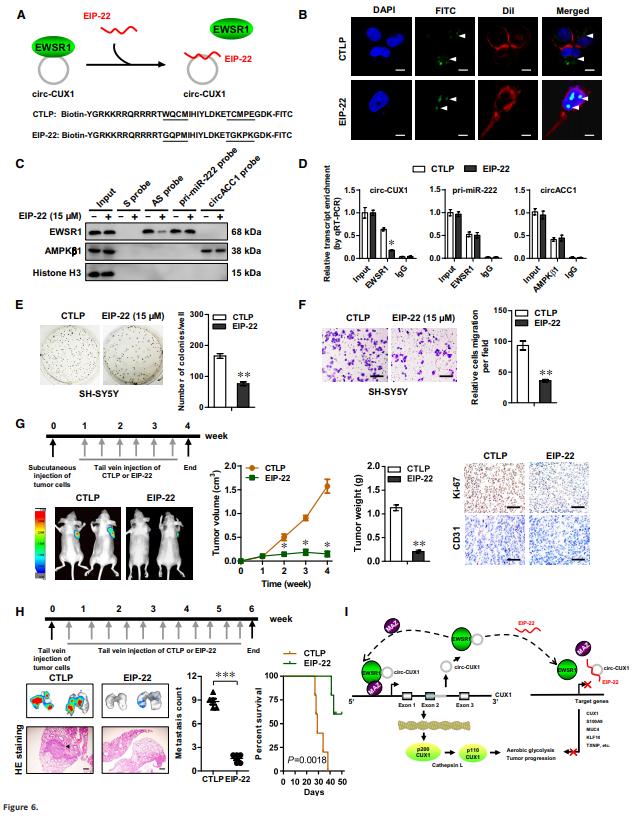
6、治療肽阻斷circ-CUX1-EWSR1相互作用
作者基于EWSR1的RRM結(jié)構(gòu)域在與circ-CUX1相互作用中的重要性設(shè)計(jì)了一種可穿透細(xì)胞的肽,即EWSR1抑制肽(EIP-22) ,可以阻止circ-CUX1-EWSR1交互作用(Fig 6A)。 用EIP-22處理SH-SY5Y細(xì)胞導(dǎo)致其在細(xì)胞核內(nèi)明顯聚集(Fig 6B)。此外,EIP-22處理減少了circ-CUX1和EWSR1之間的相互作用,但不減少pri-miR-222和EWSR1之間的相互作用或circACC1和AMP激活的蛋白激酶1的相互作用(Fig 6C和D)。施用EIP-22可抑制SH-SY5Y細(xì)胞的活力、增殖和侵襲(Fig 6E和F),同時(shí)改變circ-CUX1下游基因表達(dá)。
靜脈內(nèi)施用EIP-22可顯著降低小鼠皮下異種移植腫瘤的生長、重量,Ki-67增殖指數(shù)和CD31陽性微血管,改變circ-CUX1目標(biāo)基因的表達(dá),并降低葡萄糖攝取,乳酸鹽產(chǎn)生和ATP水平(Fig 6G)。此外,施用EIP-22可減少小鼠肺轉(zhuǎn)移量,并延長裸鼠的存活時(shí)間(Fig 6H)。這些數(shù)據(jù)表明,EIP-22通過阻止circ-CUX1-EWSR1相互作用來抑制NB進(jìn)程。
之后,作者進(jìn)一步驗(yàn)證了circ-CUX1敲除對異種移植腫瘤裸鼠的治療效果,結(jié)果顯示裸鼠的腫瘤重量和大小,Ki-67增殖指數(shù)和CD31陽性微血管都下降了,并改變了circ-CUX1目標(biāo)基因的表達(dá),此外,小鼠的葡萄糖攝取,乳酸鹽產(chǎn)生,ATP水平,肺部轉(zhuǎn)移都顯著下降。以上表明,在小鼠體內(nèi),慢病毒介導(dǎo)的circ-CUX1敲低可抑制好氧糖酵解和NB的進(jìn)展。
總之,本文確定了CUX1為轉(zhuǎn)錄因子,可促進(jìn)NB中糖酵解基因ENO1,GPI和PGK1的表達(dá)。證明circ-CUX1與EWSR1蛋白相互作用以增加MAZ反式激活,后者隨后調(diào)節(jié)CUX1和其他與順式和反式與腫瘤進(jìn)展相關(guān)的基因的轉(zhuǎn)錄(Fig 6I),例如S100A9、MUC4、KLF10和TXNIP。本文中circ-CUX1 / EWSR1 / MAZ軸的發(fā)現(xiàn)代表了對腫瘤進(jìn)行治療性干預(yù)前進(jìn)了有希望的一步。
參考文獻(xiàn):
Li Huanhuan., Yang Feng., Hu Anpei., Wang Xiaojing., Fang Erhu., Chen Yajun., Li Dan., Song Huajie., Wang Jianqun., Guo Yanhua., Liu Yang., Li Hongjun., Huang Kai., Zheng Liduan., Tong Qiangsong.(2019). Therapeutic targeting of circ-CUX1/EWSR1/MAZ axis inhibits glycolysis and neuroblastoma progression. EMBO Mol Med, 11(12), e10835. doi:10.15252/emmm.201910835






